
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Учебное пособие: Фуран. Тиофен. Пиррол
Учебное пособие: Фуран. Тиофен. Пиррол
Введение
1. Фуран
1.1. Получение
1.2. Свойства
2. Тиофен
2.1. Получение
2.2. Свойства
3. Пиррол
3.1. Получение
3.2. Свойства
3.2.1. Кислотно-основные свойства
3.2.2. Реакции электрофильного замещения
3.2.3. Восстановление
Введение
Гетероциклическими называют соединения, содержащие циклы, включающие один или несколько гетероатомов. Наиболее устойчивыми являются пяти- и шестичленные циклы.
Гетероциклические соединения встречаются во многих природных соединениях и производятся в больших масштабах в промышленности. В данной главе мы будем рассматривать главным образом гетероциклические соединения, обладающие ароматическим характером. Такие гетероциклы называют гетероароматическими.
Существуют пятичленные, шестичленные и т.д. гетероциклы, обладающие ароматическим характером. Наиболее изученными из них являются пяти- и шестичленные соединения, поскольку их производные особенно распространены в природе и часто являются промышленными продуктами. В циклы этих соединений могут входить один, два и большее количество гетероатомов, причем как одинаковых, так и разных. Большинство из них имеют традиционные названия.
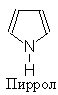
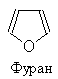 |
|||
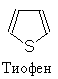 |
|||
Большое значение имеют такие соединения, в которых указанные гетероциклы сконденсированы с другими кольцами.
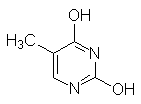
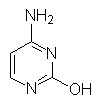
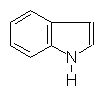
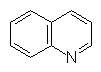
Урацил Тимин Цитозин Индол Хинолин
1. Фуран
1.1. Получение
Наиболее доступным производным фурана является фурфурол. Его получают из растительных отходов, содержащих пентозаны, обработкой их разбавленной серной кислотой с последующей перегонкой с водяным паром.
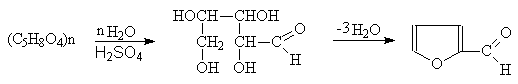 (26)
(26)
Пентозаны Пентоза Фурфурол
Каталитическим декарбоксилированием фурфурола получают фуран:
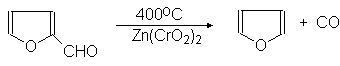 (27)
(27)
Фурфурол Фуран
1.2. Свойства
Фуран проявляет ацидофобные свойства. При действии концентрированной серной кислоты он полимеризуются. Разбавленные кислоты вызывают гидролитическое расщепление кольца с образованием 1,4-дикарбонильных соединений.
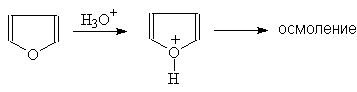 (28)
(28)
Фуран вступает в обычные для ароматических соединений реакции электрофильного замещения, причем легче, чем бензол.
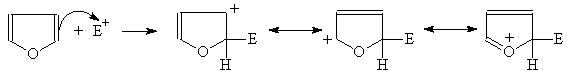
(М 3)
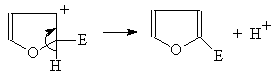
При атаке электрофила по b-положению образуется катион, в котором положительный заряд делокализуется лишь на два атома, в то время как при атаке по a-положению – на три:
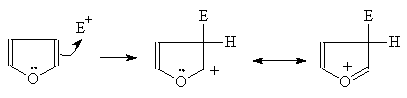
Они проходят также легко, как и в фенолах, но проводить их следует лишь в нейтральной и щелочной среде. Так, действие галогенидов в спиртовых растворах приводит к полному замещению атомов водорода:
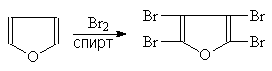
(29)
Моногалогенпроизводные фурана можно получить лишь через меркуропроизводные, из которых получают также многие другие монопроизводные:
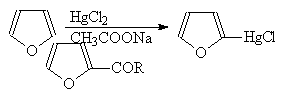 |
 |
||
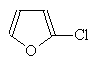
Нитрование фурана проводится ацетилнитратом в пиридине, а сульфирование -- комплексом триоксида серы с пиридином.
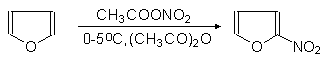 (33)
(33)
a-Нитрофуран
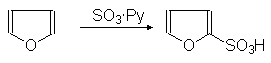 (34)
(34)
a-Фурансульфокислота
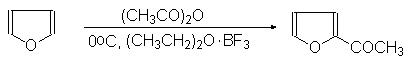
(35)
Фуран a-Ацетилфуран
Фуран ведет себя как 1,3-диен в реакциях диенового синтеза:
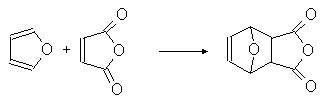 (36)
(36)
Упр.10. Составьте схему реакции получения фурфурола из пентозанов.
Упр.11. Напишите реакции фурана с веществами:
(а) пиридинсульфотриоксидом, (б) ацетилнитратом, (в) уксусным ангидридом,
(г) бромом. Опишите механизмы этих реакций? Почему фуран нельзя сульфировать серной кислотой и ацилировать хлористым ацетилом.
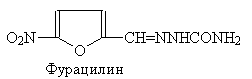 Семикарбазоном 5-нитрофурфурола
является фурацилин - средство для полоскания горла.
Семикарбазоном 5-нитрофурфурола
является фурацилин - средство для полоскания горла.
2. ТИОФЕН
Тиофен содержится в каменноугольной смоле и является спутником коксохимического бензола (присутствует в количестве 0,5%). По ряду физических и химических свойств тиофен очень близок к бензолу: температура кипения тиофена 84оС, бензола 80оС; запах чистого тиофена напоминает запах бензола, очень близка их склонность к реакциям нуклеофильного замещения. Тиофен - наиболе аромаатический из пятичленных гетероциклов.
2.1. Получение
В промышленности тиофен производят по реакции ацетилена с сероводородом при 400оС или из н-бутана и серы в газовой фазе:
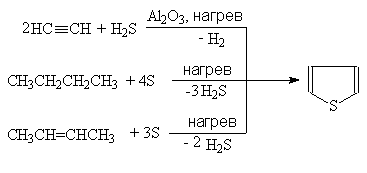
(37)
2.2. Свойства
Тиофен, в отличие от фурана и пиррола, не дает с обычными кислотами тиониевых солей и, следовательно, в кислой среде не утрачивает ароматических свойств. Он не обладает ацидофобностью.
Тиофен легко вступает в характерные для ароматических соединений реакции электрофильного замещения. Механизм этих реакций аналогичен механизму соответствующих реакций фурана:
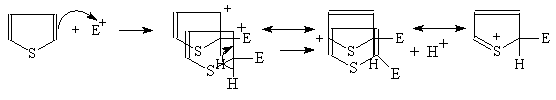
(М 4)
Поскольку тиофен, в отличие от фурана, не чувствителен к воздействию кислот, эти реакции могут осуществляться в присутствии протонодонорных реагентов. Нужно иметь в виду, что атом серы может быть окислен азотной кислотой. Поэтому тиофен нельзя нитровать азотной кислотой, а только ацетилнитратом.
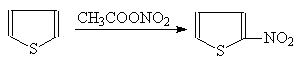 (38)
(38)
Тиофен a-Нитротиофен
Тиофен легко на холоде сульфируется концентрированной серной кислотой c образованием тиофен-2-сульфокислоты:
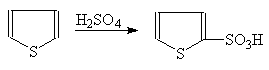
(39)
a-Тиофенсульфокислота
Поскольку бензол в аналогичных условиях не сульфируется, эта реакция используется для очистки бензола от тиофена.
В отличие от фурана тиофен замещает на хлор и бром лишь два атома. С иодм в присутствии оксида ртути замещается только один атом водорода.
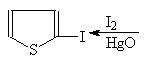
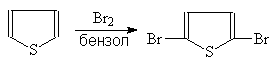
(40)
2,5-Дибромтиофен
При бромировании тиофена N-бромсукцинимидом образуется 2-бромтиофен:
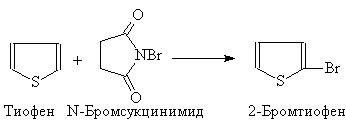 (41)
(41)
Реакцию Фриделя-Крафтса в случае тиофена приходится осуществлять не с AlCl3, а с более мягко действующими SnCl4 или SiCl4. Возможно также ацилирование тиофена:
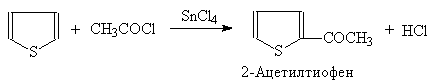
(42)
Тиофен почти совсем не обнаруживает ненасыщенного характера и не полимеризуется под действием кислот. Гидрирование тиофена в присутствии палладиевого катализатора приводит к образованию тиофана, в присутствии же никелевого катализатора гидрирование сопровождается десульфурированием:
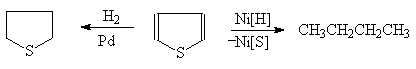
(43)
Тиофан
Тиолан может быть окислен в сульфоноксид (сульфан) или в тиоландиоксид (сульфолан)
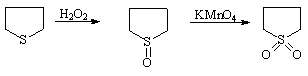
Упр.12. Промышленный синтез тиофена осуществляется пропусканием (1 сек) через раскаленную трубку при температуре 600оС смеси серы с бутаном, бутадиеном или бутенами. Напишите соответствующие реакции.
Упр.13. Напишите следующие реакции тиофена: (а) сульфирования (серной кислотой и хлорсульфоновой кислотой), (б) нитрования (ацетилнитратом), (в) ацилирования (фталевым ангидридом), (г) хлорирования (хлористым сульфурилом), (д) бромирования (бромом). Опишите механизм этих реакций.
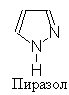
3. ПИРРОЛ
Пиррольное кольцо входит в структуру многих важных природных соединений, таких как гемин, хлорофил и др.
3.1. Получение
Пиррол содержится в каменноугольной смоле и костном масле. В лаборатории его можно получать сухой перегонкой аммонийной соли слизевой кислоты или перегонкой сукцинимида с цинковой пылью:
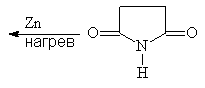
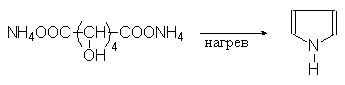
(46, 47)
Пиррол может быть получен действием аммиака на фуран в присутствии оксида алюминия (рнакция Юрьева):
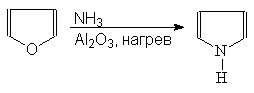
(48)
3.2. Свойства
Пиррол представляет собой бесцветную темнеющую на воздухе жидкость с т. кип. 131оС. Характерной для соединений ряда пиррола является их способность окрашивать в красный цвет смоченную в соляной кислоте сосновую лучину. Отсюда и название “пиррол” [“красное масло”].
3.2.1. Кислотно-основные свойства
Пиррол, как и фуран, проявляет ацидофобные свойства. При действии кислот он протонируется и полимеризуется. Пиррол является слабым основанием и одновременно очень слабой кислотой, более слабой, чем фенол. Он реагирует с КОН при сплавлении:
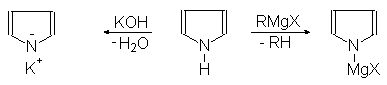
(49)
Пирролкалий Пиррол Пирролмагнийгалогенид
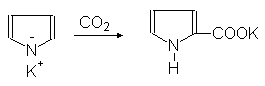
Пирролкалий реагирует с диоксидом углерода с образованием калиевой соли
пиррол-2-карбоновой кислоты:
 (50)
(50)
Пирролкалий Пиррол-2-карбонат калия
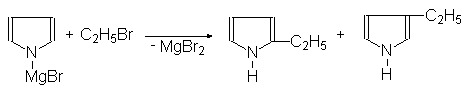
Пирролмагнийбромид реагирует с алкилгалогенидами образуя 2- и
3-алкилпирролы:
(51)
Пирролмагнийбромид a-Этилпиррол b-Этилпиррол
3.2.2. Реакции электрофильного замещения
Пиррол очень реакционноспособен по отношению к электрофильным реагентам. Механизм этих реакций аналогичен механизму соответствующих реакций фурана:
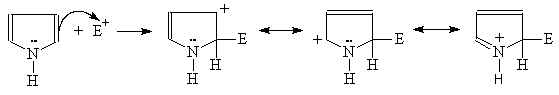 (М 4)
(М 4)
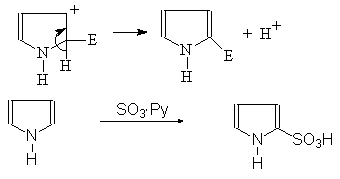
(52)
Пиррол a-Пирролсульфокислота
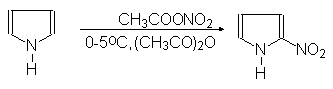
(53)
a-Нитропиррол
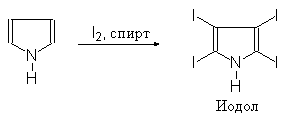
(54)
При проведении реакций электрофильного замещения следует избегать слишком кислой среды, в которой пиррол полимеризуется. Пиррол с заместителями второго рода более устойчив, чем сам пиррол и электрофильное замещение уже будет требовать катализатора.
3.2.3. Восстановление
При гидрировании пиррола в присутствии платинового катализатора образуется пирролидин:
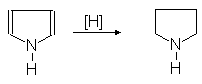 (55)
(55)
Пирролидин
Упр.14. В лабораторных условиях пиррол получают нагреванием аммонийной соли слизевой кислоты Н4NOOC(CHOH)4COONH4. Напишите соответствующие уравнения реакций.
Упр.15. Напишите уравнения реакций, протекающих при действии на пиррол:
(а) хлористого сульфурила; (б) брома; (в) иода (в избытке в присутствии KI);
(г) пиридинсульфотриоксида, затем Ba(OH)2; (д) п-нитрофенилдиазонийхлорида;
(е) уксусного ангидрида в присутствии SnCl4; (ж) HCl; (з) амида натрия;
(и) металлического калия; (к) фениллития; (л) н-бутиллития; (м) СН3MgI