
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Возможности ионообменной хроматографии
Реферат: Возможности ионообменной хроматографии
Реферат на тему:
Возможности ионообменной хроматографии.
Аффинная хроматография
Градиентная элюция
Вместо ступенчатой элюции может оказаться целесообразным постепенно увеличивать концентрацию соли, то есть перейти на элюцию непрерывным градиентом концентрации соли. Линейным или нелинейным - чтобы сократить разрыв между пиками.
В ситуации, изображенной на рис. целесообразно использовать "вогнутый" градиент концентрации соли: медленно нарастающей в области ее малых значений и круто - в области больших концентраций. Это приблизит пик белка 5 к остальным и тем самым сократит время хроматографии.
Я привел для примера способ выбора содержания соли в элюенте в случае уже выбранного рН буфера. Аналогичный опыт можно поставить и для исследования влияния рН при одной определенной концентрации соли. (Напомню, что величина рН обязательно влияет на состояние ионогенных групп белка и, следовательно, на распределение зарядов по поверхности белковой глобулы. В случае использования слабого ионообменника от рН зависит и количество активных ионов на матрице) Далее результаты обоих опытов можно разумно объединить, варьируя (ступенчато или в градиенте) оба параметра. Возможно, что придется сменить ионообменник или существенно удлинить колонку.
Если, несмотря на все усилия, разделить белки смеси в одном хроматографическом опыте не удастся, то можно вышедшие из колонки фракции неразделившихся белков объединить и внести в колонку с другим ионообменником или использовать другой вид хроматографии.
Нередко перед исследователем стоит задача очистки одного определенного белка из смеси с другими. В этом случае оптимальные условия элюции подбирают так, чтобы остальные белки, не разделяясь, отходили от нужного белка в ту или другую сторону, т.е. элюировались раньше него или задерживались на колонке.
Резюмируя, следует заключить, что использование способа фракционирования белков методом ионообменной хроматографии требует весьма серьезной и вдумчивой предварительной работы по оптимизации условий проведения этой хроматографии.
Разумеется, задача еще усложняется, если в распоряжении исследователя нет чистых белков, входящих в состав фракционируемой смеси. В этом случае приходится довольствоваться либо литературными данными об их свойствах, либо вести подбор условий используя по возможности близкие аналоги отсутствующих белков.
Возможности ионообменной хроматографии
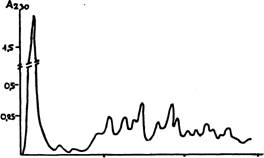
На рис. показан результат хроматографического разделения 20-ти белков из 40S - субъединицы рибосомы рачка Artemia salina (Ting Shih etal. 1979) Фракционирование вели на колонке СМ-целлюлозы (1х30 см) линейным градиентом NaCI (0-0,4 М) в фосфатном буфере рН6,5.
Разделение отнюдь не блестящее. Методом электрофореза можно добиться заметно лучшего результата. Но зато все белки получены в одном хроматографическом разделении, не ограниченном в отношении препартивного масштаба (можно увеличить количество материала и размер колонки) и нет проблемы элюции белков из геля.
400 300
Рис.
Рис. демонстрирует отмеченные ранее преимущества хро-матографии при среднем давлении в системе FPLC. На анионообменнике "Моно Ф" (см. выше) проводили разделение белков яда Crotalus atrox. Элюцию вели линейным градиентом концентрации NaCI (0-0,35 М) при рН7,5. За 20 минут удалось хорошо разделить более десятка белковых пиков.
Распределительная хроматография
В предыдущей главе мы ввели понятия неподвижной и подвижной фаз при хроматографии. Далее было установлено, что для разделения веществ, нанесенных на колонку в виде смеси, необходимо, чтобы для каждого из компонентов этой смеси установилось динамическое равновесие концентраций между двумя фазами.
Эти равновесия должны быть сильно сдвинуты в сторону неподвижной фазы. В ионообменной хроматографии такой сдвиг происходил за счет электростатической, ионной связи каждого из веществ с твердой хроматографической матрицей.
С током подвижной фазы (элюента), уносящей растворенные в ней вещества, все эти равновесия нарушаются и немедленно восстанавливаются (на более низком уровне концентраций) за счет частичного выхода из неподвижной фазы каждого из веществ.
Слоем ниже идет обратный процесс - динамические равновесия устанавливаются за счет перехода веществ из подвижной фазы в неподвижную до тех пор, пока эти новые равновесия не достигнут наивысшего уровня концентраций. После чего снова начинается вымывание веществ элюентом, точно такое же, как происходило в вышележащем слое, который тем временем опустошается.
Так происходит перемещение связанных с матрицей зон различных веществ вниз по колонке. Эти зоны движутся с различными скоростями, что обусловлено различием сил связывания каждой из них с матрицей и, соответственно, различием соотношений равновесных концентраций разделяемых веществ в неподвижной и подвижной зонах.
Повторное изложение сути хроматографического процесса имеет целью обратить внимание читателя на то, что в нем не фигурирует механизм связи веществ с матрицей.
Собственно говоря, не заявлена даже необходимость такой связи, а только условие различия равновесных концентраций в двух зонах, специфическое для каждого из фракционируемых веществ.
Такое условие может быть выполнено и другими способами. Например, можно использовать различие растворимостей этих веществ в разных растворителях. Гидрофильные вещества, имеющие на поверхности своих молекул поляризованные участки или ионы. Они хорошо растворимы в воде и плохо - в органических растворителях.
Гидрофобные же вещества плохо растворимы в воде и хорошо - в органике. Были даже названы наиболее типичные из гидрофобных веществ: алифатические цепочки вида СНз-CH2-CH2... и ароматические молекулы - замкнутые циклы с сопряженными связями типа бензола или фенола.
Следует заметить, что абсолютной нерастворимости не бывает. Гидрофильные вещества плохо, но все-таки растворяются в органических растворителях. То же самое относится и к взаимоотношениям гидрофобных веществ и воды.
Представим теперь себе колонку, заполненную целлюлозой, набухшей в воде. Внутри гранул такой целлюлозы тоже будет находиться неподвижная вода. Потом пропустим через эту колонку фенол, который заполнит пространство между гранулами.
Наконец внесем на эту колонку смесь гидрофильных веществ, хотя бы обычных водорастворимых белков. Большая их часть немедленно "укроется" в неподвижной водной фазе внутри гранул. Малая же их доля (для разных белков - разная) все-таки растворится в феноле. Установятся динамические равновесия концентраций белков, отвечающие соотношениям их растворимостей, во всех случаях сильно сдвинутые к неподвижной фазе. Но это и есть условие реализации колоночной хроматографии.
Можно надеяться, что если достаточно долго подавать на такую колонку фенол в качестве элюента, то в конце концов на выходе из колонки появятся разделенные между собой, очень пологие пики наших белков, растворенных в феноле.
Это - "распределительная хроматография". основанная на различии растворимостей. Исторически такое распределение, когда водная фаза находится внутри гранул, а элюентом служит органический растворитель, названо "нормальнофазовой" хроматографией. Она широкого распространения не получила.
Главным образом потому, что фракционируемые вещества выходят из колонки в органическом растворителе, в то время, как для подавляющего большинства биологических веществ нормальная среда - водная.
В отличие от этого, предложенный позднее вариант так называемой "обращенной" или "обратнофазовой" распределительной хроматографии оказался весьма продуктивным. Здесь связывание молекул в неподвижной фазе происходит за счет их, пусть даже не ярко выраженных, но существующих гидрофобных свойств. (Например, наличия гидрофобных участков на поверхности белковой глобулы).
В неподвижной фазе создаются условия для хорошо выраженного гидрофобного взаимодействия. Обычно не с жидкостью, находящейся внутри гранул, поскольку органический растворитель трудно удержать внутри обычной гидрофильной матрицы (он ее не смачивает).
Гидрофобную среду создают либо на поверхности самой матрицы, заставляя частично гидрофобные молекулы в водной среде "прилипать" к этой поверхности, либо в тонкой пленке сильно гидрофобного растворителя, надежно связанного с матрицей.
Гидрофобизированные матрицы сефарозы
Первый вариант представлен, в частности, модифицированными матрицами на основе хорошо знакомой нам сефарозы. По множеству ОН-групп нитей агарозы ковалентной связью присоединяют гидрофобные радикалы.
Соответственно модифицированные матрицы именуются: "октил-сефароза", "октилдецил-сефароза" и "фенил-сефа-роза". Присоединенные радикалы создают сильно гидрофобную среду на поверхности самой сефарозной матрицы.
Разделять белки по силе гидрофобного взаимодействия с этой средой можно путем простой изократической элюции водным буфером. Однако разделение можно ускорить и улучшить, если вести элюцию линейным градиентом слабого раствора NaCI (0,02-0,3М) в буфере. Дело в том, что в слабых солевых растворах белки растворяются лучше, чем в воде.
Улучшение растворимости белковых молекул в элюенте способствует отрыву белков от гидрофобизированной поверхности матрицы, а следовательно, и извлечению их из неподвижной фазы.
Любопытно, что на той же самой гидрофобизированной матрице те же самые белки можно разделять обратным - снижающимся градиентом концентрации соли. В очень концентрированных водных растворах соли, в частности сульфата аммония, растворимость белков падает до нуля.
Этим можно воспользоваться для обеспечения путем элюции снижающимся градиентом сульфата аммония (например.1-0,5М) постепенного увеличения растворимости белков в элюенте, что приведет к тем же результатам, что и в предыдущем случае.
Система ХОФ-5
Другой вариант распределительной хроматографии в обращенных фазах под сокращенным наименованием ХОФ-5 (RPC-5) был одно время очень популярен и, кажется, сохранил свое значение и сейчас.
В нем используется сильно гидрофобная жидкость, тонкой пленкой надежно обволакивающая нити гидрофобизированной матрицы, например липофильной модификации сефадекса с торговым названием "Сефадекс LH-20".
Пленку образует жидкость со сложным химическим наименованием - трикаприлилмонометиламмоний хлорид (торговое название "Адоген 464"). Из ее химической формулы: видно, что молекулы этой жидкости содержат обширную алифатическую оболочку, окружающую атом азота, несущего положительный заряд.
Система ХОФ-5 оказалась весьма эффективной для фракционирования нуклеиновых кислот. Нуклеиновые основания представляют собой совокупность замкнутых циклов с сопряженными связями и потому обладают высокой степенью ароматической гидрофобности, что и обеспечивает их склонность к растворению в гидрофобной пленке.
По-видимому, такому растворению способствует и притяжение отрицательно заряженных фосфатов нуклеиновой кислоты к положительно заряженным атомам азота в адогене 464.
Элюцию колонок ХОФ-5 ведут относительно пологим возрастающим градиентом концентрации NaCl. Присутствие соли блокирует названную электростатическую связь азот-фосфор, облегчая выход ДНК из гидрофобной пленки в окружающую ее водно-солевую среду.
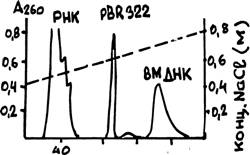
В качестве примера на рис.59 показан результата хроматографической очистки плазмиды pBR322 от окружающих ее в лизате бактерии РНК и высокомолекулярной ДНК (по данным фирмы BRL, 1981). Пунктирная линия на рисунке обозначает градиент концентрации NaCl.
Особенно часто обратнофазовую распределительную хроматографию используют для разделения низкомолекулярных объектов (аминокислот, пептидов, нуклеотидов и пр.) при высоком давлении (ЖХВД). Конкурентную элюцию в большинстве случает ведут градиентом относительно слабо гидрофобных органических растворителей: метанола, этанола, пропанола, ацетонитрила или тетрагидроф урана (ТГФ).
Хотя ранее было решено, что мы оставляем в стороне ЖХВД, но здесь имеет смысл о ней упомянуть, чтобы прояснить одну ранее оставшуюся без разъяснения ситуацию. Дело в том, что именно с помощью такого вида хроматографии осуществляют идентификацию аминокислот при секвенировании белков по методу Эрдмана.
Секвенирование ведется путем последовательного отщепления "сложных и весьма гидрофобных производных аминокислот". Здесь я могу привести их общее химическое наименование ("фенилтиогидантоиновые производные" - ФТГ) с одной только целью - указать на начало этого наименования, где фигурирует фенил - радикал фенола. Это и есть причина гидрофобности.
На Рис.60 показан хроматографический профиль разделения смеси ФТГ-производных 20-ти аминокислот методом ЖХВД на колонке, где на основе силикагеля закреплены алифатические 18-ти членные радикалы октилдецила. По сути дела это тот же самый первый вариант твердой гидрофобной матрицы, который
Аффинная хроматография. Общая характеристика метода
Это - самый сложный, тонкий и, пожалуй, самый капризный метод хроматографии. Но зато, в случае успеха, - фантастически эффективный! С его помощью в одной хроматографической операции удается полностью очистить вещество, представленное в смеси с другими компонентами ничтожной долей - порядка нескольких сотых процента.
Аффинный означает родственный (от латинского af finis) или, точнее, обладающий сродством. Аффинная связь в нашем случае подразумевает биоспецифическое взаимодействие, отличающееся исключительной избирательностью. Такая избирательность лежит в основе множества строго детерминированных процессов, протекающих в организме.
В качестве примеров можно назвать взаимодействия между ферментами и их субстратами или ингибиторами, между гормонами и их рецепторами, между антигенами и антителами к ним, между многими малыми молекулами, например, витаминами и специфическими транспортными белками, доставляющими их в клетку.
Наконец, между нуклеиновыми кислотами и специфическими белками, управляющими реализацией их функций: редупликацией, транскрипцией и трансляцией.
Любой из компонентов названных и им подобных биоспецифических пар можно надежно закрепить на хроматографической матрице в качестве так называемого "лиганда". С его помощью второй партнер такой пары может быть извлечен из смеси с другими, не комплементарными лиганду веществами и временно задержан на матрице в составе биоспецифического (аффинного) комплекса.
После удаления всех посторонних примесей промывкой тем же элюентом, в котором осуществлялось образование этого комплекса, можно произвести замену элюента на такой, который нарушит биоспецифическую связь лиганда с его аффинным партнером. Это обеспечит быстрый выход последнего из колонки, на которой останется освобожденный для новых аффинных связей лиганд.
Биоспецифическое взаимодействие реализуется за счет тех же, хорошо знакомых нам сил связи, которые фигурировали в рассмотренных ранее видах хроматографии: электростатического притяжения разноименных ионов, водородных связей и сил гидрофобного взаимодействия.
Биоспецифичность определяется конформационным соответствием участков связывания на лиганде и веществе, в результате которого различные их взаимодействия осуществляются одновременно в нескольких точках и их эффекты суммируются.
Одна из тонкостей постановки опытов с использованием аффинной хроматографии заключается в создании условий, когда ни одна из этих нескольких связей не будет излишне прочной. В противном случае вещество не удастся "снять" с лиганда.
Вся суть метода заключается в конформационном соответствии. Ни одна из связей не является специфичной. Поэтому их разрыв при элюции очищенного вещества может быть осуществлен с помощью обычных приемов: изменением рН, увеличением ионной силы (иногда и температуры) элюента, введением в его состав органических растворителей и детергентов.
В некоторых случаях может потребоваться вмешательство денатурирующих агентов (мочевина, формамид), нарушающих само конформационное соответствие пары лиганд - вещество.
Из сказанного ясно, что главное преимущество аффинной хроматографии состоит в ее очень высокой избирательности. Вместе с тем, сам способ связывания вещества с матрицей через лиганд в условиях конформационного соответствия является, как правило, идеально мягким и, в отличие от других видов хроматографии, не угрожает нативности очищаемого вещества, например, его ферментативной активности.
Действительно, здесь фермент "садится" в точно соответствующую его конфигурации "ямку", между тем, как в ионообменной или распределительной хроматографии связывание с сорбентом хотя бы только в двух, но случайно расположенных, точках может существенно деформировать молекулу фермента.
В тех "некоторых случаях", когда элюцию фермента не удается осуществить без его денатурации, можно пойти по пути ослабления первичного биоспецифического связывания. Например, заменить в качестве лиганда истинный субстрат фермента на его аналог.
Немаловажным преимуществом аффинной хроматографии является и то обстоятельство, что в ней гидролитические ферменты (протеазы и нуклеазы) с самого начала отделяются от своих субстратов.
В частности, этим обстоятельством обусловлен высокий выход при очистке макромолекулярных препаратов. Кроме того, ввиду избирательной сорбции малой доли вещества, находящегося в исходной смеси, аффинную хроматографию отличает возможность использования больших объемов исходных препаратов. В ходе ступенчатой элюции осуществляется весьма эффективное концентрирование нужного вещества.
Есть еще одна особенность аффинной хроматографии, которую следует отметить с самого начала. Способ связывания лиганда с матрицей не должен создавать стерических препятствий для осуществления его аффинного взаимодействия с сорбируемым веществом.
Если в качестве лиганда выступает биополимер (белок или нуклеиновая кислота) и его участок биоспецифического взаимодействия оказывается достаточно удаленным от точки закрепления на матрице, проблема не возникает.
Однако если в качестве лиганда используется низкомолекулярный субстрат, кофермент или гормон, то близость его расположения к матрице может создавать стерические препятствия для правильной ориентации белка, взаимодействующего с таким лигандом.
В результате степень аффинного сродства вещества к обменнику может уменьшиться и даже упасть до нуля. В таких случаях необходимо биологически активный лиганд удалить от матрицы, вводя между ними тонкую "ножку", например, линейную цепочку метиленовых остатков (... - СН2-СН2-СН2. .) или иную подходящую структуру, так называемого "спейсера""
Хотя принцип аффинной хроматографии очень прост, из приведенных кратких замечаний легко понять, что "конструирование" аффинного обменника для очистки нужного вещества является делом деликатным. Необходимо разумно выбрать матрицу, найти способ щадящего и, вместе с тем, надежного (как правило химического) закрепления на ней лиганда.
Если необходимо, то закрепления через спейсер, который тоже нужно выбрать наилучшим образом как в отношении его размера и степени гидрофильности, так и в отношении способов его связывания с матрицей и лигандом.
Разумеется, для многих частных, а также и общих случаев эта задача решена усилиями фирм, выпускающих аффинные сорбенты. Номенклатура их непрерывно расширяется и приводить ее здесь не имеет смысла.
Тем более, что каждый исследователь, понимающий исключительные возможности аффинной хроматографии, должен быть готов к тому, чтобы сконструировать аффинный обменник для решения своей особой задачи.
Литература
1. Душкин М.П., Иванова М.В. Трансформация перитонических макрофагов в пенистые клетки при внутрибрюшном введении мышам липопротеидов низкой плотности, холестерина и его продуктов окисления. // Патофизиология и эксперимент. терапия. - 1993. - N 2. - С.9-11.
2. Дятловская Э.В., Безуглов В.В. Липиды как биоэффекторы. Биохимия. 1998. Т.67. вып.1. - С. - 3-6.
3. Ершова Л.П., Курбанова Г.Н., Горбунова Н.А. О механизмах посттравматической анемии. // Пат. физиология. 1992. - N 2. - С. - 54-55.