
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Свойства и получение хлорида кальция
Реферат: Свойства и получение хлорида кальция
Содержание
1. ХЛОРИД КАЛЬЦИЯ. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА.. 2
2. ПРИМЕНЕНИЕ. 4
3. СЫРЬЕ. 6
4. ПОЛУЧЕНИЕ ПЛАВЛЕНОГО ХЛОРИДА КАЛЬЦИЯ ИЗ ДИСТИЛЛЕРНОЙ ЖИДКОСТИ СОДОВОГО ПРОИЗВОДСТВА.. 8
5. ПОЛУЧЕНИЕ ХЛОРИДА КАЛЬЦИЯ ИЗ МАТОЧНОГО ЩЕЛОКА ХЛОРАТНОГО ПРОИЗВОДСТВА.. 11
6. ПОЛУЧЕНИЕ ГИДРООКСИХЛОРИДА КАЛЬЦИЯ И ХЛОРИДА КАЛЬЦИЯ ИЗ НЕГО.. 12
7. ПОЛУЧЕНИЕ БЕЗВОДНОГО ХЛОРИДА КАЛЬЦИЯ ИЗ СОЛЯНОЙ КИСЛОТЫ И ИЗВЕСТНЯКА.. 14
Список использованной литературы.. 18
1. ХЛОРИД КАЛЬЦИЯ. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Хлорид кальция СаСІ2 образует белые кристаллы кубической формы с плотностью 2,51 г/см3. Плавится при 772°С. Сильно гигроскопичен, на воздухе расплывается. Равновесная относительная влажность воздуха над СаСІ2 ×2Н2О при 20°С равна 22%, при 50°С – 17%, а над СаС12×6Н2О при 10°С – 38%, при 20°С – 32,3%, при 24,5°С – 31%. Высушивание гранулированным хлоридом кальция при 25°С позволяет понизить влажность газа до 0,14 – 0,25 г воды в 1 л.
С аммиаком СаСІ2 образует двойные соединения CaCl2×4NH3. СаСІ2×8NH3.
При повышенных температурах СаС12 разлагается кислородом воздуха и парами воды по реакциям
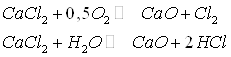
а в присутствии SiO2
или ![]() идут
реакции:
идут
реакции:
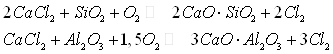
Заметное разложение СаС12
в сухом и влажном воздухе идет выше 830°С, в присутствии ![]() – выше 720°С, в
присутствии Al2O3 выше 800°С.
– выше 720°С, в
присутствии Al2O3 выше 800°С.
Известен субхлорид кальция СаС12 устойчивый при температуре выше 800°С, образующийся при нагревании СаС12 с металлическим кальцием. Субхлорид кальция окрашен в красно-фиолетовый цвет. Он может быть получен при комнатной температуре в метастабильном состоянии при быстром переохлаждении.
В солянокислых растворах растворимость СаС12 уменьшается и тем в большей степени, чем ниже температура. При 0° в растворе с содержанием 27,98% НС1 растворяется 9,1% СаС12 (вместо 37,30% в воде), при 15°С и содержании в растворе 26,20% НС1 растворяется 21,3% СаС12 (вместо 41,2% в воде). В системе НС1—СаС12—Н2О при 15°С кристаллизуются две твердые фазы: СаС12×2Н2О и СаС12×6Н2О, при 25°С – три твердые фазы: СаС12×2Н2О, СаС12×4Н2О, СаС12×6Н2О. Хлорид кальция высаливает NaCl из его водных растворов, особенно при пониженных температурах. Растворимость NaCI в системе СаС12—NaCl—Н2О (при 0°С) непрерывно уменьшается по мере растворения СаС12 (от 26,23% в воде до 0,62% в растворе, содержащем 34,87% СаС12). При более высоких температурах, помимо NaCl, кристаллизуются также СаС12.
2. ПРИМЕНЕНИЕ
Хлорид кальция используют в производстве хлорида бария, некоторых красителей, для коагуляции латекса, в химико-фармацевтической промышленности, при обработке сточных вод, в системах для кондиционирования воздуха, при экстракции масел и др. В связи с большой гигроскопичностью его часто применяют в качестве осушителя газов и жидкостей. Его применяют также для получения металлического кальция электролизом, для производства кальциевых сплавов и баббитов.
Низкие температуры замерзания водных растворов хлорида кальция позволяют применять его в качестве хладоносителя в холодильном деле и в качестве антифриза для двигателей внутреннего сгорания в авиации, автомобильном транспорте, для борьбы с гололедицей, для предотвращения смерзаемости угля и руд при транспортировании в зимнее время и др. Существенным недостатком его является сильное коррозирующее действие на металлы, которое уменьшается при введении в раствор хлорида кальция окислителей – хроматов или бихроматов. Коррозия уменьшается и в присутствии ионов магния. Раствор СаС12 + MgCl2 также служит жидкостью с низкой температурой замерзания. Его приготовляют как из твердых солей, так и смешивая, например, конечный карналлитовый щелок с предварительно упаренной дистиллерной жидкостью содового производства.
За рубежом масштабы применения хлорида кальция весьма велики вследствие использования его для обеспыливания грунтовых и щебеночных дорог и при строительстве дорог. Периодическое (3 – 4 раза за летний сезон) нанесение раствора СаС12 устраняет пылеобразование. При строительстве дорог СаС12 используют в качестве одного из компонентов цементо-грунта – подстилающего слоя дороги. При строительстве 1 км силикатированной дороги расходуют ~3т 75% раствора СаС12.
В присутствии СаС12 ускоряется твердение бетона и увеличивается морозостойкость строительных растворов. Некоторое распространение в последние годы хлорид кальция получил в качестве добавки к шихте при производстве кирпича-сырца на заводах с естественной сушкой.
Хлорид кальция можно применять для предотвращения пыления угля, в частности для предотвращения появления взрывоопасной угольной пыли в шахтах, а также в качестве гербицида для уничтожения сорняков на железнодорожных путях.
Хлорид кальция может быть использован для мелиорации солонцовых почв с большей эффективностью, чем гипс. Возможно также использование его раствора в качестве тяжелой жидкости при углеобогащении.
Хлорид кальция выпускают в виде раствора, плавленого продукта (порошкообразного, чешуйчатого или гранулированного), представляющего собой смесь двух- и четырехводного кристаллогидратов, и в виде кальцинированного, обезвоженного продукта (порошкообразного или гранулированного).
Кальцинированный и плавленый хлорид кальция упаковывают в металлические барабаны, в полиэтиленовые или бумажные пятислойные битумированные мешки. Предложено перевозить его в железнодорожных цистернах, загружаемых горячим концентрированным раствором СаС12, затвердевающим при естественном охлаждении. Для разгрузки в цистерну необходимо подать воду или разбавленный раствор в количестве, требующемся для получения стандартного раствора.
3. СЫРЬЕ
Сырьем для производства плавленого хлорида кальция служат промышленные отходы растворов хлорида кальция, получающиеся в больших количествах на содовых заводах, при производстве хлората калия и др.
Дистиллерная жидкость, получающаяся в производстве соды по аммиачному способу при регенерации аммиака по реакции:
![]()
имеет плотность 1,12—1,13 г/см3 и содержит 9,2 – 11,3% СаС12, 4,7 – 5% NaCI и небольшие количества растворенных гипса, гидроокиси кальция и аммиака в смеси с взвешенным осадком. Последний состоит из СаСО3, Са(ОН)2 и CaSO4×2H2O; количество осадка равно 20 – 25 кг/м3. На каждую тонну производимой соды выбрасывается в дистиллерной жидкости более 1 т СаСІ2 и 0,6 – 0,8 т NaCI.
В производстве бертолетовой соли после кристаллизации КС1О3 остается маточный щелок, содержащий 400 – 500 г/л СаСІ2, по 10 – 20 г/л КСІО3 и КС1 и незначительные количества других примесей. Этот щелок является отходом производства и выпускается в виде товарного продукта, применяемого для разных целей, в частности для производства хлорида бария. Путем его выпаривания получают твердый (плавленый) хлорид кальция.
Для производства хлорида кальция сырьем служат также соляная кислота и высококачественный известняк, содержащий малые количества примесей R2O3, MgO, SiO2, S и P.
В некоторых случаях хлорид кальция (22 – 25% раствор) получают из хлормагниевого рассола, обрабатывая его гашеной известью и отделяя на фильтре осадок гидроокиси магния1в.
Хлорид кальция образуется при хлорировании окиси кальция выше 600°С, а также при хлорировании сульфата кальция в среде расплавленного СаС12 в присутствии восстановителя выше 800°С. Эти способы получения СаС12 в промышленности не применяются.
4. ПОЛУЧЕНИЕ ПЛАВЛЕНОГО ХЛОРИДА КАЛЬЦИЯ ИЗ ДИСТИЛЛЕРНОЙ ЖИДКОСТИ СОДОВОГО ПРОИЗВОДСТВА
Получение товарного хлорида кальция из дистиллерной жидкости содового производства заключается в последовательном выпаривании дистиллерной жидкости от концентрации ~ 10% СаС12 до 67%, требуемой условиями ГОСТ на плавленый продукт. Выпарку ведут в одиночных или батарейных плавильных котлах, обогреваемых топочными газами, в вакуум-выпарных аппаратах, обогреваемым паром, в распылительных сушилках и др.
Отстоявшуюся дистиллерную
жидкость можно подвергнуть карбонизации и обработке хлоридом бария с
последующим отстаиванием для очистки жидкости от растворенных в ней извести и
гипса. При наличии в растворе ионов ![]() может произойти загипсовывание
греющих поверхностей выпарных аппаратов. Очистка раствора с помощью ВаС12 приводит,
однако, к увеличению производственных издержек и не позволяет использовать
выделяющуюся при выпарке поваренную соль в качестве пищевого продукта. Поэтому
карбонизацию дистиллерной жидкости и обработку ее хлоридом бария часто не
производят.
может произойти загипсовывание
греющих поверхностей выпарных аппаратов. Очистка раствора с помощью ВаС12 приводит,
однако, к увеличению производственных издержек и не позволяет использовать
выделяющуюся при выпарке поваренную соль в качестве пищевого продукта. Поэтому
карбонизацию дистиллерной жидкости и обработку ее хлоридом бария часто не
производят.
При выпаривании не
очищенной от ионов ![]() и
и ![]() дистиллерной жидкости в выпарном
аппарате с естественной Циркуляцией коэффициент теплопередачи за 92 ч
снижается на 40% от своего первоначального значения. Опыт был выполнен с дистиллерной
жидкостью следующего состава (в г/л): 122,7 – СаС12, 62,84 – NaCl, 0,93 – CaSO4,
1,21– Ca(OH)2; плотность 1,134 г/см3. Выпаривание с
принудительной циркуляцией при скорости жидкости в трубах ~3,5 м/сек и при
добавке кристаллической подкладки в виде гипса (3 – 6% от веса жидкости) не
предотвращает инкрустирования греющих поверхностей сульфатом кальция. Однако
производительность аппарата при этом увеличивается в ~3 раза, а
продолжительность работы до чистки в ~2 раза. Интенсивность зарастания греющей
поверхности и твердость образующейся корки сульфатов (состоящей из гипса,
полугидрата сульфата кальция или ангидрита) сильно зависит от температурного
режима выпарки. На некоторых содовых заводах выпаривают неочищенную
дистиллерную жидкость, останавливая аппарат для удаления инкрустаций после 25 –
35 суток непрерывной работы.
дистиллерной жидкости в выпарном
аппарате с естественной Циркуляцией коэффициент теплопередачи за 92 ч
снижается на 40% от своего первоначального значения. Опыт был выполнен с дистиллерной
жидкостью следующего состава (в г/л): 122,7 – СаС12, 62,84 – NaCl, 0,93 – CaSO4,
1,21– Ca(OH)2; плотность 1,134 г/см3. Выпаривание с
принудительной циркуляцией при скорости жидкости в трубах ~3,5 м/сек и при
добавке кристаллической подкладки в виде гипса (3 – 6% от веса жидкости) не
предотвращает инкрустирования греющих поверхностей сульфатом кальция. Однако
производительность аппарата при этом увеличивается в ~3 раза, а
продолжительность работы до чистки в ~2 раза. Интенсивность зарастания греющей
поверхности и твердость образующейся корки сульфатов (состоящей из гипса,
полугидрата сульфата кальция или ангидрита) сильно зависит от температурного
режима выпарки. На некоторых содовых заводах выпаривают неочищенную
дистиллерную жидкость, останавливая аппарат для удаления инкрустаций после 25 –
35 суток непрерывной работы.
Осветленную дистиллерную жидкость выпаривают обычно в многокорпусных выпарных аппаратах. По достижении концентрации ~40% СаСІ2 выделяется в осадок почти вся содержащаяся в жидкости поваренная соль. Она может быть возвращена в производство соды при условии тщательной отмывки от СаС12 (во избежание увеличения расхода соды на стадии предварительной очистки рассола NaCl). Отфугованная от маточного раствора, промытая и высушенная поваренная соль очень чиста и пригодна для пищевых целей (если дистиллерная жидкость предварительно не обрабатывалась хлоридом бария). Попутное получение чистой пищевой поваренной соли является важным условием рентабельности производства хлорида кальция.
Концентрированный раствор СаСІ2 после отделения поваренной соли продолжают выпаривать до концентрации 67% СаС12 обычно в плавильных аппаратах непрерывного действия до повышения его температуры кипения до 175°С. Затем жидкость разливают в барабаны, где она застывает в плавленый продукт. Для получения чешуйчатого продукта плав выпускают на поверхность охлаждаемого барабана.
Другим вариантом
получения твердого хлорида кальция из дистиллерной жидкости является следующий.
Осветленную дистиллерную жидкость выпаривают до концентрации 40% СаСІ2, отделяют осадок NaCl, а раствор
нейтрализуют соляной кислотой и добавляют к нему хлорную известь для окисления ![]() . После
перемешивания добавляют Са(ОН)2 или NaOH, отделяют осадок, а
фильтрат упаривают до концентрации 52% СаСІ2. Затем, после охлаждения до 50°С,
отстаиванием и фильтрованием удаляют выделившиеся кристаллы NaCl, а раствор
высушивают в распылительной сушилке, где получается продукт I сорта.
. После
перемешивания добавляют Са(ОН)2 или NaOH, отделяют осадок, а
фильтрат упаривают до концентрации 52% СаСІ2. Затем, после охлаждения до 50°С,
отстаиванием и фильтрованием удаляют выделившиеся кристаллы NaCl, а раствор
высушивают в распылительной сушилке, где получается продукт I сорта.
Разработан способ обезвоживания хлорида кальция азеотропной дистилляцией с помощью фракции нефти, кипящей в пределах 160 – 260°С. Нефть после регенерации можно возвращать на дистилляцию – при этом продукт в меньшей мере окрашен в желтый цвет. Обезвоженный хлорид кальция содержит меньше 0,1% воды. На дистилляцию 50%-ного исходного материала подают ~4 кг нефти, а на дистилляцию 75%-ного – 3 кг нефти на 1 кг безводного СаСІ2. При таком способе обезвоживания коррозия аппаратуры и расход тепла меньше, чем при выпарке раствора СаСІ2.
Хлорид кальция может быть получен в результате регенерации аммиака из хлорида аммония мелом сухим способом:
![]()
Реакция протекает по схеме:
![]()
При 200 – 225°С процесс лимитируется скоростью реакции взаимодействия газообразного хлористого водорода и СаСО3; при 350°С процесс лимитируется диффузией. Опыты в модели шахтной печи показали, что при пропускании возогнанного хлорида аммония через слой кускового мела (3 – 7 мм) при 420 – 450°С получается продукт, содержащий 80 – 85% СаСІ2. Промышленное осуществление этого процесса затруднено сильной коррозией и образованием настылей. Кроме того, при использовании стальной аппаратуры, теряется до 30% аммиака вследствие его каталитического разложения. В керамической и эмалированной аппаратуре потери аммиака невелики.
5. ПОЛУЧЕНИЕ ХЛОРИДА КАЛЬЦИЯ ИЗ МАТОЧНОГО ЩЕЛОКА ХЛОРАТНОГО ПРОИЗВОДСТВА
Получение плавленого
хлорида кальция из маточного щелока хлоратного производства, содержащего в 4 –
5 раз больше СаС12, чем дистиллерная жидкость, является значительно
более экономичным. Здесь, однако, идет более сильная коррозия вследствие
примеси хлората. Процесс осуществляется аналогично получению хлористого магния
из хлормагниевых щелоков, т.е. путем выпаривания в чугунных котлах,
обогреваемых топочными газами. Иногда выпаривание ведут в стальных котлах, в
стенках которых заделаны стальные змеевики; по змеевикам циркулирует
перегретая вода или другой теплоноситель. Выпаривание ведут до тех пор, пока температура
кипения жидкости не поднимается до 165 – 175°С. При атом концентрация щелока
достигает 67 – 75% СаС12, после чего его чешуируют на холодильном
барабане или сливают в тару, где он застывает в плав, состоящий из смеси ![]() .
.
6. ПОЛУЧЕНИЕ ГИДРООКСИХЛОРИДА КАЛЬЦИЯ И ХЛОРИДА КАЛЬЦИЯ ИЗ НЕГО
Гидрооксихлорид кальция ![]() образуется
при смешении в стехиометрическом отношении хлорида кальция, молотой извести и
воды. Его можно выделить из дистиллерной жидкости без выпарки ее или на
определенной стадии ее выпаривания. Он может быть использован непосредственно,
например в строительной технике в качестве добавки, ускоряющей твердение
бетона, или переработан на хлорид кальция.
образуется
при смешении в стехиометрическом отношении хлорида кальция, молотой извести и
воды. Его можно выделить из дистиллерной жидкости без выпарки ее или на
определенной стадии ее выпаривания. Он может быть использован непосредственно,
например в строительной технике в качестве добавки, ускоряющей твердение
бетона, или переработан на хлорид кальция.
Из водного ~10% раствора СаС12 прибавлением сухой гашеной извести можно выделить в виде гидрооксихлорида кальция до ~26% СаС12. При этом образуется хорошо кристаллизующийся осадок. В маточном растворе, количество которого составляет ~80% от исходных количеств раствора СаС12 и Са(ОН)2, содержится 6 – 7% СаС12 и ~0,1% Са(ОН)2. Из дистиллерной жидкости, предварительно выпаренной до содержания 21 – 22% СаС12, при этих же условиях выделяется до 66% СаС12. Для получения кристаллов в хорошо фильтрующейся форме в этом случае необходимо применять вместо сухой гидроокиси кальция известковое молоко. При этом осаждение следует производить, добавляя раствор СаС12 к подогретому до 50 – 60°С известковому молоку при постоянном перемешивании. Затем массу охлаждают до ~1°С для получения максимального выхода гидрооксихлорида. В жидкой фазе, количество которой ~60% от исходной смеси, после кристаллизации гидрооксихлорида остается 7 – 8% СаС12 и ~0,15% Са(ОН)2.
Для получения 30% раствора СаС12 при 55ºС необходимо обработать гидрооксихлорид небольшим количеством воды – 5 – 6% от веса гидрооксихлорида. Однако при этом получается плохо фильтрующаяся масса. Лучшие результаты достигаются при разложении гидрооксихлорида несколько большим количеством воды –приблизительно 14% от его веса. В этом случае в полученном растворе содержится 24 – 25% СаС12.
Изложенное свидетельствует, что переработка гидрооксихлорида кальция, получаемого из дистиллерной жидкости, не может быть экономичной и поэтому она не применяется.
Использование более концентрированных (чем дистйллерная жидкость) растворов СаС12 для получения гидрооксихлорида кальция дает существенные преимущества. Так, если применять раствор с концентрацией 25 – 35% СаС12, то можно получить высокий выход продукта при охлаждении реакционной массы до 20°С (вместо 0°С).
7. ПОЛУЧЕНИЕ БЕЗВОДНОГО ХЛОРИДА КАЛЬЦИЯ ИЗ СОЛЯНОЙ КИСЛОТЫ И ИЗВЕСТНЯКА
Получение хлорида кальция этим методом заключается в растворении известняка в соляной кислоте, в очистке образующегося «сырого» (неочищенного) раствора СаС12 от примесей и в обезвоживании его. Продукт получается более чистым, чем из отходящих жидкостей содового или хлоратного производства.
Растворение известняка (куски не больше 50 мм) производят в стальных баках, футерованных двумя слоями диабазовой плитки. В нижней части растворителя имеется решетка ив диабазовых плиток, поддерживающая загружаемый известняк. Соляную кислоту, разбавленную до 14% НС1, подают из напорного бака. Образующийся раствор СаС12, вытекающий из растворителя через штуцер в нижней его части по винипластовой трубе, должен содержать не больше 14 г/л свободной кислоты. Этого достигают, поддерживая определенную высоту слоя известняка.
Выделяющиеся из растворителей газы, содержащие СО2 и НС1, протягиваются вентилятором через керамическую башню, заполненную известняком и орошаемую разбавленным раствором хлорида кальция. Вытекающий из башни раствор, содержащий 300 – 350 г/л СаС12, примешивают к основному раствору.
Получающийся сырой
раствор, содержащий 450 – 600 г/л СаС12, очищают от примесей
соединений Fe, Mg, A1 и ![]() . Очистку производят в стальном,
футерованном диабазовой плиткой реакторе с пропеллерной мешалкой (30 об/мин).
Вначале раствор очищают от сульфатов. В реактор заливают ~10 м3
сырого раствора и вводят в него в сухом виде при перемешивании ~15 кг
хлористого бария. Осаждение сульфата бария заканчивается в течение 20 – 25
мин. Затем раствор подогревают острым паром до 70 – 75°С и добавляют к нему
известь-пушонку для осаждения гидроокисей железа, магния и алюминия. После 40 –
50-минутного отстаивания раствор профильтровывают. Количество примесей в нем не
должно превышать: 0,003 г/л Fe, 0,03 г/л
. Очистку производят в стальном,
футерованном диабазовой плиткой реакторе с пропеллерной мешалкой (30 об/мин).
Вначале раствор очищают от сульфатов. В реактор заливают ~10 м3
сырого раствора и вводят в него в сухом виде при перемешивании ~15 кг
хлористого бария. Осаждение сульфата бария заканчивается в течение 20 – 25
мин. Затем раствор подогревают острым паром до 70 – 75°С и добавляют к нему
известь-пушонку для осаждения гидроокисей железа, магния и алюминия. После 40 –
50-минутного отстаивания раствор профильтровывают. Количество примесей в нем не
должно превышать: 0,003 г/л Fe, 0,03 г/л ![]() , 0,025 г/л Mg. Раствор содержит
немного Са(ОН)2 (в пересчете на СаО 2,8 – 3,5 г/л). Для получения
безводного продукта в распылительной сушилке раствор должен иметь нейтральную
или слабощелочную реакцию: при значительной щелочности раствор вспенивается, что
затрудняет работу разбрызгивающей форсунки. Нейтрализацию избыточной щелочности
осуществляют, добавляя при перемешивании соляную кислоту в сборник очищенного
раствора. Затем очищенный раствор проходит через пенный аппарат, где его
концентрация повышается до 700 г/л СаС12, и поступает на
обезвоживание.
, 0,025 г/л Mg. Раствор содержит
немного Са(ОН)2 (в пересчете на СаО 2,8 – 3,5 г/л). Для получения
безводного продукта в распылительной сушилке раствор должен иметь нейтральную
или слабощелочную реакцию: при значительной щелочности раствор вспенивается, что
затрудняет работу разбрызгивающей форсунки. Нейтрализацию избыточной щелочности
осуществляют, добавляя при перемешивании соляную кислоту в сборник очищенного
раствора. Затем очищенный раствор проходит через пенный аппарат, где его
концентрация повышается до 700 г/л СаС12, и поступает на
обезвоживание.
Обезвоживание хлорида кальция производят, распыляя раствор в потоке горячего газа. Стальная сушильная башня изнутри выложена листом из стали 1Х18Н10Т и имеет диаметр 5,5 и высоту 11 метров с коническими верхней и нижней частями. Вокруг нижнего основанья верхнего конуса с наружной стороны расположен желоб высотой около 0,5 м, из которого раствор СаС12 подается в форсунку. Распыление раствора производят предварительно высушенным сжатым воздухом (3 ат). В верхнюю часть сушильной башни поступает топочный газ, получаемый сжиганием природного газа, разбавленный воздухом для понижения его температуры до 500°С. Распыленный раствор и горячий газ движутся в сушилке прямотоком сверху вниз. При этом вода из раствора выпаривается и образуется почти безводный продукт в виде сухого порошка. Часть СаС12 оседает внизу башни и скапливается в конусном бункере. Большая часть продукта уносится потоком воздуха и улавливается в двух параллельно работающих циклонах. Продукт выгружают как из циклонов, так и из башни и упаковывают в барабаны из оцинкованного железа.
Газ, выходящий из циклонов, уносит значительное количество хлорида кальция(2 – 2,5г/м3). Для его улавливания применяют пенные аппараты, служащие одновременно и пылеуловителями и утилизаторами тепла газа; это тепло используется для выпарки раствора перед его поступлением в сушильную башню. Пенные аппараты, применяемые в разных отраслях промышленности позволяют осуществлять очистку газов, теплопередачу и другие процессы, происходящие при контакте газов с жидкостями с весьма большой интенсивностью.
Пенный аппарат (рис. 1), диаметром 2,2 м и высотой 4,1 м, имеет горизонтально расположенную решетку с отверстиями 6 мм. Живое сечение перфорированной части решетки составляет 21%. Раствор подается на решетку с одной стороны, течет по ней в виде слоя пены и отводится с решетки с другой стороны. Газ поступает в аппарат снизу и, пройдя через отверстия решетки, вспенивает находящуюся на ней жидкость. При скорости газа в полном сечении аппарата 1,6 – 3,5 м/сек создается высокая турбулентность газо-жидкостной системы, обеспечивающая интенсивное протекание процессов в этой системе, в данном случае улавливания пыли хлорида кальция и теплообмена. Схема установки для очистки газа от хлорида кальция показана на рис. 1. Очищенный раствор СаС12 предварительно проходит через пенный аппарат. Выходящий из него подогретый и выпаренный раствор концентрацией СаС12 до 700 г/л подают в сушильную башню. Выпарку раствора осуществляют отработанным газом, температура которого снижается от 150—160°С до 80—90°С. Улавливание брызг раствора, уносимых газом из пенного аппарата, производится в специальной ловушке.
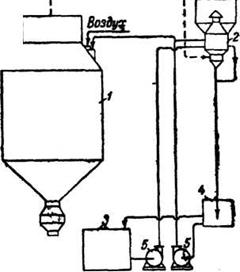
Рис. 1. Схема установки для очистки воздуха от хлорида кальция: 1– шильная башня; 2– пенный аппарат; 3–сборник раствора; 4– промежуточный бак; 5– насос.
Твердый гранулированный хлорид кальция можно получать смешением в барабане порошкообразных отходов безводного и частично обезвоженного СаС12 с непрерывно распыляемым раствором, содержащим более 50% СаС12. Смешение производят в потоке газа с температурой 200 – 500°С. Если температура массы 150 – 180°С, то в результате высушивания массы при такой температуре получается продукт, содержащий от 3 до 13% Н2О. Дальнейшей сушкой при 260 – 500°С получают безводный продукт. В зависимости от требований к продукту производят дробление и рассеивание массы, полученной при первой или второй сушке, с возвратом отходов в производственный цикл. Запатентован способ гранулирования СаС12 пропусканием расплава через узкое сопло под давлением, превышающим в 1,4 – 2,9 раз давление насыщенного пара над расплавом.
Список использованной литературы
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
3. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
4. Мороз А. С., Ковальова А. Г. Физическая и коллоидная химия. – Л. : Мир, 1994. – 278 с.
5. Физическая химия. Практическое и теоретическое руководство. Под ред. Б. П. Никольского, Л.: Химия, 1987. – 875 с.
6. Скуг Д., Уэст Д. Основы аналитической химии. В 2 т. Пер с англ. М.: Мир, 1979, - 438 с.
7. Бусев А. И. Аналитическая химия молибдена. М.: Издательство АН СССР, 1962, - 300с.
8. Химия и технология редких и рассеянных элементов. Ч. ІІІ. М.: Высшая школа, 1976, 320 с.