
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Принцип роботи ядерного реактора
Реферат: Принцип роботи ядерного реактора
Тема: "Принцип роботи ядерного реактора"
ЗМІСТ
ЯДЕРНИЙ РЕАКТОР
РЕАКТОР РОЗМНОЖУВАЧ
ТЕПЛОВИЙ РЕАКТОР
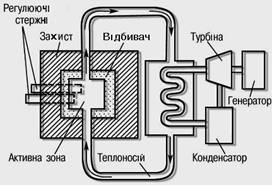
СХЕМА РЕАКТОРА
ЯДЕРНА ЕНЕРГІЯ
МЕХАНІЗМИ ЯДЕРНИХ РЕАКЦІЙ
ЛАНЦЮГОВА РЕАКЦІЯ
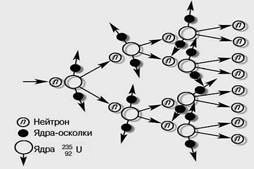
СХЕМА ЛАНЦЮГОВОЇ РЕАКЦІЇ
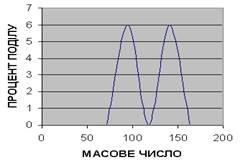
ГРАФІК
ТЕРМО ЯДЕРНА РЕАКЦІЯ
КЕРОВАНИЙ ТЕРМОЯДЕРНИЙ СИНТЕЗ
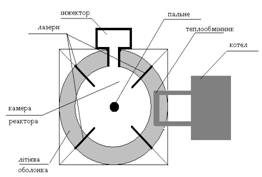
СХЕМА ТЕРМОЯДЕНОГО РЕАКТОРА
УРАН
ПЛУТОНІЙ
ЯДЕРНИЙ РЕАКТОР (атомний реактор), пристрій для здійснення керованої ядерної ланцюгової реакції розподілу. Перший ядерний реактор пущений у 1942 у США (у СРСР у 1946). Розподіл ядер відбувається в активній зоні реактора, у якій зосереджене ядерне паливо, і супроводжується вивільненням значної кількості енергії. Ядерні реактори розрізняють: по енергії нейтронів, що викликають розподіл ядер (ядерні реактори на теплових, швидких і проміжних нейтронах); по характері розподілу ядерного палива (гомогенному і гетерогенні); по використовуваному сповільнювачі (графітові, водо-водяні й ін.); по призначенню (енергетичного, дослідницькі) і т.д. Використовують для вироблення електричної енергії на атомних електростанціях і в ядерних силових установках атомних судів, для наукових досліджень, відтворення ядерного палива і т.д.
РЕАКТОР-РОЗМНОЖУВАЧ, ядерний реактор, у якому "спалювання" ядерного палива супроводжується розширеним відтворенням вторинного палива. У реакторі-розмножувачі нейтрони, що звільняються в процесі розподілу ядерного палива (напр., 239Pu), взаємодіють з ядрами поміщеного в реактор сировинного матеріалу (напр., 238U), у результаті утвориться вторинне ядерне паливо ( 239Pu). У реакторі-розмножувачі типу бридер відтворене і палива, що спалюється, являють собою ізотопи того самого хімічного елемента (напр., спалюється 235U, відтворюється 233U), у реакторі-розмножувачі типу реактор-конвертер — ізотопи різних хімічних елементів (напр., спалюється 235U, відтворюється 239Pu).
ТЕПЛОВИЙ РЕАКТОР, ядерний реактор, у якому гнітюче число розподілів ядер речовини, що поділяється, відбувається при взаємодії їхній з тепловими нейтронами. Ядерним паливом у тепловому реакторі служить 233U, 235U, 239Pu, 241Pu. Тепловий реактор використовують для виробництва електроенергії, опріснення води, штучного одержання радіоактивних речовин, при технічних іспитах матеріалів і конструкцій і т.д.
ЯДЕРНА ЕНЕРГІЯ (атомна енергія), внутрішня енергія атомних ядер, що виділяється при деяких ядерних перетвореннях. Використання ядерної енергії засновано на здійсненні ланцюгових реакцій розподілу важких ядер і реакцій термоядерного синтезу легких ядер.
МЕХАНІЗМ РОЗПОДІЛУ ЯДЕР У важких ядрах, поряд з великими силами електричного відштовхування, що прагнуть розірвати ядро на частині, діють ще значні ядерні сили, що утримують ядро від розпаду.
Під впливом поглиненого нейтрона ядро збуджується і починає деформуватися, здобуваючи витягнуту форму. Воно розтягується доти, поки сили відштовхування половинок ядра не починають переважати над силами притягання, що діють у перешийку. У результаті ядро розривається на двох частин (так називані осколки). Під дією кулоновського відштовхування осколки розлітаються зі швидкістю, рівної 1/30 швидкості світла; одночасно випускається випромінювання високої частоти. Велика частина виділюваної енергії приходиться на кінетичну енергію осколків.
ЯДЕРНА ЛАНЦЮГОВА РЕАКЦІЯ Не всі ядра здатні до розподілу. Найбільше легко поділяється ізотоп урану 23592U, що складає 1/140 від більш розповсюдженого ізотопу 23892U. Цей розподіл викликається як повільними(ПОВІЛЬНІ НЕЙТРОНИ; нейтрони з енергіями менше 100 кэВ.), так і швидкими нейтронами(ШВИДКІ НЕЙТРОНИ, нейтрони з енергіями більше 100 кэВ), що потрапили в ядро. При кожнім акті розподілу ядра випускається 2-3 нейтрона, що у свою чергу можуть викликати розподіл інших ядер. У результаті виникає ядерна ланцюгова реакція. Вона супроводжується виділенням величезної енергії. При розподілі одного ядра виділяється близько 200 Мэв. При повному ж розподілі ядер, що знаходяться в 1 м урану, виділяється енергія 2,3*104 квт·ч. Це еквівалентно енергії, одержуваної при згорянні 3 т вугілля або 2,5 т нафти.
Керована реакція розподілу ядер використовується в ядерних реакторах. Імовірність захоплення ядрами урану повільних нейтронів з наступним розподілом ядер у сотні разів більше, ніж швидких. Тому в ядерних реакторах, що працюють на природному урані, використовуються сповільнювачі нейтронів. Кращим сповільнювачем нейтронів є важка вода. Гарним сповільнювачем вважається також графіт, ядра якого не поглинають нейтронів. Ланцюгова реакція починає йти, як тільки маса речовини, що поділяється, перевищує якусь критичну масу. Керування реактором здійснюється за допомогою стрижнів, що містять кадмій або бор, що є гарними поглиначами нейтронів.
Некерована ланцюгова реакція здійснюється в атомній бомбі. Для того, щоб відбувалося практично миттєве виділення енергії (ядерний вибух), реакція повинна йти на швидких нейтронах (без сповільнювачів). Вибуховою речовиною служить чистий уран 23592U або плутоній 23994Pu.
Здатність до поділу залежно від маси осколка
ТЕРМОЯДЕРНА РЕАКЦІЇ Виділення енергії при злитті ядер легких атомів дейтерію, тритію або літію з утворенням гелію відбувається в ході термоядерних реакцій. Ці реакції називаються термоядерними, тому що можуть протікати лише при дуже високих температурах. У противному випадку, сили електричного відштовхування не дозволяють ядрам зблизитися настільки, щоб почали діяти ядерні сили притягання. Реакції ядерного синтезу є джерелом зоряної енергії. Цієї ж реакції протікають при вибуху водневої бомби.
Здійснення керованого термоядерного синтезу на Землі обіцяє людству новий, практично невичерпне джерело енергії. Найбільш перспективна в цьому відношенні реакція злиття дейтерію і тритію. Економічно вигідна реакція може йти тільки при нагріванні реагуючих речовин до температури порядку 108 До при великій густині речовини (1014-1015 часток у 1 див3). Такі температури можуть бути досягнуті шляхом створення в плазмі могутніх електричних розрядів. Основні труднощі полягають у тім, щоб удержати плазму настільки високої температури усередині установки протягом 0,1-1,0 с. Через нестійкість високотемпературної плазми ця задача поки залишається невирішеної, і як промислове джерело ядерної енергії в даний час використовуються тільки реакції розподілу ядер.
КЕРОВАНИЙ ТЕРМОЯДЕРНИЙ СИНТЕЗ (УТС), наукова проблема здійснення синтезу легких ядер з метою виробництва енергії. Рішення проблеми буде досягнуто в плазмі при температурі Т > 108К и виконанні Лоусона критерію (nt > 1014 див-3·с, де n — щільність високотемпературної плазми; t — час утримання її в системі). Дослідження проводяться в квазістаціонарних системах (t > 1 з, n +> 1014 див-3) і імпульсних системах (t ~ 10-8 з, n > 1022 див-3). У перших (токамаки, стеллараторы, дзеркальні пастки і т.д.) утримання і термоізоляція плазми здійснюються в магнітних полях різної конфігурації. В імпульсних системах плазма створюється при опроміненні твердої мішені (крупинки суміші дейтерію і тритію) сфальцьованим випромінюванням могутнього лазера або електронних пучків: при влученні у фокус пучка малих твердотельных мішеней відбувається послідовність термоядерних мікровибухів. Рішення проблеми УТС забезпечить людство енергією практично на необмежений термін.
Принципова схема термоядерного реактора в якому нагрів здійснюється за допомогою лазера.
УРАН (лат. Uranium), U (читається "уран"), радіоактивний хімічний елемент з атомним номером 92, атомна маса 238,0289. Актиноид. Природний уран складається із суміші трьох ізотопів: 238U, 99,2739%, з періодом напіврозпаду Т1/2 = 4,51·109 років, 235U, 0,7024%, з періодом напіврозпаду Т1/2 = 7,13·108 років, 234U, 0,0057%, з періодом напіврозпаду Т1/2 = 2,45·105 років. 238U (уран-I, UI) і 235U (актиноуран, Ас) є родоначальниками радіоактивних рядів. З 11 штучно отриманих радіонуклідів з масовими числами 227-240 долгоживущий 233U ( Т1/2 = 1,62·105років), він виходить при нейтронному опроміненні тория.
Конфігурація трьох зовнішніх електронних шарів 5 s 2 p 6 d 10 f 3 6 s 2 p 6 d 17 s 2, уран відноситься до f-елементів. Розташований у IIIB групі в 7 періоді періодичної системи елементів. У сполуках виявляє ступеня окислювання +2, +3, +4, +5 і +6, валентності II, III, IV, V і VI.
Радіус нейтрального атома урану 0,156 нм, радіус іонів: U3+ — 0,1024 нм, U4+ — 0,089 нм, U5+ — 0,088 нм і U6+— 0,083 нм. Енергії послідовної іонізації атома 6,19, 11,6, 19,8, 36,7 ев. Электроотрицательность по Полингу 1,22.
ІСТОРІЯ ВІДКРИТТЯ Уран був відкритий у 1789 німецьким хіміком М. Г. Клапротом при дослідженні мінералу "смоляної обманки". Названий їм на честь планети Уран, відкритої У. Гершелем у 1781. У металевому стані уран отриманий у 1841 французьким хіміком Э. Пелиго при відновленні UCl4металевим калієм. Радіоактивні властивості урану знайшов у 1896 француз А. Беккерель.
Спочатку уранові приписували атомну масу 116, але в 1871 Д. И. Менделєєв прийшов до висновку, що її треба подвоїти. Після відкриття елементів з атомними номерами від 90 до 103 американський хімік Г. Сиборг прийшов до висновку, що ці елементи (актиноиды) вірніше розташовувати в періодичній системі в одній клітці з елементом №89 актинієм. Таке розташування зв'язане з тим, що в актиноидов відбувається добудування 5 f-электоронного подуровня.
ЗНАХОДЖЕННЯ В ПРИРОДІ Уран — характерний елемент для гранітного шару й осадової оболонки земної кори. Зміст у земній корі 2,5·10-4% по масі. У морській воді концентрація урану менш 10-9 г/л, усього в морській воді утримується від 109 до 1010 тонн урану. У вільному виді уран у земній корі не зустрічається. Відомо близько 100 мінералів урану, найважливіші з них настуран U3O8, уранініт (U,Th)O2, уранова смоляна руда (містить оксиди урану перемінної сполуки) і тюямунит Ca[(UO2)2(VO4)2]·8H2O.
ОДЕРЖАННЯ Уран одержують з уранових руд, що містять 0,05-0,5% U. Витяг урану починається з одержання концентрату. Руди выщелачивают розчинами сарною, азотної кислот або лугом. В отриманому розчині завжди утримуються домішки інших металів. При відділенні від них урану, використовують розходження в їхніх окислювально-відновних властивостях. Окислювально-відновні процеси сполучать із процесами іонного обміну й екстракції.
З отриманого розчину уран витягають у виді оксиду або тетрафторида UF4, методом металлотермии:
UF4+ 2Mg = 2Mg2+ U
Уран, що утворився, містить у незначних кількостях домішки бор , кадмій і деякі інші елементи, так званих реакторних отрут. Поглинаючи нейтрони, що утворяться при роботі ядерного реактора, вони роблять уран непридатним для використання як ядерне пальне.
Щоб позбутися від домішок, металевий уран розчиняють в азотній кислоті, одержуючи уранилнитрат UO2(NO3)2. Уранилнитрат екстрагують з водного розчину трибутилфосфатом. Продукт очищення з екстракту знову переводять в оксид урану або в тетрафторид, з яких знову одержують метал.
Частина урану одержують регенерацією ядерного пального, що відробив у реакторі. Всі операції по регенерації урану проводять дистанційно.
ХІМІЧНІ ВЛАСТИВОСТІ Уран — сріблисто-білий блискучий метал. Металевий уран існує в трьох аллотропичних модифікаціях. До 669°C стійка a-модифікація з орторомбичної ґратами, параметри а = 0,2854нм, у = 0,5869 нм і з = 0,4956 нм, щільність 19,12 кг/дм3. Від 669°C до 776°C стійка b-модифікація з тетрагональними ґратами (параметри а = 1,0758 нм, з = 0,5656 нм). До температури плавлення 1135°C стійка g-модифікація з кубічною об’ємно-центрированої ґратами ( а = 0,3525 нм). Температура кипіння 4200°C.
Хімічна активність металевого урану висока. На повітрі він покривається плівкою оксиду. Порошкоподібний уран пирофорен, при згорянні урану і термічному розкладанні багатьох його сполук на повітрі утвориться оксид урану U3O8. Якщо цей оксид нагрівати в атмосфері водню при температурі вище 500°C, утвориться диоксид урану UO2:
U3O8 + Н2 = 3UO2 + 2Н2ПРО
Якщо уранилнитрат UO2(NO3)2 нагріти при 500°C, то, розкладаючи, він утворить триоксид урану UO3. Крім оксидів урану стехиометричного сполуки UO2, UO3 і U3ПРО8, відомий оксид урану сполуки U4O9 і кілька метастабільних оксидів і оксидів перемінної сполуки.
При сплавці оксидів урану з оксидами інших металів утворяться уранати: ДО2UO4 (уранат калію), СаUо4 (уранат кальцію), Na2U2O7 (диуранат натрію).
Взаємодіючи з галогенами, уран дає галогеніди урану. Серед них гексафторид UF6 являє собою жовта кристалічна речовина, що легко сублімується навіть при слабкому нагріванні (40-60°C) і настільки ж легко гидролизующееся водою. Найважливіше практичне значення має гексафторид урану UF6. Одержують його взаємодією металевого урану, оксидів урану або UF4 із фтором або фторирующими агентами Br3, Ссl3F (фреон-11) або Ссl2F2 (фреон-12):
U3O8+ 6CCl2F2 = UF4 + 3COCl2 + CCl4 + Cl2
UF4+ F2= UF6
або
U3O8+ 9F2 = 3UF6+ 4O2
Відомі фториди і хлориди, що відповідають ступеням окислювання урану +3, +4, +5 і +6. Отримано броміди урану UBr3, UBr4 і UBr5, а також иодіди урану UI3 і UI4. Синтезовано такі оксигалогеніди урану, як UO2Cl2 UOCl2 і інші.
При взаємодії урану з воднем утвориться гідрид урану UH3, що володіє високою хімічною активністю. При нагріванні гідрид розкладається, утворити водень і порошкоподібний уран. При спіканні урану з бором виникають, у залежності від молярного відношення реагентів і умов проведення процесу, бориди UB2, UB4 і UB12.
З вуглецем уран утворить три карбіди UC, U2C3 і UC2.
Взаємодією урану з кремнієм отримані силіциди U3Si, U3Si2, USi, U3Si5, USi2 і U3Si2.
Отримано нітриди урану (UN, UN2, U2N3) і фосфіди урану (UP, U3P4, UP2). Із сіркою уран утворить ряд сульфідів: U3S5, US, US2, US3 і U2S3.
Металевий уран розчиняється в HCl і HNO3, повільно реагує з H2SO4 і H3PO4. Виникають солі, що містять катіон уранілу UO22+.
У водних розчинах існують сполуки урану в ступенях окислювання від +3 до +6. Стандартний окисний потенціал пари U(IV)/U(III) — 0,52 B, пари U(V)/U(IV) 0,38 B, пари U(VI)/U(V) 0,17 B, пари U(VI)/U(IV) 0,27. Іон U3+ у розчині хитливий, іон U4+ стабільний під час відсутності повітря. Катіон UO2+ нестабільний і в розчині диспропорціонує на U4+і UO22+. Іони U3+ мають характерне червоне фарбування, іони U4+ — зелену, іони UO22+ — жовту.
У розчинах найбільш стійкі сполуки урану в ступені окислювання +6. Усі сполуки урану в розчинах схильні до гідролізу і комплексоутворенню, найбільше сильно — катіони U4+ і UO22+.
Застосування металічного урану і його сполук використовуються в основному як ядерне пальне в ядерних реакторах. Малозбагачена суміш ізотопів урану застосовується в стаціонарних реакторах атомних електростанцій. Продукт високого ступеня збагачення — у ядерних реакторах, що працюють на швидких нейтронах. 235U є джерелом ядерної енергії в ядерній зброї. 238U служить джерелом вторинного ядерного пального — плутонію.
ФІЗІОЛОГІЧНА ДІЯ. В мікрокількостях (10-5-10-8 %) виявляється в тканинах рослин, тварин і людину. Найбільшою мірою накопичується деякими грибами і водоростями. Сполуки урану всмоктуються в шлунково-кишковому тракті (близько 1%), у легенях — 50%. Основні депо в організмі: селезінка, бруньки, кістяк, печінка, легкі і бронхо-леглегеневі лімфатичні вузли. Зміст в органах і тканинах людини і тварин не перевищує 10-7 р.
Уран і його сполуки високотоксичні. Особливо небезпечні аерозолі урану і його сполук. Для аерозолей розчинних у воді сполук урану ПДК у повітрі 0,015 мг/м3, для нерозчинних форм урану ПДК 0,075 мг/м3. При влученні в організм уран діє на всі органи, будучи загальклітинною отрутою. Молекулярний механізм дії урану зв'язаний з його здатністю придушувати активність ферментів. У першу чергу уражаються бруньки (з'являються білок і цукор у сечі, олигурія). При хронічній інтоксикації можливі порушення кровотворення і нервової системи.
ПЛУТОНІЙ (лат. Plutonium, від назви планети Плутон), Pu (читається "плутоній"), радіоактивний штучно отриманий хімічний елемент, атомний номер 94. Стабільних нуклідів не має. Відноситься до актиноидам, розташований у IIIB групі, у 7 періоді періодичної системи. Електронна конфігурація трьох зовнішніх шарів незбудженого атома 5 s 2 p 6 d 10 f 66 s 2 p 67 s2. У сполуках виявляє ступеня окислювання +3, +4 (найбільш стійка), +5, +6 і +7 (валентності III, IV, V, VI і VII).
Радіус нейтрального атома Pu 0,160 нм, іонів Pu3+ 0,0974 нм, Pu4+ 0,0896 нм, Pu 5+ 0,087 нм, Pu 6+0,081 нм. Енергія іонізації нейтрального атома 5,71 ев. Електронегативність по Полингу 1,2.
Історія відкриття
Уперше Pu одержали в 1940 американські дослідники Г. Сиборг , Э. М. Макмилан, Дж. Кеннеді й А. Валь опроміненням 238U розігнаними на прискорювачі ядрами дейтерію:
23892U + 21H = 23893Np + 21 n.
Що утвориться 238Np за рахунок швидкого --перетворення ( Т1/2 2,117 сут) дає 238Pu (a-радіоактивний, Т1/2 87,74 роки). З побоювання створення ядерної зброї в роки Другої світової війни зведення про одержання плутонію були опублікували тільки в 1946. У 1942 американські фізики одержали 239Pu опроміненням нейтронами 238U. До дійсного часу отримані 15 ізотопів Pu з масовими числами 232-246. Найбільш стійкі 244Pu (a-розпад, Т1/2 = 8,26.107 років) і 242Pu (a-розпад, Т1/2 = 3,76.105 років).
ЗНАХОДЖЕННЯ В ПРИРОДІ В природі зустрічається в незначних кількостях в уранових рудах (239Pu), він утвориться з урану під дією нейронів, джерелом яких є спонтанний розподіл ядер U і космічне випромінювання.
ОДЕРЖАННЯ В даний час плутоній (його радіонуклід 239Pu у суміші з невеликою домішкою 240Pu) одержують із продуктів опромінення урану в ядерних реакторах. При відділенні плутонію від урану і нептунія використовують розходження в стійкості ступенів окислювання +4, +5 і +6 для Pu (найбільш стійкий у розчині в ступені окислювання +4), Np (найбільш стійкий у розчині в ступені окислювання +5) і U (найбільш стійкий у розчині в ступені окислювання +6). Світове виробництво плутонію складає кілька десятків тонн у рік.
Для одержання металевого плутонію тетрафторид Pu4 або трихлорид плутонії PuCl3 відновлюють магнієм або кальцієм при нагріванні:
Pu4 + 2Са = 2Са2 + Pu
ФІЗИЧНІ І ХІМІЧНІ ВЛАСТИВОСТІ Плутоній — тендітний сріблистий метал. До температури плавлення, 640°C, існує в шести поліморфних модифікаціях: a, b, g, d, d' (іноді позначається h) і e. Кожне поліморфне перетворення супроводжується перебудовою атомів плутонію в кристалічних ґратах і зміною щільності (крім перетворення модифікацій d d'). При 320-480°C плутоній не розширюється, як інші метали, а стискується.
Стійка при температурах до 122°C a-модифікація має моноклінні ґрати, з а = 0,6183 нм, у = 0,4822 нм і з = 0,1,096 нм, кут 101,79°. Щільність Pu при 20°C 19,86 кг/дм3. Температура кипіння 3352°C.
Компактний плутоній повільно окисляється на повітрі, порошок загоряється при нагріванні до 300°C. Повільно взаємодіє з водою. Легко розчиняється в соляній, фосфорній і хлорній кислотах, пасивується концентрованими сірчаною, оцтовою й азотною кислотами. У лугах не розчиняється.
При прожарюванні на повітрі сполук плутонію (крім фториду) утвориться диоксід Pu2. Відновлення воднем при нагріванні або нагрівання диоксіда у вакуумі дає Pu2O3. Отримано оксиди плутонію перемінних сполук Pu2-Pu2O3.
Плутоній реагує з галогенами. З фтором утворить фториди Pu6, Pu4, Pu3. Для інших галогенів отримані тригалогеніди сполук Pu3. Отримані також оксигалогеніди сполук PuOX і сполуки Pu з S,P, Si і іншими неметалами.
У кислих водних розчинах Pu існує у виді катіонів Pu3+(колір у розчині синьо-фіолетовий), Pu4+(колір жовто-коричневий), Рuо2+?, плутоноил-ион (колір ясно-рожевий), Рuо22+, плутонил-ион (колір рожево-жовтогарячий). Для іонів Pu4+ і Рuо2+ у розчинах характерні реакції диспропорціонування:
3Pu4+ + 2Н2ПРО = 2Pu3+ + Рuо22+ +4Н+
2Рuо2+ + 4Н+ = Pu4+ + Рuо22+ + Н2ПРО
Плутоній у ступені окислювання +7 вперше одержали в 1967 радянські хіміки Н. Н.Кріт і А. Д.Гельман окислюванням Рuо22+ озоном у лужному середовищі.
Плутоній у ступені окислювання +4 у розчинах утворить стійкі комплекси з різними лигандами (з ацетилацетонатом, цитратом, ацетатом).
При дії лугів на розчини, що містять Pu4+, випадає осад гідроксиду плутонію Pu(OH)4·x2O, що володіє основними властивостями. При дії лугів на розчини солей, що містять Pu2+, випадає амфотерний гідроксид Pu2OH. Йому відповідають солі — плутоніти, наприклад, Na2Pu2O6.
При додаванні лугу до розчину солі Pu(VI) утворяться солі плутонієвих кислот плутонати типу Na2Pu4 і поліплутонати.
Стандартний окисний потенціал пари Pu(IV)/Pu(III) +0,982 B, пари Pu(V)/Pu(IV) +1,170 B, пари Pu(VI)/Pu(IV) +1,043 B, пари Pu(VI)/Pu(III) +1,023 B.
ЗАСТОСУВАННЯ 239Pu використовують як ядерне пальне в ядерних реакторах, при виготовленні плутонієвих бомб. Критична маса 239Pu у виді металу складає 5,6 кілограм. Ізотоп 239Pu є вихідною речовиною для одержання в ядерних реакторах транс плутонієвих елементів (америцію , кюрію ).
238Pu використовують у малогабаритних ядерних джерелах електричного струму, використовуваних у космічних дослідженнях і стимуляторах серцевої діяльності.
ФІЗІОЛОГІЧНА ДІЯ плутоній і його сполуки високотоксичні. Для 239Pu ПДК у повітрі робочих приміщень 3,3·10-2 Бк/м3, у воді відкритих водойм 8,14·10-4 Бк/л.
Існують кілька типів реакторів, які мають свої особливості залежно від палива, сповільнювачів, але у всіх використовується теплова дія ядерних зв’язків, що зумовлює низький ККД таких установок, та це компенсується їхньою високою потужністю. Не слід також забувати, про ті, що: відпрацьоване пальне є небезпечним для живих організмів, як зрештою і сам реактор. Тому вчені багатьох країн працюють над покращенням існуючих і розробкою принципово нових, базованих не на розпаді важких, а на синтезі легенях. Для цього слід подолати кілька завад, але якщо це вдасться те людство буде забезпечено майже даровою енергією. І не буде використовувати обмежені природні ресурси.
СПИСОК ЛІТЕРАТУРИ
І.Д.ЖЕЖНИЧ, Б.В.ШТОГРИН Фізика означення, формули, задачі
А.І.КИТАЙГОРОДСЬКИЙ Фотоні і ядра
Енциклопедія Кирила і Мефодія