
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Витамин С: структура, химические свойства, значение
Курсовая работа: Витамин С: структура, химические свойства, значение
1 Открытие витамина с и установление его структуры
1.1 Выделение
Годы после окончания первой мировой войны были ознаменованы бурным развитием работ, направленных на выделение неуловимого витамина. И в США, и в Европе развернулась настоящая гонка, в финале которой победителя ожидали огромный научный престиж и солидная финансовая поддержка. Соломон Цильва и его группа в Листеровском институте лихорадочно пытались выделить витамин С из концентрированных цитрусовых соков. И хотя полученный ими препарат обладал сильнейшим антискорбутным действием, все попытки получить чистое кристаллическое вещество оставались тщетными. Крушение надежд испытала также и ведущая американская группа под руководством Чарльза Кинга из Питсбургского университета. Основным камнем преткновения было то, что витамин С, будучи углеводоподобным веществом, очень трудно поддавался очистке от других углеводов, присутствующих в концентрированных фруктовых соках. И тут, несмотря на кропотливую и самоотверженную работу названных групп, по иронии судьбы на сцене появился никому не известный венгерский ученый Альберт Сент-Дьёрдьи.
Абсолютно без денег, но обогащенный ценным опытом, в 1922 г. Сент-Дьёрдьи очутился в датском университетском городе Гронинген, где получил должность ассистента профессора физиологии X. Дж. Хамбергера. Благодаря своему острому чутью он буквально почувствовал казавшуюся невероятной связь между пигментацией кожи пациентов, страдающих болезнью Аддисона (вызванной нарушением функции надпочечников), и потемнением свежего среза картофеля, яблока и груши. Было известно, что такое потемнение вызвано нарушением окислительно-восстановительного процесса. Апельсины и лимоны не темнеют на срезе, и в их соке, а позже в соке капусты Сент-Дьёрдьи обнаружил сильный восстановитель. Присутствие аналогичного вещества было обнаружено им и в экстракте коры надпочечников коровы. Далее Сент-Дьёрдьи решил выделить это соединение, которое, как он полагал, могло оказаться новым гормоном надпочечников.
После непродолжительной и безуспешной попытки выделения, предпринятой в Лондонской лаборатории сэра Генри Дейла в начале 1925 г., он вернулся в Гронинген. Не найдя общего языка с новым руководством, Сент-Дьёрдьи отослал семью обратно в Будапешт, а сам отказался от должности и прошел через период глубокой депрессии. Вскоре, однако, ему улыбнулась удача. На конференции в Стокгольме он встретился с ныне всемирно известным биохимиком профессором Фредериком Хопкинсом, которому понравилась одна из его статей. Результатом этой встречи стало приглашение работать в Кембридже. Сент-Дьёрдьи выписал семью и целиком погрузился в работу, сделавшую впоследствии ему имя. После многих разочарований наконец удалось накопить менее грамма беловатого кристаллического вещества из коры надпочечников крупного рогатого скота, где оно содержалось в весьма незначительных количествах (около 300 мг/кг исходного материала), а позже из апельсинового и капустного соков. Процесс выделения „восстанавливающего фактора" заключался в следующем:
1. Замороженные надпочечники измельчали и экстрагировали метанолом, пропуская углекислый газ для предотвращения контакта с кислородом воздуха.
2. Восстанавливающий фактор высаживали из профильтрованного экстракта добавлением раствора ацетата свинца.
3. Осадок суспендировали в воде и добавляли серную кислоту..
При этом выпадал осадок сульфата свинца, а восстанавливающий фактор оставался в растворе.
4. Фильтрат упаривали под вакуумом.
5. Сухой остаток снова экстрагировали метанолом и повторялистадии 2, 3 и 4.
6. Сухой остаток растворяли в ацетоне, и при добавлении избытка петролейного эфира постепенно выпадали кристаллы восстанавливающего фактора.
Как типичный восстановитель, полученное вещество обесцвечивало йод, и исходя из суммарной массы продуктов реакции, был сделан вывод, что относительная молекулярная масса соединения равна 88,2 или кратна этому значению. Молекулярная масса, найденная методом понижения давления паров воды, составила около 180, что соответствовало точному значению 176,4. И, наконец, элементный анализ дал 40,7% углерода, 4,7% водорода и 54,6% кислорода, что позволило окончательно вывести формулу С6Н8О6.
Хопкинс настаивал на публикации этой работы, полагая, что Сент-Дьёрдьи выделил и охарактеризовал новый гормон углеводной природы с кислотными свойствами. Однако при сдаче статьи в печать возникли осложнения. Дело в том, что Сент-Дьёрдьи из озорства назвал новое соединение „ignose" (nose — нос), что, по его замыслу, должно было означать вещество углеводной природы с неизвестной структурой. Это название было отвергнуто редакцией, тогда Сент-Дьёрдьи представил новый вариант „Godnose" (в буквальном переводе Божий нос). И только когда рассерженный редактор пригрозил, что статья не будет опубликована до тех пор, пока не будет выбрано подходящее название, Сент-Дьёрдьи сдался и принял предложение редакции присвоить новому соединению название „гексуроновая кислота". Итак, в 1928 г. в Biochemical Journal эта основополагающая работа увидела свет. Несомненно, что этот забавный анекдот неоднократно всплывал в послеобеденных беседах. Интересно отметить, что в статье Сент-Дьёрдьи высказывал предположение о том, что восстанавливающие свойства фруктовых соков могут быть также обусловлены присутствием гексуроновой кислоты. Еще немного — и истина была бы установлена, тем не менее идея о том, что во всех случаях мы имеем дело с одним и тем же вездесущим веществом, уже носилась в воздухе.
В следующем году Сент-Дьёрдьи посетил США, где провел некоторое время в клинике Мэйо в Рочестере, шт. Миннесота. Многочисленные скотобойни в окрестностях Рочестера поставляли в изобилии свежие надпочечники, и ему удалось наработать 25 г гексуроновой кислоты, что составляло несметное богатство. Половина этого количества была немедленно отправлена в Англию в
Бирмингем профессору Норману Хеуорсу для структурных исследований. К сожалению, этого количества оказалось недостаточно для установления структуры, которая так и осталась в тот раз тайной.
Казалось, что на протяжении всей жизни Сент-Дьёрдьи сопутствовала удача быть в нужном месте в нужное время. Так оказалось и на этот раз. Последовавшее приглашение министра образования Венгрии дало ему возможность с триумфом вернуться на родину, и летом 1930 г. Сент-Дьёрдьи вступил в должность профессора медицинской химии в Сегеде, расположенном в ста милях южнее Будапешта. Он быстро приобрел репутацию неортодоксального и доступного руководителя, одинаково любимого и коллегами, и студентами. Годом позже ведущий сотрудник группы профессора Кинга из Питсбурга Джо Свирбли вернулся на родину и тоже начал работать в Сегеде. Мысль о том, что его беловатые кристаллы могут оказаться витамином С, все больше и больше овладевала Сент-Дьёрдьи, но витамины не входили в круг его научных интересов, и, кроме того, он ненавидел клинические испытания. Приезд Свирбли позволил всесторонне проверить эту идею, и к весне 1932 г. была установлена полная идентичность гексуроновой кислоты и витамина С.
1.2 Установление структуры
На этот раз бирмингемская группа имела в своем распоряжении достаточное количество кристаллов. Были известны молекулярная формула соединения (С6H8O6), точка плавления (191°С) и угол оптического вращения (+23° в воде). Тем не менее расшифровка структуры потребовала увлекательной, почти детективной работы, так характерной для органической химии в те легендарные годы. Ответственность за работу была возложена на Эдмунда Херста, который работал под руководством Хеуорса еще в Дареме.
При кипячении в соляной кислоте кристаллы давали фурфурол с количественным выходом, что свидетельствовало о том, что по крайней мере пять из шести атомов углерода образуют неразветвленную цепь. Дальнейшие опыты показали, что аскорбиновая кислота является слабой одноосновной кислотой и сильным восстановителем. Первая стадия окисления, которая легко обратима, может быть проведена с помощью водного раствора иода, подкисленного бензохиноном, или молекулярного кислорода в присутствии солей меди при рН 5. Продукт окисления, которое приводило к отщеплению двух атомов водорода, был назван дегидроаскорбиновой кислотой (С6Н6Об)- Обратимое окисление иодом протекало аналогично известной реакции с 2,3-дигидроксималеиновой кислотой:
НООСС(ОН) = С(ОН)СООН + I2 →НООССО - СОСООН + 2HI
что позволяло предположить наличие ендиольной группировки С(ОН) = С(ОН). Сходство в спектрах поглощения аскорбиновой
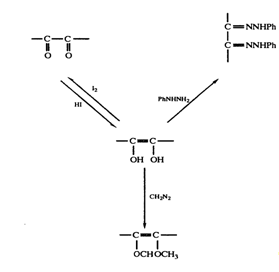
Рис. 1. Реакции ендиольной группировки.
и дегидроксималеиновой кислот с единственной интенсивной полосой при 245 нм подтвердило это предположение. В дальнейшем присутствие ендиольной группировки было доказано следующим образом: 1) при обработке диазометаном получалась диметиласкорбиновая кислота; 2) взаимодействие с фенилгидразином после первоначального окисления приводило к образованию озазона (рис. 3.1). Первоначально кислотные свойства аскорбиновой кислоты приписывались наличию карбоксильной группы. Однако было показано, что дегидроаскорбиновая кислота — это нейтральный лактон, который медленно гидролизуется, высвобождая карбоксильную группу. Легкость взаимных превращений дегидроаскорбиновой и аскорбиновой кислот указывала на то, что
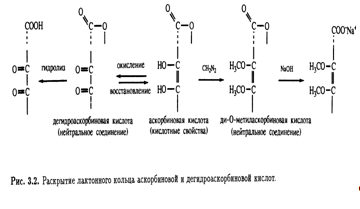
последняя также является лактоном. Эта точка зрения подкреплялась и тем фактом, что диметиласкорбиновая кислота, будучи нейтральным соединением, при обработке гидроксидом натрия дает натриевую соль без отщепления метильной группы, т. е. происходит раскрытие лактонного кольца (рис. 3.2).
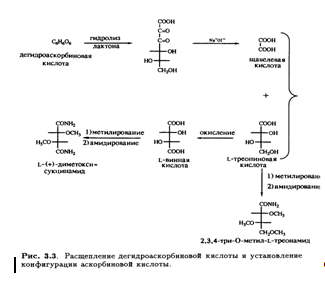
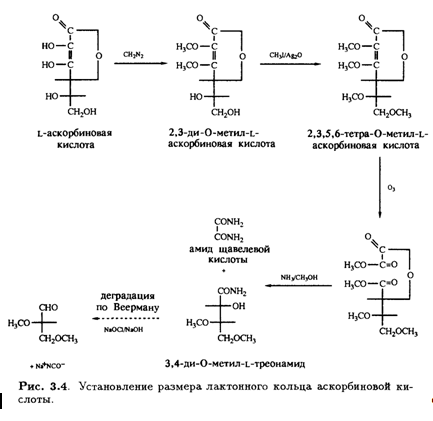
Кроме того, было известно, что в молекуле присутствуют еще две спиртовые ОН-группы, которые при обработке ацетоном образуют производное изопропилидена, также содержащее два енольных гидроксила. Дальнейшее окисление дегидроаскорбиновой кислоты гипоиодитом натрия в щелочной среде приводит к образованию щавелевой и L-треониновой кислот, причем последняя была идентифицирована по ее последовательным превращениям в известные со соединения — L-диметоксисукцинамид и три-О-метил-ь-треонамид. Описанные превращения помогли установить стереохимическое родство природной L-аскорбиновой кислоты и углеводов L-ряда, а также выяснить, что карбонильная группа лактона соседствует непосредственно с ендиольной группировкой (рис. 3.3). Теперь необходимо было выяснить размер лактонного кольца, и это удалось сделать в результате еще одного простого эксперимента. Было известно, что при обработке диазометаном L-аскорбиновая кислота превращается в ди-О-метильное производное. Дальнейшее метилирование иодметаном в присутствии оксида серебра приводит к образованию тетра-О-метилированного соединения, озонолиз которого дает единственный продукт — нейтральный эфир. Под действием аммиака в метаноле эфир деградирует с образованием амида щавелевой кислоты и 3,4-ди-О-метил-Ь-треонамида; последний был идентифицирован по характерной для 2-гидроксиамидов реакции Веермана. Так было показано, что лактонное кольцо замыкается по положению С-2 треонамида, эквиэквивалентного положению С-4 тетра-О-метиласкорбиновой кислоты (рис. 3.4). Таким образом было установлено, что аскорбиновая кислота является 7-лактоном, который изображен на рис. 3.5.
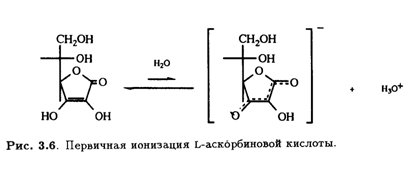
Надо отметить, что в растворе в небольших количествах могут присутствовать и другие таутомерные формы. Асимметрический центр при С-5 имеет L- конфигурацию (или S-конфигурацию согласно системе Кана — Ингольда — Прелога). Кислотные свойства раствора аскорбиновой кислоты обусловлены ионизацией ендиольного гидроксила при С-3 (рКа 4,25), что приводит к делокализации отрицательного заряда в образующемся анионе.
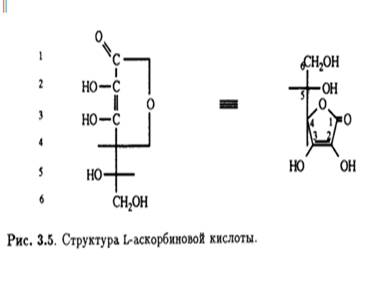
1.3 Уточнение структуры с помощью инструментальных методов
Развитие и совершенствование спектроскопических методов, последовавшее в годы после успешного установления структуры L-аскорбиновой кислоты, позволило более глубоко проникнуть в структуру молекулы.
1.3.1 Дифракция рентгеновского излучения
Впервые рентгеноструктурный анализ L-аскорбиновой кислоты был выполнен еще в начале 30-х гг. с целью помочь структурным исследованиям, проводимым в Бирмингеме, и фактически подтвердил выводы бирмингемской группы. В 60-е гг. в работе Хвослефа из Осло, выполненной с помощью методов рентгеновской и нейтронной дифракции, было обнаружено, что кристаллы аскорбиновой кислоты относятся к моноклинной пространственной группе с четырьмя молекулами в элементарной ячейке. В кристалле существует два типа молекул (А и В) с восемью межмолекулярными водородными связями (рис. 3.7).
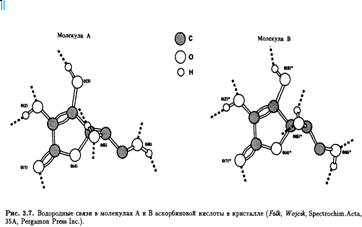
Конформации молекул А и В фактически идентичны в том смысле, что в обоих случаях С-5—ОН расположена антиперипланарно относительно С-4—Н и С-6-ОН (рис. 3.8). Соли L-аскорбиновой кислоты содержат резонансно-стабилизированный аскорбатный анион, образующийся при депротонировании
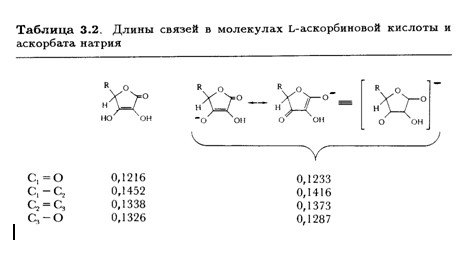
С-3—ОН. Рентгеноструктурные данные подтверждают ожидаемое изменение длины связей в конъюгированной системе аниона О—С-3=С-2-С-1=О по сравнению с нейтральной молекулой (табл. 3.2).
Во многих солях аскорбиновой кислоты суммарный эффект координированного иона металла и водородного связывания приводит к тому, что С-6—ОН находится в синклинальной (или гош)
ориентации относительно С-5—ОН.
1.3.2 Ультрафиолетовая спектроскопия
УФ-спектр L-аскорбиновой кислоты при рН 2 имеет максимум поглощения при 243 нм (е = 10 000 моль~1дм3см~1), который при рН 7,0 сдвигается в красную область к 265 нм (е = 16 500моль_дм3см~1) за счет депротонирования С-3—ОН группы.
Эти изменения соответствуют π → π* электронному переходу в сопряженной двойной углерод-углеродной связи пятичленного лактонного кольца.
1.3.3 Инфракрасная спектроскопия
В ИК-спектре L-аскорбиновой кислоты имеется ряд интересных
максимумов поглощения.(рис.3.9)
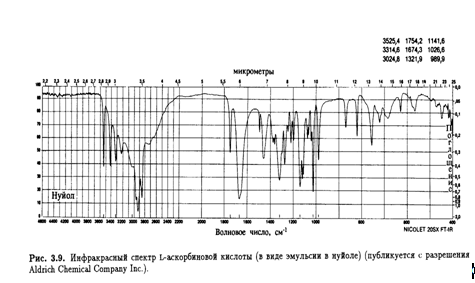
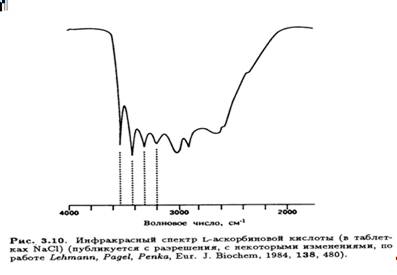
Особенный интерес представляет область валентных колебаний
О—Н от 4000 до 2000 см -1 (рис.3.10).
Так как длины водородных связей (и соответственно прочность) в кристалле известны, можно провести корреляцию этих максимумов поглощения и характеристических валентных колебаний ОН-групп, участвующих в образовании водородных связей. Очевидно, что четыре отчетливых пика в высокочастотном крыле спектра соответствуют спиртовым ОН-группам при С-5 и С-6 боковой цепи (табл. 3.3).

Енольные гидроксилы при С-2 и С-3 участвуют в образовании более прочных водородных связей с укороченным расстоянием О-О (0,261-0,267 нм), что выражается в виде сложной серии уширенных полос в области 3100-2200см -1, соответствующих молекулам А и В. Несомненно, пик с максимумом поглощения 2915 см -1 вблизи высокочастотного крыла спектра является следствием наложения сигналов валентных колебаний С-Н. Что касается низкочастотных сигналов, сильное поглощение при 1754 см -1 было отнесено за счет валентных колебаний группы С=О пятичленного лактонного кольца, а интенсивный дублет при 1675 и 1660 см -1 — за счет валентных колебаний группы С=С (на которые накладываются колебания вдоль всей сопряженной системы). Сигнал при 1460 см -1 приписан ножничным колебаниям группы СН2 .
Несмотря на сложность области характеристических колебаний, были сделаны попытки провести их корреляции, например:
полоса при 1320 см -1 приписана деформации С-2-ОН, полоса при 1275 см -1 — колебаниям С-2—О, полоса при 1140 см -1 — колебаниям С-5—О и полосы при 1025/990 см -1 — деформации лактонного кольца.
1.3.4 Спектроскопия ядерного магнитного резонанса
В спектре 13С ЯМР L-аскорбиновой кислоты при полном подавлении спин-спинового взаимодействия с протонами, как и ожидалось, появились сигналов, которые были соотнесены с конкретными атомами молекулы (рис. 3.11).
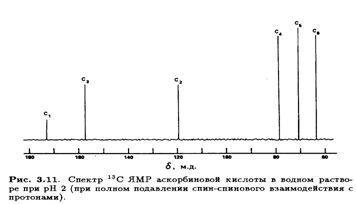
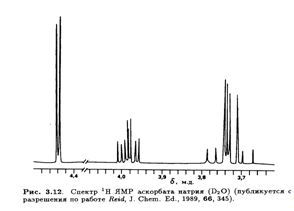
Неполное подавление спин-спинового взаимодействия с протонами приводит к ожидаемому расщеплению сигналов, т. е. С-1, С-2 и С-3 (синглеты), С-4 и С-5 (дуплеты) и С-6 (триплет). Сигналы С-4 и С-5 удалось дифференцировать после того, как был получен спектр при полном подавлении спин-спинового взаимодействия с протонами производного, дейтерированного по положению 4, где сигнал при 77δ м. д. стал триплетом вследствие спин-спинового взаимодействия с дейтерием. Сигнал С-3 был идентифицирован благодаря его большому (19δ м. д.) слабопольному сдвигу при изменении рН от 2 до 7, что приводит к депротонированию С-3—ОН. Особенно интересен спектр 1Н ЯМР L-аскорбиновой кислоты, так как его тщательный анализ позволяет определить конформацию молекулы в водном растворе. При снятии спектра в D2O четыре протона ОН-групп замещаются на дейтерий и не проявляются в виде сигналов. Остальные четыре протона (Н-6, Н-6', Н-5 и Н-4) образуют систему АВМХ, причем протоны при С-6 неэквивалентны из-за хиральности атома С-5.
Тонкая структура этих сигналов не проявляется в низких магмагнитных полях (60 или 100 МГц), но выше 300 МГц обнаруживается спин-спиновое взаимодействие, не являющееся взаимодействием первого порядка. Это расщепление особенно заметно в спектре 1Н ЯМР аскорбата натрия (рис. 3.12).
Значения констант спин-спинового взаимодействия J, полученные из таких спектров, позволяют определить преимущественную конформацию L-аскорбиновой кислоты в водном растворе. Например, найдено, что Jh4,H5 составляет 1,8 Гц. Это соответствует предсказанному значению для конформации, изображенной на рис. 3.13. Таким образом, преимущественная конформация вокруг связи С-4—С-5 в водном растворе такая же, как и в кристалле (рис. 3.8).
В равной степени информативна корреляция констант спин-спинового взаимодействия с конформацией вокруг связи С-5—С-6.
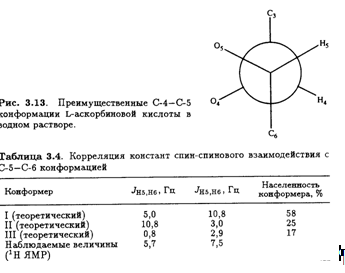
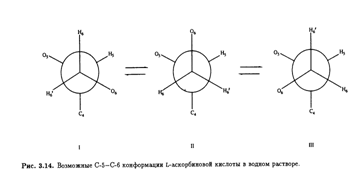
Возможные стабильные конформеры представлены на рис. 3.14. Предположив, что наблюдаемые константы спин-спинового взаимодействия являются весовым усреднением теоретических величин для трех конформеров, можно вычислить их населенность (табл. 3.4). И снова предпочтительная конформация вокруг связи С-5—С-6 в растворе идентична обнаруженной в кристалле. Сходство преимущественных конформации боковых цепей в кристаллической решетке и в растворе объясняется, возможно, отсутствием в обоих случаях внутримолекулярных водородных связей. Но, конечно, прочные межмолекулярные водородные связи образуются между соседними молекулами аскорбиновой кислоты в кристалле и с молекулами воды в водном окружении.
1.3.5Масс-спектрометрия
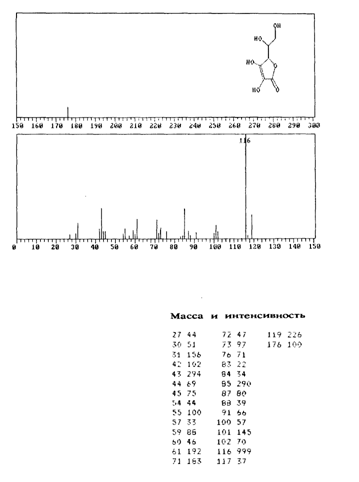
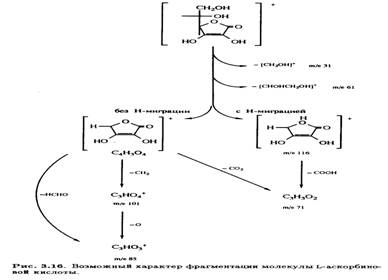
В масс-спектре L-аскорбиновой кислоты, зафиксированном при ионизации молекулы под действием электронного удара, имеется интенсивный пик с m/е 116 наряду с пиком молекулярного иона (m/е 176) (рис. 3.15). Было высказано предположение, что фрагментация происходит за счет отщепления боковой цепи с последующим разрушением кольца, что соответствует наличию наиболее интенсивных сигналов (рис. 3.16).

2 Химические свойства l-аскорбиновой кислоты
Некоторые превращения L-аскорбиновой кислоты уже упоминались в разделе, посвященном установлению структуры молекулы.
Эти и другие реакции будут подробно рассмотрены в последующих разделах.
2.1 Алкилирование и ацилирование
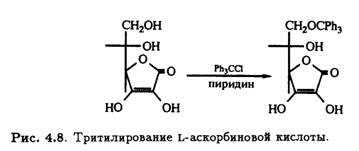
Как и у многих углеводов, первичный гидроксил при С-6 L-аскорбиновой кислоты легко подвергается трифенилметилированию (тритилированию) под действием трифенилхлорметана в пиридине (рис. 4.8).
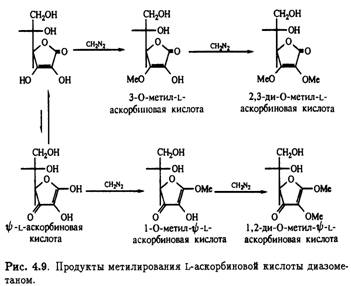
Метилирование L-аскорбиновой кислоты диазометаном проливает свет на таутомерную природу витамина. Повышенная кислотность гидроксила при С-3 позволяет оттитровать его диазометаном в эфире; при этом образуется
3-О-метиласкорбиновая кислота. Реакция сопровождается образованием небольших количеств 1-метил-ψ-L-аскорбиновой кислоты вследствие присутствия минорных количеств таутомера. Оба соединения подвергаются дальнейшему етилированию диазометаном,давая 2,3-ди-О-метил-L-аскорбиновую и 1,2-ди-O-метил- ψ-L-аскорбиновую кислоту соответственно (рис. 4.9)
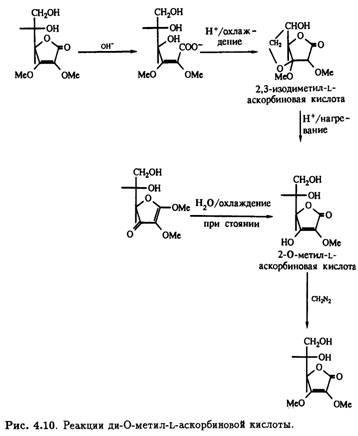
Под действием щелочи с последующим подкислением 2,3-ди-О-метильное производное претерпевает интересную цепь превращений. Образуется не простой моноциклический лактон, а бициклическое производное с единственным свободным гидроксилом — 2,3-изодиметил-L-аскорбиновая кислота. Кислотный гидролиз этого продукта приводит к 3-О-метил-L-аскорбиновой кислоте, которая также получается при стоянии на холоду водного раствора 1,2-ди- O-метил- ψ-L- аскорбиновой кислоты, что сопровождается потерей лабильного метильного остатка при С-1. Как и следовало ожидать, 3-O-метил-L-аскорбиновая кислота легко метилируется под действием диазометана в эфире, образуя 2,3-ди-О-метилированное производное. Описанные превращения суммированы на рис. .10.
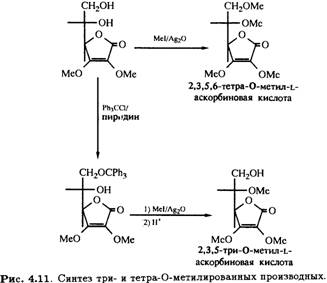
2,3-Ди-О-метил-L-аскорбиновая кислота может быть подвергнута дальнейшему метилированию иодметаном в присутствии оксида серебра с образованием 2,3,5,6-тетра-О-метилированного продукта, а также тритилированию первичной спиртовой группы при С-6. Метилирование с последующим снятием тритильной защитной группировки в кислой среде приводит к 2,3,5-три-О-метильному производному (рис. 4.11), которое, как было показано, участвует в цепи превращений, идентичных приведенным на рис. 4.10, и превращается в бициклическое 2,3,5-изотриметильное производное.
Катализируемая кислотами этерификация аскорбиновой кислоты, например ацетилирование, первоначально приводит к образованию О-6-ацильного производного, а в более жестких условиях — к 5,6-диэфиру. Кристаллический 5,6-диацетат хорошо известен; получение 2,3,4,6-тетраацетата требует еще более жестких условий.
В щелочных условиях электрофильная атака алкилирующих и ацилирующих агентов зависит от кислотности и стерической доступности гидроксильных групп при С-2, С-3, С-5 и С-6. Наиболее кислым является атом водорода гидроксила при С-3 (рКа = 4,25), но делокализация отрицательного заряда в соответствующем анионе снижает его реакционную способность и приводит к возникновению двойственной природы, которая выражается в том, что алкилироваться может не только положение О-3, но и положение С-2. В результате селективная модификация положения О-3 затруднена, и добиться ее можно только с помощью таких сильных алкилирующих и ацилирующих агентов, как диазометан и хлорангидриды.
Потеря второго протона гидроксилом при С-2 (рКа = 11,79) приводит к образованию дианиона, который селективно алкилируется и ацилируется по тому положению (рис. 4.12).
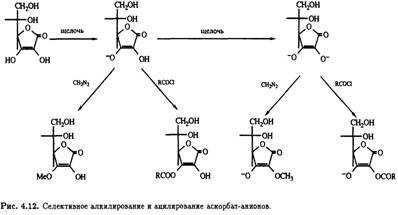
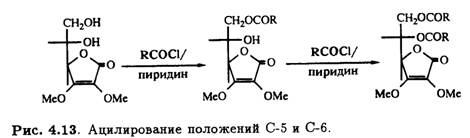
Подобный подход можно использовать при синтезе 2-О-неорганических эфиров, например 2-О-сульфата. Если защищены оба гидроксила при С-2 и С-3, то в присутствии основания модифицируется более доступная стерически первичная спиртовая группа при С-6 и последнюю очередь — при С-5 (рис. 4.13).
2.2 Образование ацеталей и кеталей
Катализируемое кислотами образование ацеталей и кеталей аскорбиновой кислоты применяется для специфической защиты одновременно двух гидроксильных групп в процессе структурной модификации. Такие 5,6-О-производные, как изопропилиденкеталь и бензилиденацеталь, хорошо известны, а недавно появилась возможность селективно защищать гидроксильные группы при
С-2 и С-3 с помощью реакционноспособных альдегидов (рис. 4.14).
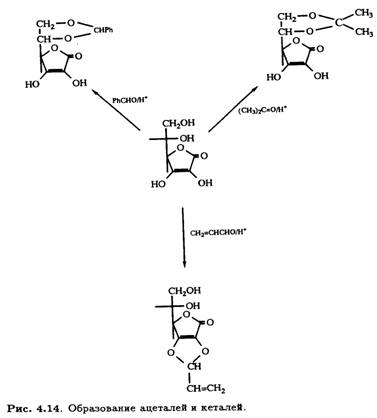
Эти новые реакции открыли путь к селективному модифицированию как первичных, так и вторичных спиртовых групп молекулы аскорбиновой кислоты.
2.3 Окисление
L-Аскорбиновая кислота является сильным восстановителем в водном растворе, однако в безводной среде это не так очевидно. Первая стадия окисления легко обратима и приводит к образованию дегидроаскорбиновой кислоты, структура и свойства которой будут рассмотрены в следующем разделе. Дегидроаскорбиновая кислота также способна быть восстановителем особенно в щелочных условиях и при окислении гипоиодит-ионом или молекулярным
кислородом распадается на L-треонин и щавелевую кислоту. Эта реакция фрагментации оказалась очень полезной при установлении структуры витамина С. Аналогичная фрагментация происходит также при обработке пероксидом водорода в щелочной среде или перманганатом калия в кислой или щелочной среде, причем кроме вышеназванных продуктов детектируется еще и ряд других.
Скорость аэробного окисления аскорбиновой кислоты зависит от рН раствора, достигал максимума при рН 5 и 11,5. Однако наиболее быстро и полно фрагментация протекает в щелочной среде. Окислительное расщепление происходит и в анаэробных условиях, хотя и медленнее.
Ультрафиолетовое, рентгеновское и гамма-излучение инициируют фотохимическое окисление аскорбиновой кислоты в водных растворах по свободнорадикальному механизму как в аэробных, так и в анаэробных условиях.
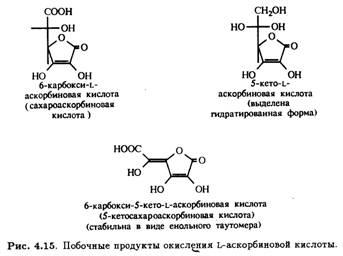
Окисление первичной и вторичной спиртовых групп аскорбиновой кислоты при С-5 и С-6 может теоретически приводить к образованию ряда побочных продуктов. Получение таких производных непосредственно из L-аскорбиновой кислоты требует селективной защиты гидроксилов при С-2 и С-3. На рис. 4.15 приведены примеры соединений такого типа, которые удалось выделить.
2.4 Дезоксисоединения
Производные L-аскорбиновой кислоты, у которых один или более гидроксилов при С-2, С-3, С-5 или С-6 замещены на атом водорода, известны как дезоксисоединения. Нестабильность витамина С подогревает интерес к его более стабильным аналогам при условии сохранения ими антискорбутного действия.
Известно, что 6-дезокси-L-аскорбиновая и L-рамноаскорбиновая кислоты (рис. 4.16) сохраняют соответственно 30 и 20% антискорбутной активности витамина С. В последние годы были синтезированы еще некоторые соединения такого типа (рис. 4.17). Обнадеживает, что 6-хлор-6-дезоксипроизводное обладает повышенной термической стабильностью по сравнению с витамином С и в то же время обладает заметной антицинготной активностью.

3. Биохимия витамина с
Эффективность витамина в заживлении ран и способность ускорять рост связаны с его участием в синтезе волокнистых соединительных тканей, особенно в ускорении посттрансляционного гидроксилирования остатков пролина и лизина коллагена — наиболее распространенного белка животного мира. Этот процесс, все еще далекий от того, чтобы быть полностью понятным, в ходе которого, как это ни парадоксально, восстановительные свойства аскорбиновой кислоты необходимы для окисления пролина и лизина, будет главной темой настоящего раздела. Хотя, конечно, этим роль аскорбиновой кислоты отнюдь не ограничивается. Начиная с первых лет становления биохимии витамина С, ознаменовавшихся спорами вокруг его открытия, а также вокруг роли в метаболизме аминокислот, сфера влияния этого соединения все более расширялась, охватывая различные аспекты иммунологии, онкологии, процессов пищеварения и всасывания, эндокринологии, нейрологии, детоксикации и профилактики катаракты.
Среди высших организмов лишь очень немногие не способны к биосинтезу витамина С. К ним относится и Homo sapiens, поэтому неудивительно, что большая часть из того, что известно о биохимии L-аскорбиновой кислоты, имеет отношение к млекопитающим.
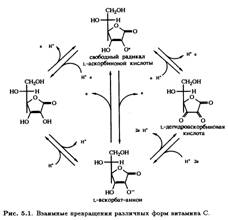
3.1 Биосинтез
Большинство живых организмов могут превращать D-глюкозу в L-аскорбиновую кислоту. Важно ясно понимать, что это превращение происходит не через эпимеризацию, а через формальный поворот в плоскости на 180° соединения D-ряда, в результате чего образуется соединение, относящееся к L-ряду. Следует помнить, что представленное на рис. 5.2 изображение ациклической формы D-глюкозы, относится к D-ряду, так как гидроксильная группа у предпоследнего атома углерода (в данном случае С-5) расположена справа от него.
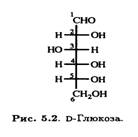
Защитив предварительно реакционноспособную альдегидную группу по С-1, можно окислить D-глюкозу поположениюС-6, получив D-глюкуроновую кислоту (рис. 5.3).
Если теперь С-1 альдегидную группу восстановить до первичного гидроксила, мы получим соединение, структура которого приведена на рис. 5.4.

Наиболее важная функциональная группировка (в данном случае карбоксильная при С-6) обычно располагается в верхней части изображения, а соответствующему атому углерода присваивается номер С-1. Следовательно, если повернуть лист бумаги на 180° или перевернуть изображение в плоскости, мы по-
получим соединение L-ряда — производное альдогексозы L-гулозы, называемое L-гулоновой кислотой (рис. 5.5). Последующие циклизация и окисление приводят к образованию L-аскорбиновой кислоты.
Считается, что все хлорофиллсодержащие растения и прорастающие семена могут синтезировать аскорбиновую кислоту согласно схеме, приведенной на рис. 5.8.
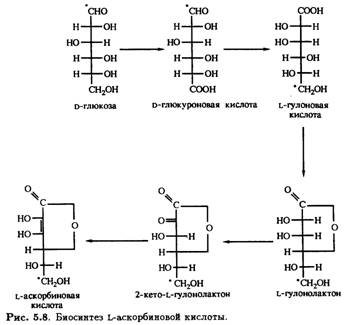
Согласно некоторым источникам, у растений более важна цепь превращений с участием D-галактуроновой кислоты, в результате которой после восстановления и замыкания лактонного кольца вместо L-гулонолактона образуется L-галактуронолактон, также превращающийся в L-аскорбиновую кислоту. Предшественником D-галактуроновой кислоты является, очевидно, D-галактоза — углевод, обнаруженный у млекопитающих и не найденный по крайней мере в значительных количествах у растений. Поэтому трудно предполагать, что этот процесс может быть важным. Тем не менее независимо от того, является ли исходным соединением D-глюкоза или D-галактоза, биосинтез L-аскорбиновой кислоты происходит через инверсию. Однако этому противоречат экспериментальные данные, свидетельствующие о том, что у некоторых растений, например у созревающей клубники, превращение D-глюкозы в L-аскорбиновую кислоту осуществляется не через инверсию. Если использовать D-глюкозу, меченную тритием (3Н) по положению С-6, в образующейся L-аскорбиновой кислоте меченым оказывается также положение С-6. Результаты генноинженерной работы, в которой была получена экспрессия гена фермента редуктазы Corynebacterium в бактериях Erwinia herbicola, демонстрируют наличие в цепи превращений еще двух промежуточных соединений — D-глюконовой и 2,5-дикетоглюконовой кислот. В этом случае нет необходимости в инверсии, чтобы объяснить, каким образом D-глюкоза трансформируется в L-аскорбиновую кислоту. Очевидно, следует предположить, что одни растения продуцируют L-гулоновую кислоту через D-глюкуроновую или D-гaлактуроновую кислоты, тогда как у других процесс протекает через образование d-глюконовой и 2,5-дикетоглюконовой кислот и не требует инверсии.
Большая часть исследований по синтезу аскорбиновой кислоты
у животных была выполнена на лабораторных крысах, и результаты подтвердили идею о полной С-1/С-6 инверсии между D-глюкуронатом и L-гулонатом. Большинство представителей земной фауны способны биосинтезировать L-аскорбиновую кислоту из d-глюкозы через промежуточные соединения — D-глюкуроновую кислоту, L-гулоновую кислоту, L-гулонолактон и 2-кето-L-гулонолактон. Исключение составляют приматы (включая и Homo sapiens) и некоторые другие млекопитающие, а также рыбы, насекомые и некоторые виды птиц. Остается лишь гадать, почему эти представители животного мира утратили способность к биосинтезу аскорбиновой кислоты. По-видимому, их далекие предки лишились генетического материала, необходимого для синтеза фермента L-гулонолактоноксидазы, что и заблокировало завершающую стадию в цепи превращений. Полагают, что эта досадная ошибка произошла 25 миллионов лет назад и именно она привела к тому, что человек делит несомненные трудности
своего положения с другими приматами, морскими свинками, индийскими крыланами, некоторыми видами птиц, включая дрозда с экзотическим голосом; рыбами и некоторыми видами насекомых, включая обитающую в пустыне саранчу, тутового шелкопряда и жуков Anthonomus. Возможно, что у всех травоядных насекомых (поедающих зеленые растения) существует потребность в поступлении витамина С с пищей. Выведение его из рациона, например, саранчи приводит к абортивной линьке и смерти. У тех представителей животного мира, которые способны самообеспечивать себя аскорбиновой кислотой, ее биосинтез осуществляется в печени (млекопитающие) или почках (птицы, рептилии, амфибии).
3.2 Витамин С в продуктах питания
Homo sapiens целиком зависит от поступления витамина С с пищей. Единственным животным продуктом, содержащим значительные количества витамина С, является молоко (1-5 мг/100г); содержится он также и в печени. Самые богатые источники аскорбиновой кислоты — это свежие овощи и фрукты (особенно цитрусовые, томаты и зеленый перец), печеный картофель (17 мг/100 г)
и листовые овощи. Очень богаты витамином С гуава (300 мг/100 г) и черная смородина (200 мг/100 г), но они не слишком распространены в западных странах. В табл. 5.1 приведены исчерпывающие данные о содержании витамина С в наиболее употребляемых овощах и фруктах.
Известно, что кулинарная обработка овощей и фруктов часто влечет за собой потери аскорбиновой кислоты. Так, при измельчении продуктов значительно возрастает ферментативная активность аскорбатоксидазы, содержащейся в растениях, богатых витамином С. Этот фермент присутствует во всех растительных тканях и обычно либо неактивен, либо содержится внутри визикул. Другой фермент, обусловливающий потерю аскорбиновой кислоты, фенолаза, катализирует окисление полифенольных соединений кислородом воздуха, за счет чего происходит потемнение таких фруктов, как яблоки. При наличии аскорбиновой кислоты фермент восстанавливает о-хиноны снова до о-дифенолов. Процесс сопровождается образованием дегидроаскорбиновой кислоты, которая быстро превращается в 2,3-дикетогулоновую кислоту, и

катализируется ионами Cu(II) и других переходных металлов. Именно поэтому не рекомендуется готовить овощи и фрукты в медной и железной посуде. И, конечно, основным фактором, влияющим на потерю витамина С в процессе приготовления пищи, является просто его растворение в воде. Исследования скорости разрушения витамина С при кулинарной обработке, выполнены на модельных системах, привели к предположению, что это процесс первого порядка. Влияние температуры на скорость распада витамина С адекватно описывается уравнением Аррениуса, где κ — константа скорости первого порядка, А — предэкспоненциальный множитель, Еа — энергия активации, R — газовая постоянная и Т — абсолютная температура:
![]()
Как показали результаты экспериментов, график зависимости lnk от 1/Т представляет собой прямую линию, что позволяет вычислить энергию активации. Стандартные величины лежат в пределах 80-120 кДж · моль -1. Однако растения — очень сложные системы, на скорость распада витамина С в которых влияют и другие факторы, например микроорганизмы и (или) природные ферменты. Поэтому энергия активации служит только для приблизительной оценки влияния температуры на этот процесс. Более того, дополнительным параметром является отсутствие воздушной среды. Ситуация еще больше усложняется, если реакция не
подчиняется первому порядку. Так, например, имеются данные, что при хранении соков распад аскорбиновой кислоты является процессом нулевого порядка. Трудно понять, почему наблюдается такое различие в кинетике, однако несомненно, что решающее влияние на разрушение витамина С оказывает природа системы. Следует отметить, что овощи, приготовленные в микроволновой печи, сохраняют гораздо больше витамина С, чем приготовленные обычными способами. Это может происходить главным образом
благодаря использованию меньших объемов воды, хотя должно сказываться и сокращение времени кулинарной обработки. Таким образом, потери витамина С можно предотвратить, не только избегая длительного кипячения овощей в медной посуде, но и если готовить их целиком.
4 Аналитические аспекты химии витамина с
4.1 Аналитическая химия
Анализ L-аскорбиновой кислоты и ее различных форм представляет собой определенную трудность, и даже сегодня нет универсального рутинного метода, который был бы свободен от недостатков. Любой метод анализа должен давать возможность одновременно определять как саму L-аскорбиновую кислоту, так и продукты ее окисления и находить четкие различия между этими соединениями. Кроме того, аналитический метод должен позволять работать с минимальными количествами препаратов. Это, так сказать, требования высшего порядка. Но ситуация осложняется тем, что в животных и растительных тканях витамин С присутствует в окружении множества других органических молекул.
Аскорбиновую кислоту следует либо отделять от них, либо использовать для анализа некое уникальное свойство этой кислоты. Очевидно, что таким уникальным свойством является ее способность участвовать в окислительно-восстановительных реакциях, что и составляет основу многих аналитических методик. Другие методы базируются на определении суммарного количества витамина С как в окисленной, так и в восстановленной формах. Иногда такое определение более предпочтительно, поскольку многие полезные свойства этого соединения, используемые в медицине, присущи как самой аскорбиновой кислоте, так и продуктам ее окисления.
4.2 Биологические методы анализа
Сегодня биологические методы представляют главным образом исторический интерес. Но на самом деле их преимущество заключается в том, что они основаны на определении конкретного профилактического и лечебного свойства, а именно антискорбутной активности, присущей и дегидроаскорбиновой кислоте. Биологические методы требуют больших затрат времени и средств и дают широкий разброс результатов, которые не всегда надежны. Для проведения биоанализа используют морских свинок, так как крысы синтезируют собственный витамин С. Животных выдерживают на искусственном рационе с добавлением различных количеств витамина, затем забивают, а их зубы подвергают гистологическому анализу. В результате устанавливают степень защиты от цинги в зависимости от количеств аскорбиновой кислоты, поступающей с пищей. Антискорбутная активность 0,05 мг аскорбиновой кислоты принята в качестве международной единицы для измерения содержания витамина С.
4.3 Титриметрические и колориметрические методы анализа
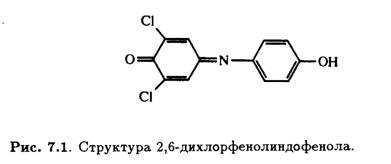
Титриметрические методы основаны на использовании восстановительных свойств L-аскорбиновой кислоты. Обычно она окисляется до дегидроаскорбиновой кислоты. В методике, предложенной еще в 1927 г., используется 2,6-дихлорфенолиндофенол или 2,6-ди-хлор-4[(4-гидроксифенил)имино]циклогексадиен-3,5-он-1, который при нейтральных рН дает синюю окраску, при кислых — розовую, а при взаимодействии с L-аскорбиновой кислотой образует бесцветный продукт. Структура этого соединения приведена на рис. 7.1.
Эта реакция лежит в основе наиболее популярного титриметрического метода анализа витамина С. Она проста в исполнении благодаря легкости определения конечной точки титрования и без труда может быть использована для анализа растворов, содержащих довольно высокие концентрации витамина С. К сожалению, данный метод очень чувствителен к присутствию других восстановителей, с которыми витамин С часто соседствует в растворах (диоксид серы, таннины, ионы металлов, восстанавливающие сахара и т. п.). В каждом конкретном случае есть способы уменьшить влияние примеси, но устранить эффект всех примесных восстановителей в анализируемом растворе одновременно невозможно. И если раствор первоначально окрашен, это маскирует изменение цвета вследствие реакции; в таких случаях для определения конечной точки использовали разнообразные инструментальные методы, например, полярографию. Было предложено много других титрующих реагентов, например, соединения железа(Ш). В этом случае конечную точку определяют при добавлении в качестве индикаторов феррозина, а, а'- дипиридина или 2,4,6-трипиридил-симм-триазина (рис. 7.2).
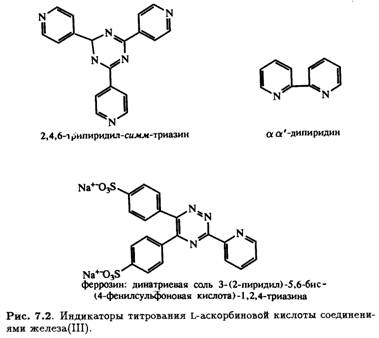
Полагают, что единственным продуктом многих изученных окислительно-восстановительных реакций L-аскорбиновой кислоты является дегидроаскорбиновая кислота. Но часто это не так, и окисление идет дальше. Поэтому разработка точного и чувствительного метода определения концентрации в растворе L-аскорбиновой кислоты, дегидроаскорбиновой кислоты и отдельных или всех продуктов дальнейшего окисления все еще остается актуальной.
Практическое применение метода
Количественное определение аскорбиновой кислоты в мандарине
Выполнение работы:
На аналитических весах берут навеску 5-10г и растирают в ступке с 15см3 HCl. Полученный экстракт затем отфильтровывают в колбу объемом 50 см3, затем ступку и пестик моют дистилированой водой и также фильтруют в эту колбу. В 2 конические колбы на 50 см3 отбирают аликвоту фильтрата по 5см3,
Добавляют по 10 см3 дистилированой воды и титруют раствором 2,6- ДХФИФ до слаборозовой окраски. Титрование проводят не меньше 4 раз и определяют средний V 2,6-ДХФИФ.
m= 7,38г
V(ДХФИФ)=1,2 см3
С(ДХФИФ)= 0,001М
V(2,6-ДХФИФ) С(2,6-ДХФИФ) М(С6Н8О6) fэкв (С6Н8О6) Vк 100
m Va
4.4 Спектрофотометрический анализ
Водные растворы L-аскорбиновой кислоты бесцветны и не поглощают в видимой области спектра, но при нейтральных значениях рН в спектре оглощения наблюдается сильный сигнал при 265 нм. Это обстоятельство было бы очень удобно использовать для непосредственного спектрофотометрического анализа, но в большинстве случаев растворы витамина С содержат вещества, также поглощающие в УФ-области, что в некоторой степени ограничивает использование этого метода. В течение ряда лет были сомнения относительно точного значения молярного коэффициента экстинкции при 265 нм; в разных работах давались значения от 7500 до 16650. Причина таких различий объясняется быстрым окислением L-аскорбиновой кислоты в нейтральных и слабокислых растворах атмосферным кислородом. До тех пор, пока спектры поглощения снимаются в строго анаэробных условиях, неизбежны низкие величины, так как поглощение продуктов окисления, при 265 нм незначительно.
Сложности появляются при наличии в растворе ионов Си + и других переходных металлов, являющихся потенциальными катализаторами окисления молекулярным кислородом. Их следует удалять или связывать в комплекс путем добавления хелатирующего агента этилендиаминтетрауксусной кислоты. Положение максимума поглощения зависит от рН и в кислых растворах смещается в область 245 нм. На основании величины поглощения при этой длине волны в растворе соляной кислоты и хлорида калия определяли содержание витамина С в безалкогольных напитках и некоторых лекарственных препаратах, где незначительны примеси других веществ. Часто бывает желательно определить в одном и том же растворе содержание дегидроаскорбиновой и L-аскорбиновой кислот. Дегидроаскорбиновая кислота поглощает в УФ-области при 220 нм, но величина молярного коэффициента экстинкции значительно ниже и составляет 720. Таким образом, в этом случае чувствительность спектрофотометрического анализа почти в 20 раз меньше, чем в случае L-аскорбиновой кислоты. Позже мы увидим, что этот факт имеет далеко идущие последствия при хроматографическом разделении L-аскорбиновой и дегидроаскорбиновой кислот.
Для того чтобы преодолеть проблемы, связанные с присутствием в животных и растительных тканях веществ, поглощающих в УФ-области, проводился поиск реагентов, дающих специфические цветные реакции с L-аскорбиновой кислотой и(или) продуктами ее окисления. Титриметрический метод с использованием дихлорфенолиндофенола, описанный выше, был адаптирован для колориметрии. Для спектрофотометрического определения можно использовать и окрашенное 2,4-динитрофенилгидразиновое производное витамина. Обнаружено, что это же самое соединение образуется с дегидроаскорбиновой и 2,3-дикетогулоновой кислотами, являющимися продуктами окисления L-аскорбиновой кислоты (рис. 7.3). Эта реакция имеет широкое практическое применение для определения содержания дегидроаскорбиновой кислоты и известна под названием метода Роу. Он заключается во взаимодействии раствора дегидроаскорбиновой кислоты с 2,4-динитрофенилгидразином в специфических условиях при 37°С в течение 4 ч, в результате чего образуется озазон — производное 2,3-дикетогулоновой кислоты. Эту же реакцию можно использовать и для определения содержания L-аскорбиновой кислоты, предварительно окислив ее до дегидроаскорбиновой кислоты над активированным углем (норит) раствором брома и т. п. При добавлении к озазону сильной кислоты образуется раствор красного цвета, поглощающий при 530 нм.
Основу для колориметрического и спектрофотометрического методов анализа создает также ярко-синий цвет продукта реакции L-аскорбиновой кислоты с соединениями диазония (рис. 7.4).
Альтернативный подход заключается в использовании флуоресценции продукта конденсации дегидроаскорбиновой кислоты с о-фенилендиамином. Облучение образующегося хиноксалина на длине волны 350 нм приводит к его флуоресценции при 427 нм. Обычно методика включает окисление L-аскорбиновой кислоты до дегидроаскорбиновой, и затем суммарное количество определяется спектрофлуорометрически.
4.5 Электрохимические методы
Электрохимические методы предоставляют возможность высокоселективного анализа с высокой точностью и воспроизводимостью; к тому же они очень просты в исполнении. Было предложено множество методик. Например, в таблетках поливитаминов, содержащих соединения Fe'-11-', витамин С был проанализирован методом дифференциальной пульсирующей вольтамперометрии на стеклянном углеродном электроде. Однако эти методики не нашли широкого применения, так как необходима большая работа по их
совершенствованию.
4.6 Хроматографические методы
Хроматографические методы дают самую большую надежду на преодоление основной проблемы, связанной с присутствием в смесях, содержащих витамин С, множества мешающих анализу веществ. Как мы уже видели, пока не существует методов, позволяющих четко и непосредственно определять небольшие количества L-аскорбиновой кислоты и(или) продуктов ее окисления в присутствии любых других соединений. Единственный удовлетворительный способ достижения специфичности заключается в хромато-
графическом отделении анализируемых соединений друг от друга, а также от остальных веществ.
Вплоть до относительно недавнего времени наиболее часто из хроматографических методов использовали обычно газожидкостную хроматографию (ГЖХ). Определить L-аскорбиновую кислоту непосредственно этим методом невозможно из-за ее нелетучести. Для того чтобы иметь такую возможность, была разработана длительная процедура превращения L-аскорбиновой кислоты в летучий триметилсилиловый эфир. Такой метод позволяет получать точные и воспроизводимые результаты, но из-за длительности предварительной подготовки образца он не так удобен, как разработанный недавно метод высокоэффективной жидкостной хроматографии (ВЭЖХ). В настоящее время ВЭЖХ стала альтернативным способом быстрого определения самых разнообразных органических и неорганических соединений. Она часто находит применение в фармацевтической промышленности для анализа болеутоляющих и других препаратов. ВЭЖХ давно используется и для анализа витаминов.
Однако это не решает всех проблем в случае определения витамина С. Остается еще много сложностей, и метод не всегда удается использовать с одинаковой легкостью как для анализа всего разнообразия образцов, так и для определения малых концентраций.
Однако, когда применение метода ВЭЖХ возможно, он обычно дает надежные, точные и воспроизводимые результаты. Вопрос количественного определения разделенных веществ в ВЭЖХ требует наличия специфического физического свойства у витамина С (как у L-аскорбиновой кислоты, так и у продуктов ее окисления). Ко времени написания этой книги наиболее широкое
распространение получили детекторы, измерявшие поглощение в УФ- или видимой области спектра. Они позволяют определять нанограммовые количества L-аскорбиновой кислоты, но при определении дегидроаскорбиновой кислоты их чувствительность гораздо ниже из-за значительно более низкого молярного коэффициента экстинкции (см. выше). Остается проверить, нельзя ли повысить
эффективность анализа, используя детекторы другого типа, чувствительные к массе. Для ВЭЖХ обычно используют колонку с мелкопористым полимерным обратнофазовым сорбентом с развитой поверхностью, таким, как, например, PLRS-s 100A, при низких значениях рН водной подвижной фазы. Для этого подходит 0,2 М раствор NaH2PO4, который создает рН около 2,1, а также подавляет действие ионов металлов и дает хорошо забуференную подвижную фазу. Такой метод был использован для определения содержания L-аскорбиновой кислоты и продуктов ее окисления во фруктовых соках. В данной среде УФ-спектрофотометрический детектор, регистрирующий поглощение при 220 нм (при этой длине волны оба соединения имеют близкие молярные коэффициенты экстинкции), имеет удовлетворительную чувствительность. Типичная хроматограмма приведена на рис. 7.6.
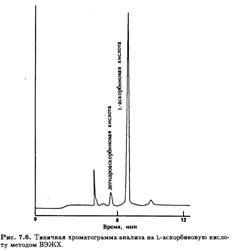
Из нее явствует, что этим методом разделяются не только L-аскорбиновая и дегидроаскорбиновая кислоты, но и продукты их дальнейшего окисления, соответствующие оторым пики также присутствуют на хроматограмме. Это одна из многих методик с использованием ВЭЖХ, пригодных для проведения подобного анализа.
4.7 Неорганическая химия
Этот раздел будет посвящен главным образом реакциям L-аскорбиновой кислоты с ионами металлов и их комплексами. Однако было бы неуместно обсуждать эту тему без рассмотрения свойств соединения, которое в буквальном смысле „покушается" на всю неорганическую химию. Следовательно, сюда важно включить рассмотрение довольно сложного химизма окислительно- восстановительных реакций витамина С, а также информацию о количественном и качественном определении и свойствах соединений, которые часто фигурируют как промежуточные продукты таких реакций, а именно аскорбат-радикалов.
5. Статистическая обработка результатов анализа
Метод исключения грубых промахов по Q-критерию
Метод заключается в расчете величины Q:Q = (x1 - x2) / R, где x1 – возможный промах измеренийx2 – результат измерения, ближайший по значению к х1R – размах варьирования, т.е. разность между наибольшим и наименьшим значениями. Если Q < Qтаб – результат остаетсяЕсли Q > Qтаб – результат отбрасывается
Для определения погрешности титрования следует провести ста тистическую обработку выбранных данных. Стандартное отклонение:
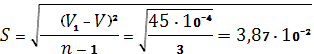
Погрешность титрования: ![]()
Литература
1. М. Девис, Дж. Остин, Д. Патридж «Витамин С. Химия и биохимия», Москва «Мир» 1999