
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Синтез и реакции Бис-(2,6-тремитилсилилокси)би-цикло[3.3.1]нонандиена-2,6
Курсовая работа: Синтез и реакции Бис-(2,6-тремитилсилилокси)би-цикло[3.3.1]нонандиена-2,6
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"САМАРСКИЙ ГОСУДАРСВЕННЫЙ УНИВЕРСИТЕТ"
Химико-технологический факультет
Кафедра органической химии
Курсовая работа
СИНТЕЗ И РЕАКЦИИ БИС- (2,6-ТРИМЕТИЛСИЛИЛОКСИ) БИ-ЦИКЛО [3.3.1] НОНАНДИЕНА-2,6
Выполнил студент
2 курса, 2 группы
Чернышов Дмитрий Александрович
Научный руководитель
Кандидат химических наук, доцент
Скоморохов М.Ю.
Зав. кафедрой
Доктор химических наук, профессор
Климочкин Ю.Н.
САМАРА 2006
Оглавление
ВВЕДЕНИЕ
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 МЕТОДЫ ПОЛУЧЕНИЯ СИЛИЛОВЫХ ЭФИРОВ ЕНОЛОВ
1.2 ПРИМЕНЕНИЕ СИЛИЛОВЫХ ЭФИРОВ ЕНОЛОВ В СИНТЕЗЕ
2. СИЛИЛОВЫЕ ЭФИРЫ ЕНОЛОВ КАК С-НУКЛЕОФИЛЫ
2.1 РЕАКЦИЯ С ГЕТЕРОАТОМНЫМИ ЭЛЕКТРОФИЛАМИ
3. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
3.1 СИНТЕЗ ИСХОДНЫХ СОЕДИНЕНИЙ
2.2 РЕАКЦИИ БИС- (2,6-ТРИМЕТИЛСИЛИЛОКСИ) БИЦИКЛО [3.3.1] НОНАНДИЕНА-2,6
ВЫВОДЫ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Целью работы являлось, получение бис- (2,6 - риметилсилилокси) бицикло [3.3.1] нонандиена-2,6, и исследование превращений под действием галогенсукцинимидов и бензальдегида.
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 МЕТОДЫ ПОЛУЧЕНИЯ СИЛИЛОВЫХ ЭФИРОВ ЕНОЛОВ
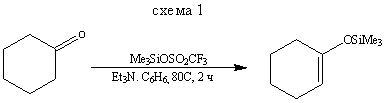
Обычный метод получения силиловых эфиров енолов - силилирование енолов и енолят-ионов, которое почти всегда протекает как О-силилирование, а не как С - силилирование. Некоторые типичные примеры приведены на схемах (1-9).
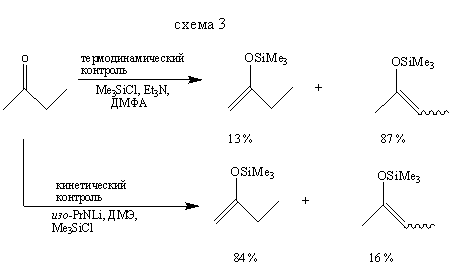
Методы получения эфиров енолов, приведенные на схемах (2) и (3), показывают, как, используя термодинамический или кинетический контроль, можно синтезировать преимущественно тот или другой изомер. Реакция, представленная схемой (4), демонстрирует другой путь синтеза некоторых силиловых эфиров.


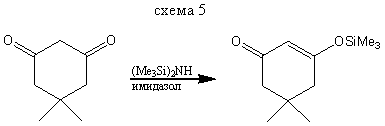
В реакциях с β-дикарбонильными соединениями, могут получаться как моно - так и дизамещенные силиловые эфиры енолов.
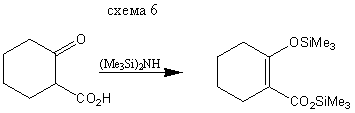
Реакция карбоновых кислот и сложных эфиров

1.2 ПРИМЕНЕНИЕ СИЛИЛОВЫХ ЭФИРОВ ЕНОЛОВ В СИНТЕЗЕ
Силильная группа стабилизирует енольную функцию благодаря чему могут быть проведены реакции по двойной связи, схема (9) или такие реакции, в которых двойная связь енолов выступает как составная часть диеновой системы (схема (10) и (11)); в случае диена в схеме 11 наблюдается более высокая региоселективность, чем при использовании соответствующего этилового эфира енола.


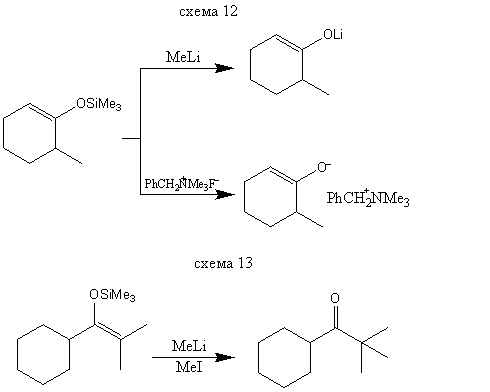
Силиловые эфиры енолов достаточно стабильны, и соответствующие их смеси можно разделять традиционными методами, например газовой хроматографией. Поэтому силилирование используется в аналитических целях. Обработка силилилового эфира метиллитием или фторид-ионом схема (12) приводит к индивидуальному литиевому или аммониевому еноляту, который можно далее использовать в синтезе, например по схеме (13). Таким образом, силилирование - один из методов генерирования енолятов определенного строения. Раньше для этой цели использовались енолацетаты, однако при взаимодействии енолацетата с метиллитием наряду с енолятом образуется один эквивалент трет-бутоксида лития, который может вызывать осложнения на последующих стадиях. При использовании силилового эфира побочным продуктом служит совершенно инертный тетраметилсилан.
2. СИЛИЛОВЫЕ ЭФИРЫ ЕНОЛОВ КАК С-НУКЛЕОФИЛЫ
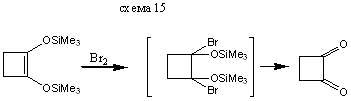
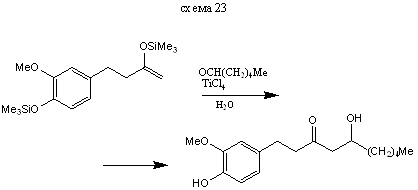
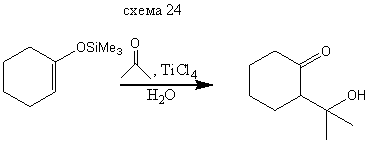
В реакциях с сильными электрофилами силиловые эфиры енолов могут использоваться непосредственно без превращения в соответствующие еноляты. Очень приближенно можно считать, что силилиовый эфир енола обладает такой же нуклеофильностью, как и соответствующий енол. Ниже приведены примеры реакций электрофилов различного типа с силилированными енолами. Основное преимущество использование силилиовых эфиров енол обусловлено тем, что процесс не осложняется образованием равновесной смеси енол, получающегося из исходного и конечного кетонов. Реакции с галоген-, О-, N - и S-электрофилами приводит к α-функционально замещенным кетонам (и альдегидам) схемы (14-21). Реакции с С - электрофилами приводят к β-функционально замещенным кето-спиртам. Приведенные примеры иллюстрируют специфическую альдольную конденсацию схемы (23-24).
2.1 РЕАКЦИЯ С ГЕТЕРОАТОМНЫМИ ЭЛЕКТРОФИЛАМИ
Галогенирование енолов силиловых эфиров приводит к α-замещенным кетонам

Реакция с О-электрофилами α-функционально-замещенным альдегидам и кетонам.

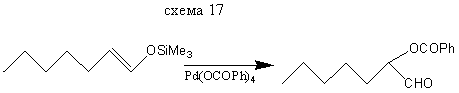
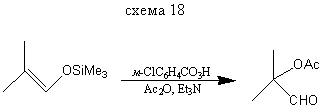
Реакции с N - и S - электрофилами идет по аналогии с О-электрофилами

Гидроборирование приводит к получению α-бор-замещенным силиловым эфирам.
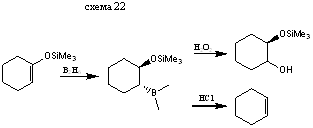
Реакция с С-электрофилами протекает по специфической схеме альдольной конденсации
3. ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ
3.1 СИНТЕЗ ИСХОДНЫХ СОЕДИНЕНИЙ
Бицикло [3.3.1] нонандион-2,6

В колбу на 250 мл загружают 10 г эфира Меервейна,20 мл 6 н соляной кислоты и 30 мл 80% уксусной кислоты кипятят 25 часов, упаривают в вакууме досуха, получившийся остаток перекристализовывают из толуола. Выход: 3,1 г (78%) т. пл. = 140-142°С (литературные данные [1] т. пл. =141-143°С).
Бис- (2,6-триметилсилилокси) бицикло [3.3.1] нонандиен-2,6
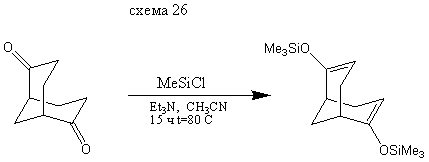
Смесь 10 г (0,066 моль) бицикло [3.3.1] нонандиона-2,6, 30 мл (0,235 моль) (CH3) 3 SiCI и 40 мл (0,277 моль) Et3N в 50 мл CH3CN и кипятят смесь в течение 15 часов. Реакционную смесь выливают в 150 мл холодной воды и экстрагируют 4×50 мл циклогексаном. Органический слой промывают холодной водой 2×50 мл, сушат Na2SO4 и растворитель упаривают досуха в вакууме. Остаток перекристализовывают из СН3ОН Выход: 10 г (51%) т. пл. = 40-41°С.
2.2 РЕАКЦИИ БИС- (2,6-ТРИМЕТИЛСИЛИЛОКСИ) БИЦИКЛО [3.3.1] НОНАНДИЕНА-2,6
Синтез галоген производных бицикло [3.3.1] нонандиона-2,6
3,7-Дихлорбицикло [3.3.1] нонандион-2,6
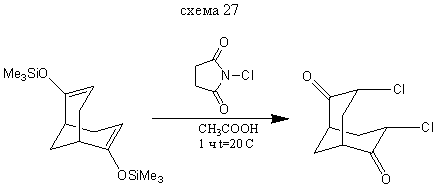
В колбу на 50 мл прибавляем 5 мл уксусной кислоты и на водяной бане при 15-20 ° С добавляем 0,4 г (0,001351 моль) бис- (2,6-триметилсилилокси) бицикло [3.3.1] нонандиена-2,6 и далее, в течении 2 минут постепенно добавляем 0,38 г (0,002846 моль) хлорсукцинимида. Реакционную смесь выдерживают в течении 1 часа при комнатной температуре и выливают в 10 мл воды. Выход: 0,2 г (66%) т. пл. = 156,5-158,5° С (литературные данные [2] т. пл =161-163°С).
3,7-Дибромбицикло [3.3.1] нонандион-2,6
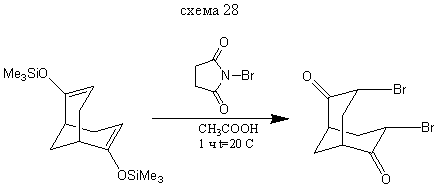
В колбу на 50 мл прибавляем 5 мл уксусной кислоты и на водяной бане при 15-20 ° С добавляем 0,4 г (0,001351 моль) бис- (2,6-триметилсилилокси) бицикло [3.3.1] нонандиена-2,6 и далее, в течении 2 минут постепенно добавляем 0,48 г (0,002846 моль) бромсукцинимида. Реакционную смесь выдерживают в течении 1 часа при комнатной температуре и выливают в 10 мл воды. Выход: 0,3 г (61%). т. пл. = 166,5-167,5° С. (литературные данные [3] т. пл =165-166°С).
Бис (3,7-бензалиден) бицикло [3.3.1] нонандион-2,6
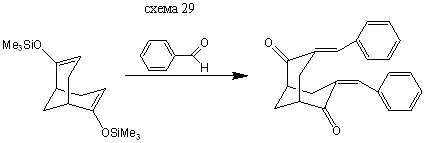
В колбу на 50 мл помещают 10 мл толуола, 0,89 г (0,008446 моль) бензальдегида и 0,5 г (0,001689 моль) бис- (3,7-триметилсилилокси) бицикло [3.3.1] нонандиена-2,6, при температуре Т=20° С прибавляют по каплям раствор 0,1 мл эфирата трехфтористого бора в 4 мл толуола. Затем кипятят 1 час, охлаждают, осадок отфильтровывают и перекристализовывают из уксусной кислоты. Выход: 0,33 г (60%) т. пл. =199-201°С (литературные данные [4] т. пл =202-203°С).
ВЫВОДЫ
В данной курсовой работе был проведен анализ литературных данных по способам получения и применения силиловых эфиров в органической синтезе. Разработан способ получения бис- (2,6-триметилсилилокси) бицикло [3.3.1] нонандиена-2,6 и иследованны его реакции с галогенсукцинимидами и бензальдегидом.
СПИСОК ЛИТЕРАТУРЫ
1. Н.В. Аверина, Н.С. Зефиров. // ЖОрХ Т.5, вып.11 (1969) С. 1991.
2. Stetter. H. et al. // Chem. Ber., 1962, S.1687.
3. Климова Н.В. // Изв. акад. наук, сер. хим, 24, 1975, С.1565.
4. Аверина Н.В., Семиошкин А.А., Борисова Г.С., Зефиров Н.С., // ЖОрХ Т.33, вып 4, 1997, С 550.
5. J. James G. Henkel, William C. Faith, Jeffry T. Hane. // Org. Chem. Vol.46, 1981, P.3483.
6. Eiichi Nakamura, Isao Kuwajima. // Tetrahedron Lett, Vol.24, N.32, 1983. P.3343,Общая органическая химия: Сб. / Под ред. Н.К. Кочеткова Москва "ХИМИЯ", 1984 Т.6. C.120.