
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Синтез и анализ ХТС в производстве гидроксида натрия и хлора из водного раствора хлорида натрия
Курсовая работа: Синтез и анализ ХТС в производстве гидроксида натрия и хлора из водного раствора хлорида натрия
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КУРСОВАЯ РАБОТА
по дисциплине «Общая химическая технология»
на тему:
Синтез и анализ ХТС в производстве гидроксида натрия и хлора
из водного раствора хлорида натрия
2006 г.
СОДЕРЖАНИЕ
Введение
1. Литературный обзор
2. Технологическая часть
2.1. Характеристика исходного сырья
2.2. Характеристика готовой продукции
2.3. Описание технологической схемы
2.4. Функциональная модель
2.5. Структурная модель
2.6. Операторная модель
3. Заключение
4. Задача
Список использованной литературы
Введение
Химическая наука и химическая промышленность в настоящее время являются одними из ведущих отраслей, которые обеспечивают научно технический прогресс в обществе. Интенсивный рост данной отрасли требует создания мощной производственной базы в области крупнотоннажных реагентов. Одним из таких веществ является гидроокись натрия.
Гидроксид натрия находит широкое применение в самых разнообразных отраслях промышленности. Едкий натр используется для приготовления электролитов при производстве химических источников тока, в качестве реагента или растворителя в органическом синтезе и технологии искусственных волокон. В связи с наличием такого широкого потребительского спектра выбранная тема является актуальной.
Целью данной работы является разработка экономически эффективного, технологически реализуемого и экологически безопасного производства. Для решения этой проблемы рассмотрим реализуемые в настоящее время в промышленности методы производства едкого натра, выберем наиболее подходящий метод. Предложим методы совершенствования реализуемого производства и решение экологических проблем возникающих при функционировании производства.
1. Литературный обзор
Электролиз водного раствора хлорида натрия - одно из важнейших крупнотоннажных производств, основанных на процессе электролиза водных растворов электролитов. Он позволяет на основе одного сырья получить одновременно три продукта: гидроксид натрия, хлор и водород. Технологический процесс состоит из трех стадий: подготовки сырья к электролизу раствора хлорида натрия, очистки и переработки продуктов электролиза.
1.1. Подготовка сырья к электролизу
Сырьем для электролиза служит хлорид натрия в виде каменной соли, самоосадочной соли или подземного рассола. Подготовка сырья к электролизу включает операции растворения (при использовании твердой соли), очистки рассола от механических примесей и удаления ионов кальция и магния.
Механические примеси удаляют отстаиванием рассола с последующим фильтрованием осадка, а ионы кальция и магния, которые отрицательно влияют на процесс электролиза, обработкой рассола раствором карбоната натрия или известковым молоком:
СаСl +Na2CO3 → СаСО3+ 2NaCl
с последующей нейтрализацией избыточной щелочности соляной кислотой. Осадок карбонатов кальция и магния удаляют фильтрованием.
Полученный рассол должен иметь концентрацию соли 310 - 315 г/л, чтобы обеспечить, возможно, более низкий потенциал разряда ионов при электролизе. Также существуют допустимые пределы содержания ионов кальция и магния.
Рассол, поступающий на электролиз, представляет многокомпонентную систему, в которой содержатся ионы натрия, хлора, гидроксоний-катион и гидроксид-анион. Последовательность их разряда и образующиеся продукты определяются в соответствии с «правилом разряда» величиной их потенциалов разряда, которые зависят от условий электролиза и, весьма существенно, от материала катода. Различают два варианта технологического процесса электролиза водного раствора хлорида натрия: электролиз с твердым железным катодом (диафрагменный метод) и электролиз с жидким ртутным катодом.
Аноды электролизеров в обоих случаях изготавливают из одинаковых материалов: искусственного графита, пропитанного для уменьшения износа льняным маслом, или из титана, покрытого слоем оксидов рутения и титана. Аноды второго типа позволяют вести электролиз при высоких плотностях тока и более низком напряжении. Такие условия снижают расход электроэнергии на 10-12%. Поэтому оксидно-рутениевые аноды вытесняют графитовые: ими оснащено в настоящее время до 70% всех установок электролиза.
1.2. Электролиз раствора хлорида натрия с железным катодом
При прохождении постоянного электрического тока через водный раствор хлорида натрия на железном катоде разряжаются ионы гидроксония НзО+, потенциал разряда которых в насыщенном растворе хлорида натрия, даже при учете перенапряжения, составляет +1,1 В, тогда как потенциал разряда ионов натрия равен +2,71 В.
В то же время, на графитовом и окиднорутениевом анодах потенциал разряда ионов гидроксила ОН" за счет высокого перенапряжения составляет 1,9 В и превышает потенциал разряда ионов хлора, равный 1,6 В. Поэтому на подобных анодах разряжаются ионы хлора.
В табл. 1. приведены потенциалы разряда ионов и уравнения первичных процессов при электролизе с железным катодом.
Таблица 1
Электролиз с железным катодом
| Электрод | Потенциал разряда, В | Первичная реакция | ||
|
Ер |
Епер |
Е | ||
| Катод |
+2,71 0,84 |
- 0,26 |
+2,71 +1,10 |
Na+ H3O+ + ē ® 0,5H2 + H2O |
| Анод |
-0,83 -1,33 |
-1,07 -0,27 |
-1,90 -1,60 |
OH- Cl- - ē = 0,5 Cl2 |
Теоретическое напряжение разложения равно:
VT = Ek + Ea = +1,1-(-1,6) = 2,7 В
На практике, при проведении процесса электролиза с железным катодом, на токоподводах электролизера поддерживается напряжение около 4,0 В.
В результате разряда ионов НзО+ в катодном пространстве накапливаются ионы ОН и образуется раствор гидроксида натрия:
![]()
![]() NaCl+H2O
→ 0,5Cl2
+ 0,5H2
+ NaOH
NaCl+H2O
→ 0,5Cl2
+ 0,5H2
+ NaOH
у анода у катода
Разряд ионов гидроксония на катоде вызывает смещение равновесия диссоциации воды вправо:
2H2O → H3O++OH-
и повышение концентрации гидроксид-ионов в катодном пространстве. При высокой концентрации ионов ОН- возможно попадание их в анодное пространство и реакция разряда:
2OH- - 2ē → 0,5O2 + H2O
Вследствие этого, хлор, выделяющийся в анодном пространстве, загрязняется кислородом.
Вторичные процессы при электролизе с железным катодом протекают в анодном пространстве. Они включают:
- окисление графитового анода
кислородом, образующимся при![]() разряде
ионов гидроксида на аноде:
разряде
ионов гидроксида на аноде:
C + O2 → CO2
C + 0,5O2 → CO
- растворение хлора в электролите с образованием соляной и хлорноватистой кислот:
Cl2 + 2H2O ↔ H3O + Cl- + HOCl
- взаимодействие компонентов при диффузии щелочи в анодное пространство или смешении анодной (анолит) и катодной (католит) жидкостей с образованием гипохлорит-иона и хлорат-иона.
В результате протекания вторичных процессов раствор гидроксида натрия, полученный электролизом с железным катодом, всегда содержит примесь гипохлорита и хлората натрия. Вторичные процессы снижают выход по току и коэффициент использования энергии.
Удельный вес побочных вторичных процессов может быть снижен:
- разделением катодного и анодного пространства в электролизере с помощью фильтрующей диафрагмы (отсюда название метода диафрагменный), обеспечивающей одностороннее движение рассола в направлении, противоположном движению ионов ОН- к аноду и препятствующей обратному перемещению их;
- подачей рассола в электролизер со скоростью, превышающей скорость образования ионов ОН- и вытеснение образующегося раствора гидроксида натрия (щелока) в катодное пространство;
- применением высоких температур и концентраций рассола, что снижает растворимость хлора в электролите и вероятность протекания вторичных процессов;
- понижением концентрации выходящего из электролизера щелока, то есть уменьшением содержания гидроксида натрия в растворе, также снижающего вероятность вторичных процессов. Поэтому, процесс электролиза никогда не доводят до полного превращения хлорида натрия, останавливая его при достижении определенной концентрации щелока.
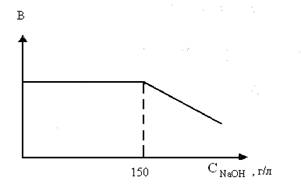
Рис. 1. Зависимость выхода по току от концентрации щелока
На рис. 1. приведена зависимость выхода гидроксида натрия от концентрации его в выходящем щелоке. Таким образом, оптимальными условиями процесса электролиза водного раствора хлорида натрия с железным катодом являются:
- температура электролита 70 - 90°С;
- концентрация щелока, выходящего из электролизера 130 - 140 г/л;
- концентрация рассола, поступающего в электролизер 305 - 315 г/л.
В этих условиях степень превращения хлорида натрия составляет 0,4-0,5 дол. ед.
Эектролизер (электролитическая, ячейка) - основной аппарат в технологическом процессе производства едкого натра и хлора электролизом водного раствора хлорида натрия с железным катодом.
Диафрагменные электролизеры могут быть двух типов: с вертикально расположенными катодами с верхним или нижним токоподводом, или с горизонтально расположенными катодами. В настоящее время повсеместно используются электролизеры первого тпа (рис 2).
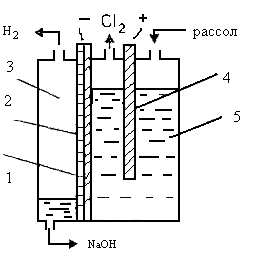
Рис. 2. Электролизер вертикального типа: 1 – перфорированный катод, 2 – диафрагма, 3 – катодное пространство, 4 – анод, 5 – анодное пространство.
Электролизер состоит из герметически
закрытого корпуса, что исключает подсос воздуха и загрязнение им газообразных
продуктов электролиза, анода, катода и диафрагмы. Он снабжен устройствами для
подвода рассола и отвода щелока, хлора и водорода. Катод![]() электролизера
изготовлен из перфорированной листовой стали или стальной сетки, натянутой на
каркас. Катод может иметь различную конфигурацию. Диафрагму электролизеров
изготавливают из асбеста, устойчивого к слабокислой, щелочной среде и действию
хлора. Диафрагмы могут быть двух типов: листовые и осажденные. Листовые
диафрагмы изготавливают из тонких листов асбестового картона, плотно
прилегающих к катоду, осажденные - из специально подготовленного асбестового
волокна, наносимого в виде пульпы на поверхность катода и насасываемого на
него. В табл. 2. приведены характеристики наиболее распространенных современных
электролизеров с металлооксидными анодами БГК-50/25 и БГК-100, различающиеся
производительностью.
электролизера
изготовлен из перфорированной листовой стали или стальной сетки, натянутой на
каркас. Катод может иметь различную конфигурацию. Диафрагму электролизеров
изготавливают из асбеста, устойчивого к слабокислой, щелочной среде и действию
хлора. Диафрагмы могут быть двух типов: листовые и осажденные. Листовые
диафрагмы изготавливают из тонких листов асбестового картона, плотно
прилегающих к катоду, осажденные - из специально подготовленного асбестового
волокна, наносимого в виде пульпы на поверхность катода и насасываемого на
него. В табл. 2. приведены характеристики наиболее распространенных современных
электролизеров с металлооксидными анодами БГК-50/25 и БГК-100, различающиеся
производительностью.
Таблица 2
Характеристики электролизеров с железным катодом и металлооксидными анодами
| Показатели | Тип электролизера | |
| БГК-50/25 | БГК-100 | |
Сила тока (нагрузка на ячейку), кА |
50 | 100 |
| Число ячеек (электролизеров) | 1 | 1 |
| Напряжение, В | 3,40 | 3,45 |
| Выход по току, дол. ед. | 0,96 | 0,96 |
| Срок службы электродов, лет | 4 | 4 |
| Концентрация NaOH в щелоке, г/л | 120-140 | 120-140 |
|
Концентрация хлора, не менее об. дол. |
0,965 | 0,975 |
|
Концентрация водорода, не менее об, дол. |
0,995 | 0,995 |
|
Производительность по 100% NaOH, т/сутки |
1,72 | 3,44 |
В цехе электролиза, отдельные ячейки (электролизеры) объединены в группы до 150 штук. Тогда суммарное напряжение электролиза составит 3,4·150 = 510 В.
Разновидность диафрагменного способа - более совершенный процесс электролиза в электролизерах с ионообменной мембраной. В таких электролизерах анодное и катодное пространства разделены полимерной мембраной, которая предотвращает попадание хлорида натрия из анодного пространства в которое подается рассол, в катодное и препятствует переносу ионов ОН- к аноду электролизера. Хлор выделяется на аноде и выводится из анодного пространства вместе с обедненным рассолом. Ионы натрия и частично молекулы воды проходят через мембрану к катоду, куда подается вода в количестве, необходимом для образования щелока заданной концентрации. Электролизеры мембранного типа различаются числом ячеек (от 40 до 80) и имеют мощность до 80 тысяч тонн в год по гидроксиду натрия. В отличие от электролизеров с асбестовой диафрагмой нагрузка на ячейку (сила тока) значительно ниже и не превышает 7,5 кА. Поэтому электролизеры с ионообменной мембраной значительно экономичнее диафрагменных.
1.3. Электролиз раствора хлорида натрия с ртутным катодом
На ртутном катоде разряд ионов гидроксония Н3О может происходить только при малых, менее 50 А/м, плотностях тока. В условиях промышленного электролиза водных растворов хлорида натрия в электролизерах с ртутным катодом плотность тока составляет 5-10 кА/м2. При такой плотности тока, вследствие перенапряжения потенциал разряда ионов Н3О составляет +2,0 В. В то же время, за счет растворения выделившегося металлического натрия в ртути, образуется амальгама Natign, представляющая качественно новый электрод, потенциал разряда натрия на котором составляет +1,2 В. Поэтому, на катоде будут разряжаться ионы натрия.
Первичные процессы разряда на аноде при электролизе с ртутным катодом те же, что и при электролизе с железным катодом. В табл. 3. приведены потенциалы разряда ионов и уравнения первичных процессов при электролизе с ртутным катодом.
Таблица 3
Электролиз с ртутным катодом
| Электрод | Потенциал разряда, В | Первичная реакция | ||
|
Ер |
Епер |
Е | ||
| Катод |
+2,71 0,84 |
- 0,26 |
+2,71 +1,10 |
Na+ + ē® Na H3O+ |
| Анод |
-0,83 -1,33 |
-1,07 -0,27 |
-1,90 -1,60 |
OH- Cl- - ē = 0,5 Cl2 |
Теоретическое напряжение разложения равно:
VT = Ek + Ea = +1,2-(-1,6) = 2,8 В
Практически, при проведении электролиза с ртутным катодом на токоподводах электролизера поддерживается напряжение, равное 4,5 В.
Вторичные процессы при электролизе водного раствора хлорида натрия с ртутным катодом сводятся к реакци:
- разложение амальгамы натрия водой вне электролизера в разлагателе:
NaHgn + H2O®- NaOH + 0,5H2 + nHgn
- растворение натрия в ртути и образование жидкой амальгамы натрия в катодном пространстве.
Так как в электролизе с ртутным катодом не происходит разряда ионов НзО+, то концентрация ионов гидроксила в катодном пространстве электролизера не увеличивается и вторичные процессы в анодном пространстве отсутствуют.
Суммируя уравнения реакций первичных процессов и вторичных процессов образования и разложения амальгамы натрия, получаем уравнение процесса электролиза, идентичное ранее полученному:
NaCI ® Na + 0,5Cl
Na + nHg ® NaHgn
NaHgn + H2O ® NaOH + 0,5H2 + nHg
![]()
![]() NaCl + H2O ® NaOH + 0,5H2 + 0,5Cl2
NaCl + H2O ® NaOH + 0,5H2 + 0,5Cl2
в разлагателе у анода
Электролизер, используемый в процессе электролиза с ртутным катодом, состоит из собственно электролизера (ванны) и разлагателя. Конструктивно разлагатель может быть объединен в одно целое с электролизером или вынесен отдельно. По дну ванны, имеющему небольшой уклон, непрерывно движется тонкий (толщиной 5 мм) слой ртути, являющийся катодом. Образующаяся в процессе электролиза жидкая амальгама натрия концентрацией не более 3×10-4 масс. дол., самотеком поступает в разлагатель, куда подается вода. Из разлагателя, выделяющийся водород поступает в общий коллектор, а раствор гидроксида натрия концентрацией 0,5 масс. дол. направляется в сборник щелока. На рис. 3. приведена принципиальная схема электролиза с ртутным катодом.
В табл. 4. даны характеристики наиболее распространенных электролизеров с ртутным катодом.
Таблица 4
Характеристики электролизеров с ртутным катодом
| Показатель | Тип электролизера | |
| Р-101 | Р-300 | |
| Сипа тока (нагрузка), кА | 150 | 300 |
| Напряжение, В | 4,6 | 4,7 |
| Выход по току, дол. ед. | 0,95 | 0,95 |
|
Расход энергии на 1 т Cl2, кВт×ч |
3620 | 3680 |
|
Производительность по Сl2, т /сутки |
4,5 | 9,04 |
Сопоставление диафрагменного и ртутного методов производства едкого натра и хлора позволяет заключить, что:
- электролизеры с ртутным катодом потребляют больше энергии вследствие высокого напряжения разложения, эксплуатация их сложнее, капитальные затраты выше, а условия труда из-за токсичности ртути тяжелее. Однако в них можно получать более концентрированные и свободные от хлорида натрия щелока, что об легчает последующее выделение гидроксида натрия,
- электролизеры с железным катодом позволяют использовать в качестве сырья подземные рассолы, тогда как в ваннах с ртутным катодом применяется только чистая соль. Их недостаток - высокое (до 0,04 масс. дол. против 0,0005 масс. дол. в ртутных ваннах) содержание в щелоке хлорида натрия, затрудняющее его переработку.
Себестоимость гидроксида натрия полученного электролизом с ртутным катодом на 10-15% выше, чем себестоимость полученного диафрагменным методом.
Дальнейшее совершенствование процесса производства гидроксида натрия и хлора электрохимическим методом заключается в:
- разработке процесса, сочетающего диафрагменный и ртутный методы, в котором твердый хлорид натрия, полученный выпариванием обратного щелока из диафрагменного электролизера, поступает на донасыщение анолита из ванн с ртутным катодом,
- внедрение электролизеров диафрагменного типа с ионообменной мембраной.
1.4. Переработка продуктов электролиза
Электролиз водного раствора хлорида натрия используется для промышленного производства гидроксида натрия. В качестве побочного продукта при этом получается водород.
Переработка щелока в гидроксид натрия. Электролитический щелок, получаемый электролизом с ртутным катодом, не содержит хлорида натрия. Для получения из него гидроксида натрия щелок упаривают до заданной концентрации и затем обезвоживают. Щелок, получаемый электролизом с железным катодом, содержит 170—200 г/л хлорида натрия. Процесс переработки этого щелока заключается в выделении из него хлорида натрия, возвращаемого в технологический процесс, упаривании раствора и обезвоживании полученного плава едкого натра для получения твердого продукта. Выделение хлорида натрия из щелока основано на его изотермической кристаллизации. Растворимость хлорида натрия в водных растворах гидроксида натрия понижается с увеличением концентрации последнего.
Поэтому при упаривании щелока из него выпадает растворенный в нем хлорид натрия. Упаривание до концентрации выше 50% масс. практически нецелесообразно, так как за этим пределом растворимость хлорида натрия почти не изменяется. Выделившийся хлорид натрия после охлаждения раствора отделяют на фильтре, промывают и вновь используют для электролиза (обратная соль).
В некоторых отраслях промышленности используют твердый едкий натр. Для его получения очищенный от хлорида натрия и упаренный щелок обезвоживают (плавят) в котлах, обогреваемых топочными газами, или в вакуум-выпарных установках непрерывного действия, обогреваемых высококипящим органическим теплоносителем - даутермом (смесь дифенила и диоксида).
Технический гидроксид натрия (едкий натр) выпускают в твердом виде (плавленный и в виде чешуек) с содержанием NaOH не менее 95% (ГОСТ 2263-71) и в виде водного раствора с содержанием NaOH не менее 610 г/л (ГОСТ 11078-71).
2. Технологическая часть
2.1. Характеристика исходного сырья
Исходным компонентом при производстве едкого натрия является хлорид натрия. При производстве применяют также карбонат натрия и соляная кислота.
Натрия хлорид (поваренная соль, каменная соль) NaCl, бесцветные мало гигроскопичные кристаллы с кубической гранецентрирированной решеткой (а = 0,56402 нм, пространственная группа Fm3m, z = 4); ТПЛ = 801°С, Ткип. = 1413°С; плотность - 2,161 г/см3 (20°С); Ср° - 50,50 Дж/(моль×К); АН°ПЛ -28,20 кДж/моль, DН°обр - 411,26 кДж/моль; S0298 = 72,15 Дж/(моль×К).
В равновесном паре содержится 83 молекулярных % NaCl и 17% Na2Cl2. Растворимость в воде (г в 100 г): 35,68 (10°С), 35,87 (20°С), 36,80 (50°С), 38,12 (80°С). Растворимость в жидком NH3, спиртах, этиленгликоле, муравьиной кислоте, не растворим в соляной кислоте. В интервале от -21,2 до 0,15°С кристаллизуется дигидрат NaCl-2H2O; плотность 1,6 г/см3; давление водяного пара над ним изменяется от 91,77 (-21,2°С) до 462,84 Па (0,15°С). Насыщеннный водный раствор (28,41% по массе NaCl) кипит при 108,7°С.
В природе хлорид натрия встречается в виде минерала галита (каменная соль), в воде океанов и морей, рапе соляных озер и подземных рассолах.
Хлорид натрия производят из природного сырья. Добыча каменной соли осуществляется закрытым способом (реже - открытым) с применением подземного выщелачивания. Добыча самосадочной соли из соляных озер производится механическим способом, озерную соль промывают рапой, центрифугируют и сушат. Садочную (бассейновую) соль получают естественным испарением морских и озерных рассолов в системе специально устроенных бассейнов, в местностях с холодным климатом используют вымораживание. Выварочную соль (наиболее чистая) производят упариванием естественных или искусственно полученных и очищенных рассолов в вакуум-выпарных аппаратах. Для технических целей применяют каменную и самосадочную соль, для пищевых - выварочную, самосадочную и садочную. Производят специальные сорта хлористого натрия: йодированную, брикетированную и исслеживающуюся, чистую с содержанием хлористого натрия выше 99,9% по массе. Хлорид натрия - пищевой продукт, консервирующее средство, сырье для получения Na2CO3, Cl2, NaOH, хлорной извести и др.; его применяют более чем в 1500 производств различных веществ и материалов. Мировое производство около 175 млн. т/год (1980). ПДК в воздухе 1,0 мг/м3.
Натрия карбонат (кальцинированная сода) Na2CO3, бесцветные кристаллы; до 350 °С существует a-модификация (см. табл. 5), в интервале 350-479 °С - b с моноклинной кристаллической решеткой, а выше 479°С -гексагональная модификация g (а = 0,5215 нм, с = 0,6584 нм, z = 2, пространственная группа Р63тс); DН0 переходов a « b и b « g соответственно 0,80 и 2,1 кДж/моль; Тпл. = 858°С; DН°ПЛ = 28 кДж/моль.
Гигроскопичен. Растворимость в воде = 17,69% по массе (20 °С); DН0 растворения для бесконечно разбавленного раствора - 26,65 кДж/моль; растворы имеют сильнощелочную реакцию. Ниже 32°С из водных растворов кристаллизуется декагидрат, в интервале 32-35°С - гексагидрат, выше 35°С - моногидрат, а выше 112,5 °С - безводная соль. В природе карбонат натрия встречается в виде грунтовых рассолов, рапы в озерах и минералов-натрона Na2CO3·10H2O, термонатрита Na2CO3·H2O, троны Na2CO3·NaHCO3·2H2O. В России мощность месторождений природного карбонат натрия около 4 млн. т. Крупные запасы карбонат натрия сосредоточены в США, Канаде, Кении, Мексике, ЮАР и др.
Основное количество карбоната натрия получают аммиачно-хлоридным способом (способ Сольвэ): естественный или искусственно приготовленный рассол NaCl очищают от примесей Са и Mg действием Na2CO3, и Са(ОН)2, насыщают NH3, а затем подвергают карбонизации в барботажных колоннах. Прокаливанием NaHCO3 получают Na2CO3. Карбонат натрия добывают также из природных залежей, соляных рассолов. Применяют: как компонент шихты в производстве стекла; для получения мыла и др. моющих средств, гидроксида Na и др. соединений Na; при варке целлюлозы; для обработки бокситов в производстве А1; для нейтрализации кислых компонентов при очистке нефтепродуктов; для получения пигментов, например Fe2O3 из FeCl3. ПДК в воздухе 2 мг/м3.
Соляная кислота (хлористоводородная кислота, хлороводородная кислота), раствор НС1 в воде - бесцветная жидкость с резким запахом; сильная одноосновная кислота. Хлористый водород НС1 (молекулярная масса 36,461 ) - бесцветный газ с резким запахом, во влажном воздухе сильно дымит; длина связи Н-С1 0,1274 нм, энергия диссоциации - 427,77 кДж/моль; Ткип - 85,1°С (бесцветная легко подвижная жидкость), Тпл -114,22°С; кристаллизуется в кубической решетке, ниже -174,15°С существует ромбическая модификация; тройная точка -114,22 °С; плотность по воздуху 1,2679; tкрит = 51,4°С, ркрит = 8,258 МПа, dкрит = 0,42 г/см3; DНПЛ = 1,9924 кДж/моль (-114,22°С), давление пара (Па): 133,32-10"° (-200,7°С), 2,775-103 (-130,15°С), 10,0x104 (-85,1°С), 74,0x104 (-40°С), 24,95×105 (О°С), 76,9×105 (50°С).
![]() 2.2.
Характеристика готового продукта
2.2.
Характеристика готового продукта
Натрия гидроксид (каустическая сода) NaOH, бесцветные кристаллы; до 299°С устойчива ромбическая модификация (а = 0,33994 нм, с = 1,1377 нм), выше 299°С - моноклинная; DН0 полиморфного перехода 5,85 кДж/моль; Тпл. = 323°С, Ткип. = 1403°С; плотность 2,02 г/см3; С°р = 59,54 Дж/(моль·К); DН°обр = -425,88 кДж/моль, Н°ВОЗГ - 239,335 кДж/моль (0 К); DН°ПЛ 7,8 кДж/моль; S°298 = 64,43 Дж/(моль×К). Показатели преломления: меньший Np= 1,457, средний Nm = 1,470, больший Ng = 1,472. Растворимость (% по массе): в воде - 52,2 (20°С), метаноле-23,6 (28°С), этаноле-14,7 (28°С); DН0 растворения для бесконечно разбавленного водного раствора - 44,45 кДж/моль; водные растворы имеют сильнощелочную реакцию. Гидроксид натрия поглощает из воздуха СО2, образуя Na2CO3. В жидком NH3 практически не растворяется. j
Из водных растворов при 12,3-61,8°С кристаллизуется моногидрат (сингония ромбическая; Тпл = 65,1°С; плотность 1,829 г/см3; DН°о6р - 734,96 кДж/моль), а в интервале от -28 до - 24°С - гептагидрат, от -24 до -17,7°С - пентагидрат, от -17,7 до -5,4°С - тетрагидрат (a-модификация), а при -5,4 - 12,3°С - NaOH×3,5H2O (Тпл = 15,5°С); известен также метастабильный b-NaOH×4H2O. Выше 61,8°С кристаллизуется безводная соль.
Гидроксид натрия - сильное основание, относится к щелочам. Со спиртами образует алкоголяты. Расплавленный гидроксид натрия растворяет Na и NaH. Разрушает материалы органического происхождения (бумагу, кожу и др.). Получают гидроксид натрия: электролизом растворов NaCl (с одновременным получением С12) с использованием твердых электродов и проточного электролита (60-90°С) либо ртутного катода (до 70°С); взаимодействием горячего раствора Na2CO3 с Са(ОН)2; реакцией Ва(ОН)2 с раствором Na2SO4. Применяют: для очистки нефти, масел; в производстве бумаги, мыла, искусственных волокон и др.; как осушающий агент для газов и многих органических жидкостей; водные растворы - электролиты в воздушно-цинковых элементах. Вызывает тяжелые ожоги кожи и слизистых оболочек; ПДК в воздухе 0,5 мг/м3.
2.3. Модели рассматриваемой ХТС
2.3.1. Химическая модель
В процессе получения NaOH протекают электрохимические реакции:
NaCI ® Na + 0,5Cl
Na + nHg ® NaHgn
NaHgn + H2O ® NaOH + 0,5H2 + nHg
![]()
![]() NaCl + H2O ® NaOH + 0,5H2 + 0,5Cl2
NaCl + H2O ® NaOH + 0,5H2 + 0,5Cl2
в разлагателе у анода
Заключение
В представленной работе осуществлён анализ структуры химико-технологических схем электрохимического производства гидроксида натрия. Оценены достоинства и недостатки перечисленных методов. Доказано технико-экономическое преимущество применение метода электролиза с ртутным катодом.
На основании проведённого анализа предложена модель ХТС по изготовлению гидроксида натрия, характеризуемая простой технологией, включающей минимум стадий, минимальной себестоимостью продукта.
Благодаря применению циркуляционной схемы построения технологической линии максимально снижен расход карбоната кальция и соляной кислоты и решена проблема утилизации отходов. Все растворители работают в замкнутых циклах, что так же снижает экологическую напряжённость производства.
Список использованных источников
1. Кутепов А.М. Общая химическая технология / А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. М.: Высшая школа, 1990. - 520 с.
2. Общая химическая технология / Под ред. И.П. Мухлёнова М.: Высшая школа. – 1984. - т 1. - 419 с.
3. Расчёты химико-технологических процессов / Под ред. И.П. Мухлёнова, изд 2. - М.: Химия. 1982. - 245 с.
4. Бесков С.Д. Технологические расчёты / С.Д. Бесков. М.: Высшая школа,1966, 519 с.