
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Синтез и анализ ХТС в производстве ацетона
Курсовая работа: Синтез и анализ ХТС в производстве ацетона
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ
ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КУРСОВАЯ РАБОТА
по дисциплине «Общая химическая технология»
на тему:
СИНТЕЗ И АНАЛИЗ ХТС В ПРОИЗВОДСТВЕ АЦЕТОНА
Выполнил:
студент группы
Проверил:
2008 г.
1. Содержание
1. Содержание 2
2. Задание
3. Введение
4. Синтез ХТС
Обоснование создания эффективной ХТС
Определение технологической топологии ХТС
Установление технологических и конструкционных
параметров ХТС, технологических параметров
режима и потоков
Химическая модель ХТС
Функциональная модель ХТС
Структурная модель ХТС
Операторная модель ХТС
Технологическая схема ХТС
5. Анализ ХТС
Представление изучаемого объекта в виде
иерархической структуры ХТС
Построение математической модели ХТС
Изучение свойств и эффективности
функционирования ХТС
6. Заключение
2. Задание
Какое количество гидроперекиси изопропилбензола необходимо, если известно, что в процессе разложения получается 6 т. толуола, степень разложения 80 %
3. Введение
Ацетон СН3СОСН3 известен с 1732 г как продукт сухой перегонки солей уксусной кислоты и ранее назывался пироуксусным эфиром. Состав ацетона определили Ю. Либих и Ж. Дюма в 1832 г., а А. Уильямсон установил его строение (1852 г), которое позднее было подтверждено синтезом ацетона из цинк-диметила и хлористого ацетила.
Долгое время ацетон не имел широкого применения и производился в небольших масштабах термическим разложением уксуснокислого кальция («уксусного порошка»), получаемого при сухой перегонке древесины."
Вследствие зарождения и развития химии синтетических материалов возникла потребность в таком хорошем растворителе, каким является ацетон; это заставило искать новые способы его получения.
В настоящее время ацетон широко применяется в качестве растворителя в различных отраслях промышленности. Он является также сырьем для синтеза целого ряда соединений, в том числе растворителей более сложного строения, таких, как диа-цетоиовый спирт, окись мезитила, метилизобутилкетон, метил-изобутилкарбинол; из ацетона (через ацетонциангидрин) получают метилметакрилат, применяемый в производстве органического стекла, изофорон, уксусный ангидрид, дяфенилолпропан и другие продукты.
Разнообразие областей применения ацетона вызвало быстрый рост его производства.
В Российской Федерации ацетон применяется главным образом как растворитель в производстве автомобильных, авиационных, кабельных, кожевенных и других лаков и эмалей, кинопленок, фотореагентов, целлулоида, ацетатного шелка и т. п. Для химических синтезов используется лишь небольшая часть ацетона.
В данной работе приводится анализ различных способов получения ацетона, выбор оптимальной технологической схемы, обеспечивающей экономически эффективный, технологически целесообразный и экологически безопасный метод производства.
4. Синтез ХТС
Производство ацетона брожением крахмала
Ферментативный метод является самым старым методом получения ацетона в промышленных масштабах. В результате жизнедеятельности некоторых видов бактерий (Bacyllus acetobutylicus и др.) крахмал превращается в ацетон и n-бутиловый спирт. В качестве сырья для этого процесса чаще всего применяют кукурузную муку; из 100 кг муки можно получить 12 кг n-бутанола, 6 кг ацетона и 2 кг этилового спирта [1].
Производство ацетона из изопропилового спирта
Изопропиловый спирт в довольно больших количествах вырабатывается в различных странах путем сернокислотной или прямой гидратации пропилена. Основным потребителем изопропилового спирта является производство ацетона, который может быть получен из него двумя методами: каталитическим дегидрированием и неполным окислением (в паровой или жидкой фазе).
Каталитическое дегидрирование изопропилового спирта. Метод каталитического дегидрирования изопропилового спирта в ацетон осуществляется в промышленности США с 1923 г. и получил широкое распространение в других странах. Принципиальная схема производства ацетона этим методом показана на рис. 1. Процесс протекает в одну стадию то реакции:
СН3СН(ОН)СН3 → СН3СОСН3 + Н2 – 69,9 кДж (16,7 ккал)
В качестве катализатора Используется главным образом окись цинка, осажденная на пемзе. Повышение температуры способствует сдвигу равновесия реакции в сторону образования ацетона. По данным Кольбе и Барвелла [1], степень превращения Изопропилового спирта в ацетон при 225 °С составляет 84%, три 325 °С – 97%, при 525 °С – 100%, однако в последнем случае в значительной степени протекают побочные реакции.
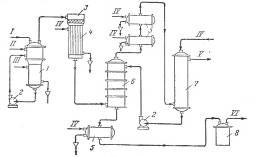
Рис. 1. Принципиальная схема производства ацетона дегидрированием изопропилового спирта:
1 – испаритель; 2 – насосы; 3 – реактор; 4 – водяной холодильник смешения; 5 – холодильники; 6 – башня снасадкой; 7 – Водяной скрубберу; 9 – сборник ацетона
I – изопропиловый спирт; II – водород; III – пар; IV – вода; V – отходящие газы; VI – товарный ацетон.
Для предотвращения образования продуктов полимеризации, отравляющих катализатор, исходный изопропиловый спирт смешивают в паровой фазе с эквимолекулярным количеством водорода. Реакцию проводят яри 380°С, степень превращения изопропилового спирта составляет 98%. Реактор представляет собой заполненный катализатором трубчатый аппарат, межтрубное пространство которого обогревается топочными газами.
После 10 суток работы требуется регенерация катализатора, так как активность его уменьшается вследствие отложения углерода на поверхности. Регенерацию осуществляют пропусканием через слой катализатора азота, содержащего – 2% кислорода, при 500 °С, Срок службы катализатора – около 6 месяцев.
Контактные газы из реактора поступают на охлаждение (при котором конденсируется около 50% ацетона), после чего их промывают водой, поглощающей ацетон. Промывные воды подвергаются фракционированию и азеотропной перегонке для выделения товарного ацетона и безводного изопропилового спирта, снова направляемого на дегидрирование.
Водород после промывки от ацетона возвращается на разбавление спирта, а водород, образовавшийся при дегидрировании, выводится из системы и используется для других синтезов. Выход ацетона составляет около 90% (считая на изопропиловый спирт). На 1 т ацетона расходуется 1,1—1,2 т изопропилового спирта или около 0,9 т пропилена [1].
Французским институтом нефти разработан способ дегидрирования изопропилового спирта в жидкой фазе. Катализатором процесса служит суспендированный в исходном спирте никель Ренея, реакцию проводят при 150 °С. В этих условиях достигаются почти количественные выходы ацетона.
Неполное окисление изопропилового спирта в паровой фазе.
Реакция неполного окисления изопропилового спирта
СН3СН(ОН)СН3 + 0,5 О2 → СН3СОСН3 + Н3О + 180 кДж (43 ккал)
протекает в присутствии металлических катализаторов – меди, серебра, никеля, платины и т. д.
Высокий выход ацетона достигается при использовании серебра, осажденного на пемзе, или серебряной сетки. Температура реакции может изменяться в широких пределах (450— 650 °С) и выбирается в зависимости от применяемого катализатора, объемной скорости паров спирта и воздуха и других факторов.
Перед подачей реагентов в контактный аппарат (рис. 2) изопропиловый спирт испаряют в испарителе-сатураторе, насыщают парами воздуха и перегревают полученную паровоздушную смесь. Реакция протекает в адиабатических условиях, т. е. тепло, выделяющееся в процессе окисления, воспринимается самой реакционной смесью.
При окислении, «роме ацетона, образуется также некоторое количество побочных продуктов, в том числе уксусной кислоты и ацетальдегида. Поэтому контактные газы после прохождения ими металлического катализатора пропускают через насадку в виде слоя мела, на которой уксусная кислота и ацетальдегид почти количественно превращаются в ацетон. Оптимальной для этой реакции является температура 450 °С, достигаемая охлаждением контактных газов во встроенном в реактор змеевике.
Из контактного аппарата газы поступают в котел-утилизатор, а затем последовательно на «парциальную» конденсацию и водную абсорбцию. Несконденсировавшиеся газы после абсорбции ацетона водой сбрасывают в атмосферу. Промывные воды из скруббера объединяют с конденсатом и направляют на ректификацию.
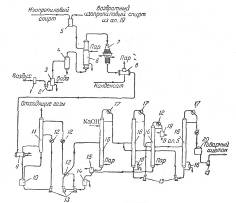
Рис. 2. Принципиальная схема производства ацетона неполным окислением изопропилового спирта в паровой фазе:
1 – висциновый фильтр; 2 – ротационный компрессор; 3, 9, 12, 19 – холодильники; 4 – ресивер; 5 – сборник изопропилового спирта; 6 – испаритель-сатуратор; 7 – контактный аппарат; 8 – котел-утилизатор; 9 – сборник конденсата; 10 – скруббер; 11 – насосы; 12 – сборник сточной воды; 15 – сепаратор; 16 – ректификационные колонны; 17 – дефлегматоры; 18 – кипятильники; 20 – сборник ацетона.
В первой по ходу процесса ректификационной колонне из водного раствора отгоняют ацетон и изопропиловый спирт. В верхнюю часть колонны для очистки от осмоляющихся примесей подают 15%-ный раствор NaOH. Вода из куба колонны после осаждения органических веществ и утилизации ее тепла подается в скруббер на абсорбцию ацетона.
В следующей колонне происходит разделение продуктов на ацетон-сырец и раствор изопропилового спирта. Ацетон-сырец поступает на ректификацию для выделения товарного ацетона; изопропиловый спирт выделяют перегонкой из водного раствора и возвращают на окисление.
Неполное окисление изопропилового спирта в жидкой фазе.
Интересным методом получения ацетона из изопропилового спирта является его неполное окисление и жидкой фазе. Этот метод, применяемый для производства перекиси водорода, осуществляется с 1957 г. на заводе фирмы «Shell Chemical Со.» в США [2].
Процесс протекает по схеме
СН3СН(ОН)СН3 + О2 → СН3СОСН3 + Н2О2
и проводится автокаталитически при 90 – 140°С под давлением, позволяющем удерживать смесь в жидкой фазе. В качестве окислителя можно применять как воздух, так и кислород.
Реактор должен быть изготовлен из материалов, не разлагающих перекись водорода. На окисление подают 89%-ный раствор изопропилового спирта; по достижении концентрации перекиси водорода 15 – 25% продукт выводится из реактора, разбавляется водой и стабилизируется. Ацетон и не прореагировавший спирт отгоняют и очищают, перекись водорода концентрируют быстрым испарением и вакуум-перегонкой.
Выход ацетона составляет 95% от теоретического, выход перекиси водорода – около 87 %25.
Другие методы получения ацетона
Ацетон получается также в качестве побочного продукта в синтезе аллилового спирта из изопропилового спирта и акролеина:
СН3–СН(ОН) –СН3 + СН2=СН–СНО → СH2=СН–СН2ОН + СН3–СО–СН3
Эта реакция проводится в паровой фазе при 350–450 °С и атмосферном давлении в присутствии катализатора – смеси окиси магния и окиси цинка.
Данный процесс, так же как и процесс получения ацетона и перекиси водорода из изопропилового спирта, является составной частью синтеза глицерина по методу американской фирмы «Shell Chemical Со.»:
|
|
||||
а) пропилен → изопропиловый спирт → ацетон + перекись водорода
|
б) пропилен → акролеин
в) акролеин + изопропиловый спирт → аллиловый спирт + ацетон
г) аллиловый спирт + перекись водорода → глицерин.
Значительные количества ацетона производят из этилового спирта, ацетилена и уксусной кислоты. Все три процесса по механизму, вероятно, сходны между собой.
Реакция
2С2Н5ОН + Н2О--- → СН3СОСН3 + СО2 + 4Н2
протекает при взаимодействии паров этилового спирта и воды в присутствии катализатора — окиси железа, активированной известью; температура процесса 470 °С. Водной промывкой из контактных газов выделяют ацетон в виде 5%-ного водного раствора. Выход ацетона по этиловому спирту составляет 86% [2]. Катализатор нуждается в периодической регенерации, общий срок его службы — 6 месяцев. Реакцию
2СН=СН + ЗН2О → СН3СОСН3 + СО2 + 2Н2
проводят пропусканием ацетилена в смеси с избытком водяного пара над катализатором, состоящим из окисей цинка и железа. Процесс протекает при той же температуре (470 °С), что и синтез ацетона из этилового спирта. Катализатор периодически регенерируют. При промывке контактных газов водой получают 10%-ный водный раствор ацетона, который подвергают ректификации. Выход ацетона равен 85% от теоретического. Эта реакция успешно осуществлялась даже при применении газа, содержащего 8% ацетилена («разбавленный» ацетилен).
В обоих описанных процессах ацетон получается, по-видимому, в результате декарбоксилирования промежуточно образующейся уксусной кислоты, способность которой превращаться в (СН3)2СО при нагревании с солями металлов (например, с ацетатом кальция) известна уже давно.
Это обстоятельство использовано для оформления в промышленном масштабе процесса производства ацетона пропусканием паров уксусной кислоты над окисью церия (осажденной на пемзе) при 400—450 0С и атмосферном давлении:
2СН3СООН → СН3СОСН3 + СО2 + Н2О
Выход ацетона достигает 95% от теоретического.
Одним из путей получения ацетона в промышленности является каталитическое окисление пропан-бутановых смесей при низкой температуре и высоком давлении, осуществленное в США фирмами «Gelanese Corporation of America» и «Warren Petroleum Co.».
Наряду с ацетоном в этом процессе образуются также уксусная кислота (главный продукт), метилэтилкетон, ацетальдегид, метанол, муравьиная, пропионовая и масляная кислоты и различные лактоны.
Недавно была показана возможность синтеза ацетона прямым окислением пропилена в присутствии хлористого палладия. Сообщают, что пропилен легко превращается в ацетон в течение 5 мин при 20 °С; выход ацетона составляет 90% от теоретического.
Процесс окисления пропилена, выражаемый суммарным уравнением
СН3СН=СН2 + 0.5 О2 → СН3СОСН3
протекает в две стадии:
а) СН3СН=СН2 + РbС12 + Н2О → СН3СОСН3 + Рb + 2НС1
б) Рb + 2НС1 + 0.5 О2 → Рb С12 + Н2О
На практике процесс осуществляется значительно сложнее. Реакционной средой является водный раствор солей палладия, железа и меди. В этот раствор пропускают олефин. Хлористый палладий дает с олефином комплекс, который легко разрушается с образованием карбонильного соединения, металлического палладия и соляной кислоты. Металлический палладий немедленно окисляется в хлорид солями железа и меди, которые при этом переходят в соли низшей валентности. Окисление солей меди и железа в соли с высшей валентностью осуществляется кислородом (или кислород-азотной смесью). Таким образом, указанные соли являются переносчиками кислорода.
Процесс может быть оформлен в одну стадию, если в реактор, содержащий раствор солей, одновременно поступают олефин и кислород, или в две стадии, когда олефин и кислород подаются в два отдельных реактора, между которыми циркулирует раствор солей.
Такой способ окисления олефинов в настоящее время разработан применительно к процессу получения ацетальдегида из этилена.
Наконец, как уже указывалось, ацетон получается в качестве побочного продукта в синтезе фенола по кумольному методу. Этот метод значительно сложнее технологически, но при реализации достаточно больших объёмов производства позволяет намного снизить себестоимость продукта.
4.1 Обоснование создания эффективной ХТС
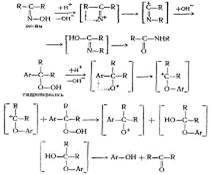
Реакция кислотного, или так называемого гетеролитического распада гидроперекисей, в отличие от гемолитического распада, до сравнительно недавнего времени не привлекала внимания исследователей. Толчком к изучению этой весьма интересной реакции послужило открытие и широкое распространение нового способа совместного получения фенола и ацетона через гидроперекись изопропилбензола.
П. Г. Сергеев, Р. Ю. Удрис и Б. Д. Кружалов, изучая в 1943 г. свойства впервые полученной ими гидроперекиси изопропилбензола, обнаружили, что данная гидроперекись в присутствии незначительных количеств серной кислоты практически количественно и с большой скоростью распадается на фенол и ацетон, выделяя при этом значительное количество тепла. Через год эта реакция была описана в литературе Хоком и Лан-гом [1]. В 1943—1946 гг. П. Г. Сергеев с сотрудниками детально изучил описанную реакцию, и несколько .позднее этот процесс был реализован в промышленном масштабе[2].
Первые сведения о возможности такого расщепления гидроперекисей относятся к более раннему периоду (1931 г.), когда была опубликована работа Виланда и Мейера [3], посвященная изучению свойств гидроперекиси трифенилметана. Эти авторы впервые синтезировали гидроперекись трифенилметана и пытались получить ее бензоильное производное. Однако при взаимодействии гидроперекиси с хлористым бензоилом неожиданно были получены фенол и бензофенон в эквимолекулярном соотношении:
(С6Н5)3–COOH → (С6Н6)3С=О + С6Н5ОН
Спустя 20 лет, в 1950 г., когда в СССР процесс получения фенола и ацетона через гидроперекись изопропилбензола уже был осуществлен в промышленности, появилась работа Караша с сотрудниками по изучению механизма реакции кислотного разложения гидроперекиси изопропилбензола.
Авторы отмечают, что реакция разложения чрезвычайно экзотермична и протекает с заметной скоростью даже при –80 СС. Для того чтобы свести к минимуму нежелательные побочные процессы, разложение проводилось в среде уксусной кислоты (в которой гидроперекись стабильна при комнатной температуре) в присутствии 0,1 мол. % хлорной кислоты. В этих условиях гидроперекись изопропилбензола количественно разлагалась на фенол и ацетон.
Для объяснения этой реакции Караш предложил цепной механизм:
|
С6Н5(СН3)2СООН → [С6Н5(СН3)2СО]+ + (АОН)— (а)
[С6Н6(СН3)2СО]+ → [СвН6-О-(СН3)2С]+ (б)
С6Н5(СН3)2СООН + [С6Н5–О– (СН3)2С]+ →
→ [СвН6(СН3)2СО]+ + С6Н5ОН + (СН3)2СО (в)
В описанной схеме «А» — сильная кислота по теории Льюиса. В результате бимолекулярной реакции гидроперекиси с кислотой образуется осколок молекулы, несущий положительный заряд на кислородном атоме, который перегруппировывается затем в катион, несущий положительный заряд на углеродном атоме (ион карбония). Этот ион, взаимодействуя с молекулой гидроперекиси, превращается в фенол и ацетон, регенерируя кислородный катион, который в свою очередь перегруппировывается в ион карбония и т. д.
Тот факт, что только сильные кислоты могут быть причиной гетеролитического распада гидроперекиси изопропилбензола, авторы доказывают следующим образом. Хлористый водород, растворенный в уксусной кислоте, не является сильной кислотой и в этом случае не пригоден для разложения гидроперекиси, тогда как в других условиях следы хлористого водорода вызывают бурный ее распад на фенол и ацетон. С другой стороны, хлорное железо, которое в спиртовом растворе представляет собой слабую кислоту, в данных условиях не разлагает гидроперекись. В то же время раствор хлорного железа в бензоле является сильной кислотой и быстро превращает гидроперекись изопропилбензола в фенол и ацетон. Аналогичные результаты были получены с другими растворителями (диоксан, бензол) и кислотами (растворы фтористого бора, хлористого алюминия, серная кислота). Это указывает на отсутствие специфического влияния растворителя или аниона.
Караш с сотрудниками наблюдали также, что присутствие в гидроперекиси диметилфенилкарбинола вызывает в условиях кислотного разложения образование димера α-метилстирола наряду с заметно уменьшающимися количествами фенола и ацетона. Если в реакцию вступали относительно большие количества этого карбинола (2 – 3 моль на 1 моль гидроперекиси), образование фенола и ацетона полностью прекращалось; основными продуктами при этом были димер а-метилстирола и перекись водорода.
На основании описанного эксперимента Караш. сделал вывод о том, что разложение гидроперекиси изопропилбензола может по существу измениться в присутствии вещества, способного конкурировать с гидроперекисью по отношению к кислоте «А». В данном случае, очевидно, диметилфенилкарбинол является более сильным основанием, чем гидроперекись изопропилбензола; следовательно, реакция (а) не может протекать.
Сравнительно недавно Хоку с сотрудниками удалось синтезировать бензоильное производное гидроперекиси изопропилбензола, которое безуспешно пытались получить Виланд и Мейер для гидроперекиси трифенилметана. Детально изучив механизм превращений гидроперекиси изопропилбензола, Хок предложил схему распада, в основе которой лежит перегруппировка иона оксония в ион карбония.
При рассмотрении реакции кислотного разложения гидроперекиси изопропилбензола с точки зрения, механизма, предложенного Карашем, становится очевидной аналогия с бекмановской перегруппировкой:
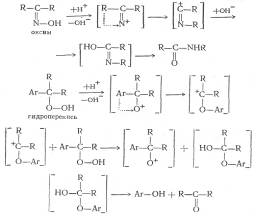
Несмотря на то, что схема, предложенная Карашем, наиболее полно объясняет процесс кислотного разложения гидроперекисей, следует отметить, что точный механизм первичного гетеролитического распада гидроперекисей в деталях не известен и трудно сказать что-либо определенное относительно продолжительности существования предполагаемого кислородного катиона и того, является ли он в действительности «свободным».
Таким образом можно сделать вывод о том, что процесс кислотного разложения гидроперекиси изопропилбензола является оптимальным процессом получения ацетона.
Рассмотрим технические решения по созданию данного производства.
4.2 Определение технологической топологии ХТС
Вследствие того, что реакция кислотного разложения гидроперекиси изопропилбензола нашла большое практическое применение в производстве фенола и ацетона, в научно-технической литературе с каждым годом появляются новые сообщения относительно различных способов осуществления данного процесса. В основном вся литература по этому вопросу представлена в виде патентов или коротких сообщений рекламного характера. В то же время опубликовано очень мало сведений о конкретном аппаратурно-технологическом оформлении процесса кислотного разложения гидроперекиси на действующих или проектируемых промышленных установках.
В большинстве случаев в качестве катализатора рекомендуют серную кислоту, концентрированную или разбавленную. При этом, как правило, концентрированная кислота применяется в каталитических количествах (0,1—2% от веса гидроперекиси), а разбавленная кислота берется в большом избытке. В ряде патентов предлагают вместо серной кислоты использовать хлорную и фосфорную кислоты, органические сульфокислоты, сульфированную феноло-формальдегидную смолу. Рекомендуют проводить разложение гидроперекиси изопропилбензола сернистым ангидридом в аппарате пленочного типа. Сообщают о возможности разложения гидроперекиси сульфидами щелочных или щелочноземельных металлов и их смесей, а также в присутствии таких катализаторов, как фосфор, сера, селен и мышьяк при 108—110 °С в вакууме. В качестве катализаторов для разложения концентрированной или разбавленной гидроперекиси предлагают безводные сульфаты меди, кальция, бериллия, магния, стронция и бария. Разложение гидроперекиси можно также осуществить на пористом материале, пропитанном серной кислотой, с помощью катализаторов алкилирования (А1С13, FеС13, активные глины) или на ионообменных смолах. Несмотря на множество предложенных катализаторов, в промышленности России и за рубежом применяют только серную кислоту, и нет никаких сведений о использовании других катализаторов.
Вследствие большого теплового эффекта реакции разложения гидроперекиси на фенол и ацетон (2×103 кДж/кг = 486 ккал/кг) необходимо отводить выделяющееся тепло в качестве среды, воспринимающей тепло, применяют изопропилбензол, фенол, ацетон или серную кислоту.
В значительной части патентов указывается на возможность кислотного разложения неконцентрированной гидроперекиси изопропилбензола в том виде, в каком она получается сразу после окисления, т. е. состоящей примерно из 25% гидроперекиси и 70—75% изопропилбензола. Разложение такой гидроперекиси обычно осуществляют с помощью относительно большого количества разбавленной серной кислоты — в гетерогенной среде. Конструкция реактора не описывается, однако указано, что смесь в реакторе должна интенсивно перемешиваться для обеспечения необходимой скорости реакции. Эмульсия, образовавшаяся в реакторе, поступает в сепаратор, где происходит разделение фаз. Верхний, органический слой направляют сначала на нейтрализацию, затем на ректификацию для выделения индивидуальных продуктов, а слой отработанной серной кислоты вновь возвращают в реактор.
Для такого гетерогенного процесса рекомендуют применять 10—75%-ную серную кислоту. Выбор необходимой концентрации серной кислоты зависит от температуры реакции. Так, для того чтобы обеспечить достаточную скорость реакции при 50—60 °С, необходима 60—70%-ная серная кислота. В одном из патентов предлагают проводить процесс с использованием 44%-ной серной кислоты.
В первоначальном варианте гетерогенного метода разложения разбавленная (10%-ная) серная кислота и гидроперекись энергично смешивались в реакторе. Затем после отстаивания и разделения органический и водный слои подвергали раздельной обработке для выделения целевых продуктов. Недостатки этого метода: влияние эффективности перемешивания на скорость реакции, корродирующее действие разбавленной серной кислоты, сложность системы выделения целевых продуктов, вызванная тем, что фенол и ацетон растворимы в органических и неорганических фазах. Серьезным недостатком является также необходимость удаления большого количества сточных вод, содержащих фенол. Гетерогенный процесс кислотного разложения гидроперекиси изопропилбензола, по имеющимся сведениям, был реализован в промышленности только на первом зарубежном заводе по производству фенола и ацетона, введенном в действие в Монреале (Канада) в 1953 г.
В дальнейшем все большее применение стал находить гомогенный процесс кислотного разложения, заключающийся в том, что кислота применяется в таких небольших количествах, которые полностью растворимы в реакционной смеси и не образуют второго слоя.
Так, в кратком описании завода по производству фенола и ацетона в Пон-де-Кле (Франция) указывается, что гидроперекись выделяется в концентрированном виде путем вакуум-ректификации продуктов, полученных в результате окисления изо-протшлбензола. Здесь же сообщается, что при современном состоянии техники такой метод концентрирования гидроперекиси не вызывает затруднений. Разложению на фенол и ацетон подвергается уже концентрированная гидроперекись. В сообщении о пуске в начале 1960 г. завода по получению фенола и ацетона в Гренжмаутсе (Англия) говорится, что концентрированная гидроперекись разлагается на фенол и ацетон в присутствии серной кислоты. Процесс разложения протекает настолько быстро, что в любой момент количество гидроперекиси в реакторе незначительно.
Для осуществления реакции разложения в гомогенной среде было разработано несколько методов, согласно которым один из основных продуктов реакции возвращают в аппарат на разложение в количестве, достаточном для гомогенизации реакционной массы.
Применение фенола в качестве гомогенизатора было осуществлено рядом французских производителей. В данных процессах в реакторе создается пленка из фенола. Для этого гидроперекись изопропилбензола, серную кислоту, а также дополнительное количество фенола подают в реактор непрерывно.
Концентрация кислоты составляет 30—75%, а количество ее — около 1—5% от веса гидроперекиси. Реакцию можно проводить при 50 °С и скорость подачи сырья регулировать таким образом, чтобы содержание гидроперекиси изопропилбензола в смеси не превышало 0,5%.
Реакционная смесь непрерывно поступает во второй реактор, в котором также поддерживается температура 50 °С и где реакция заканчивается. Смесь, выходящая из этого реактора, содержит менее 0,1% гидроперекиси и подается в третий реактор, в котором кислоту нейтрализуют каустиком до щелочной реакции по метилроту. Нейтрализованная смесь отстаивается от небольшого водного слоя, содержащего главным образом сульфат натрия. Органический слой перегоняют в трех колоннах. В первой из них, работающей при атмосферном давлении, в виде дистиллята отгоняется ацетон, во второй — α-метилстирол и в третьей — фенол путем перегонки в вакууме. Выход фенола составляет 94—96%, ацетона — 95% в пересчете на гидроперекись изопропилбензола.
Метод использования ацетона в качестве гомогенизатора был разработан фирмами «Hercules Powder Company» (США) и «Distillers Company Limited» (Англия). Этот метод применяется в промышленности. Разложение гидроперекиси проводят в гомогенной среде, состоящей из ацетона и концентрированной (95—96%-ной) серной кислоты, которая вводится в виде 1%-ного раствора в ацетон. Реакционная среда не должна содержать больших количеств воды, так как при этом происходит расслаивание. Желательно, чтобы воды было менее 2%, а для достижения оптимальных результатов вода должна полностью отсутствовать.
Гидроперекись изопропилбензола может быть применена как концентрированная, так и в виде сырой реакционной смеси, полученной окислением изопропилбензола. Преимущественно используют концентрированную (75—88%-ную) гидроперекись. Хотя количество серной кислоты можно изменять в широких пределах, оптимальной является добавка 0,8 вес. % Н2PО4 (считая на серный ангидрид).
Регулирование температуры осуществляется путем дефлегмации ацетона. Гидроперекись изопропилбензола и дополнительное количество ацетона вводят в реактор, в котором находится смесь, гомогенизированная ацетоном. В патенте приводится пример непрерывного разложения гидроперекиси изопропилбензола в ацетоне. Реакционный сосуд, в котором осуществлялось разложение, был снабжен термометром, механической мешалкой, холодильником и штуцерами для ввода гидроперекиси, раствора серной кислоты в ацетоне и для вывода разложенной реакционной смеси. Штуцер для вывода смеси находился сбоку, на высоте, равной одной трети общей высоты реактора. До начала опыта реактор заполняли раствором, состоявшим из ацетона и 1 вес. % -(в пересчете на ацетон) концентрированной серной кислоты. Затем вводили до уровня слива из реактора гидроперекись изопропилбензола. С этого момента из сосуда вытекала реакционная смесь, а из холодильника возвращался -ацетон, который смешивался с добавляемой в количестве 1 % (из расчета на вводимую гидроперекись) серной кислотой и поступал обратно в реактор. Полученная смесь отбиралась в том же объеме, в каком вводилась гидроперекись. Таким образом было разложено 3516 вес. частей 80,5%-ной гидроперекиси изопропилбензола. В минуту подавалось 17,2 вес. части гидроперекиси. Температура смеси в реакторе составляла 90 °С, а время контактирования — 29 мин. Вытекающий из реактора продукт содержал 0,5% гидроперекиси. При разгонке реакционной смеси было получено 1510 вес. частей твердого фенола, что соответствовало выходу 86% от теоретического.
Фирма «Bergwerkgeselschaft Hibernia AG» рекомендует проводить процесс разложения гидроперекиси изопропилбензола в центробежном насосе с использованием в качестве теплоносителя серной кислоты при температуре около 30°С, причем отношение объема раствора гидроперекиси к кислоте составляет 1 : 14—20. Благодаря высокой степени перемешивания реакционной смеси в насосе гидроперекись полностью разлагается, хотя смесь остается в насосе только короткое время. Размешивание можно интенсифицировать применением ультразвука, благодаря которому повышается также скорость реакции. В патенте указывается, что при таком способе разложения не образуется побочных продуктов. Серная кислота, используемая в процессе, одновременно служит для поддержания температуры реакции в пределах 28—38°С. Продукты разложения гидроперекиси отличаются высокой степенью чистоты, что является важным условием для их выделения в чистом виде. Ниже приводится описание схемы предлагаемого патентом процесса (рис. 3).
Сборник 9 заполняют смесью, состоящей из 50% серной кислоты и 50% ацетона; смесь готовят прибавлением ацетона к серной кислоте до тех пор, пока плотность смеси не станет равной 1,325 г/см3 при 15°С. Температура смеси, прокачиваемой через систему, поддерживается в пределах 20 °С при помощи холодильной установки 1. Гидроперекись изопропилбензола из сборника 3 подают через холодильник 2 в реактор, представляющий собой центробежный насос 5, в котором смесь дополнительно может быть перемешана путем применения ультразвука. Насос имеет емкость около 5 л и вращается со скоростью 1400 об/мин. За 1 ч через насос проходит 30 м3 реакционной жидкости. Рекомендуемое объемное соотношение серной кислоты и гидроперекиси 14: 1. Смесь из насоса 5 поступает в холодильник 4, где отводится тепло реакции. Охлажденная смесь поступает в сосуд 6, снабженный мешалкой и охлаждающим устройством. После дополнительного перемешивания и охлаждения в сосуде 6 смесь направляют в первый разделитель 7, откуда отделившаяся серная кислота стекает через холодильник 8 в сборник 9. Углеводородный слой из сосуда 7 поступает во второй разделитель 10 для окончательного отделения остатков серной кислоты. Свободный от кислоты углеводородный слой подают из сосуда 10 в нейтрализатор 11, а оттуда — на ректификацию для выделения целевых продуктов. Указывают, что по этому методу получают с высокими выходами очень чистые фенолы и кетоны. В качестве иллюстрации приводится следующий пример. Был взят продукт окисления, содержащий 41% гидроперекиси изопропилбензола. При количественном разложении в реакционной смесидолжно было бы содержаться 23,8% фенола и 15,7 % ацетона. Фактически смесь состояла из 23,8 % фенола и 15,2 %, т. е. выход фенола составил 94% и ацетона 97% от теоретического (считая на гидроперекись бензоила).
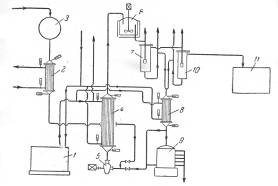
Рис. 3. Принципиальная схема процесса кислотного разложения гидроперекиси изопропилбензола с центробежным насосом в качестве реактора:
1—холодильная установка; 2, 4, 8—холодильники; 3—сборник концентрированной гидроперекиси; 5— центробежный насос-реактор; 6—аппарат с мешалкой; 7, 10— разделительные сосуды; 9—сборник смеси серной кислоты и ацетона; 11—нейтрализатор.
С целью уменьшения количества побочных продуктов, образующихся при совместном получении фенола и ацетона, появились предложения о проведении кислотного разложения гидроперекиси изопропилбензола в присутствии перекиси водорода. Сущность этих предложений заключается в том, что присутствующий в качестве примеси в технической гидроперекиси диметилфенилкарбинол образует с перекисью водорода гидроперекись, которая вместе с основным количеством гидроперекиси разлагается на фенол и ацетон. Возможность такого превращения диметилфенилкарбинола в фенол и ацетон впервые была показана Карашем с сотр. в 1950 г.
Росс и Хуттель показали, что диметилфенилкарбинол, содержащийся в технической гидроперекиси изопропилбензола, путем обработки последней перекисью водорода в присутствии серной кислоты при низкой температуре (5—10 °С) можно превратить в гидроперекись. Однако при таком способе разложения технической гидроперекиси изопропилбензола возможно образование димерной перекиси ацетона, являющейся сильным взрывчатым веществом. Кроме того, вследствие сравнительно больших расходов относительно дорогой (по сравнению с дешевым фенолом, получаемым по кумольному методу) перекиси водорода указанный способ вряд ли может представлять промышленный интерес.
4.3 Установление технологических и конструкционных параметров ХТС, технологических параметров режима и потоков
Реакция кислотного разложения гидроперекиси изопропилбензола на фенол и ацетон очень экзотермична: средний тепловой эффект процесса составляет ~ 308×103 кДж/кмоль ( ~ 74 ккал/моль) или 2080 кДж/кг гидроперекиси ( ~ 486 ккал/кг гидроперекиси). Энергия активации, найденная для технической гидроперекиси, E = 75420 кДж/моль (18 000 кал/моль).
Скорость реакции разложения сильно меняется в зависимости от количества и концентрации кислоты. В случае применения 10%-ного раствора серной кислоты для полного разложения гидроперекиси требуется около 1 ч, тогда как в присутствии 1%-ного раствора кислоты — 5 ч, а при применении 94—96%-ной серной кислоты в количестве 0,1% от веса гидроперекиси — менее одной минуты.
Сообщают, что при подаче газообразного сернистого ангидрида в сосуд, содержащий несколько граммов чистой гидроперекиси изопропилбензола, происходил взрыв. Даже при очень низких температурах сернистый ангидрид все еще сохраняет свою активность. При добавлении гидроперекиси по каплям к жидкому SО3 при —55 °С через некоторое время происходил сильный взрыв вследствие недостаточного отвода тепла из реакционной массы.
Кинетика реакции кислотного разложения гидроперекиси изопропилбензола была исследована П. Г. Сергеевым, М. С. Немцовым и Б. Д. Кружаловым, которые установили, что скорость реакции находится в сложной зависимости от концентрации кислоты три ее значениях меньше 0,01%. При Концентрациях кислоты выше 0,01% константа скорости пропорциональна содержанию кислоты. Скорость реакции разложения увеличивается также с ростом температуры.
При кислотном разложении гидроперекиси изопропилбензола очень важно поддерживать определенный температурный режим, так как при увеличении температуры выше определенного предела выход фенола и ацетона снижается. Существенным является также протекание вторичных реакций при кислотном разложении гидроперекиси. Очевидно, что для понижения выхода побочных продуктов необходимо снижать концентрации фенола и диметилфенилкарбинола в смеси, а также уменьшать время их пребывания в присутствии серной кислоты в реакционной зоне.
Перечисленные особенности кислотного разложения гидроперекиси и определяют технологическое оформление этого процесса.
Разложение проводят при низких начальных концентрациях гидроперекиси в реакционной смеси таким образом, чтобы обеспечивался полный распад гидроперекиси за один проход. При высоких концентрациях гидроперекиси незначительное колебание режима может вызвать неконтролируемое спонтанное разложение ее с выделением такого количества тепла, которое нельзя отвести в системе охлаждения реактора; это может привести к взрыву вследствие мгновенного испарения реакционной смеси. При неполном разложении за один проход гидроперекись будет распадаться на следующих стадиях процесса, что вызывает ее потери за счет термического распада и нежелательно по соображениям техники безопасности. Высокая экзотермичность реакции обусловливает необходимость создания эффективной системы отвода тепла.
Практически процесс можно осуществлять как в адиабатических, так и изотермических условиях. Оформление процесса в адиабатическом реакторе сводится к следующему. По реакционной системе, состоящей из реактора и холодильника, циркулирует какой-либо разбавитель, к которому перед входом в аппарат добавляют серную кислоту и гидроперекись изопропилбензола. За счет тепла реакции смесь нагревается от начальной температуры t1 до заданной предельной температуры t2. Очевидно, что степень тепловыделения и нагрева реакционной смеси определяется количеством гидроперекиси, вводимой на единицу веса жидкости, циркулирующей в системе.
Смесь из реактора поступает в холодильник, где охлаждается до начальной температуры t2 после чего часть ее, соответствующая количеству гидроперекиси, поданной на разложение, выводится из системы, а оставшаяся часть возвращается на циркуляцию. Как уже говорилось, в качестве реакционной среды может быть использована либо разбавленная серная кислота, легко отстаивающаяся от продуктов разложения гидроперекиси и возвращаемая в производственный цикл, либо собственно смесь продуктов разложения гидроперекиси.
4.4 Модели рассматриваемой ХТС
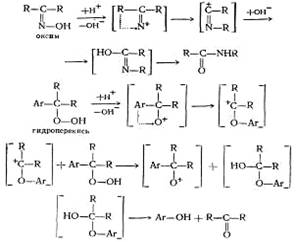
Химическая схема
Кислотное разложение гидроперекиси изопропилбензола протекает по следующей схеме:
4.5 Функциональная модель ХТС
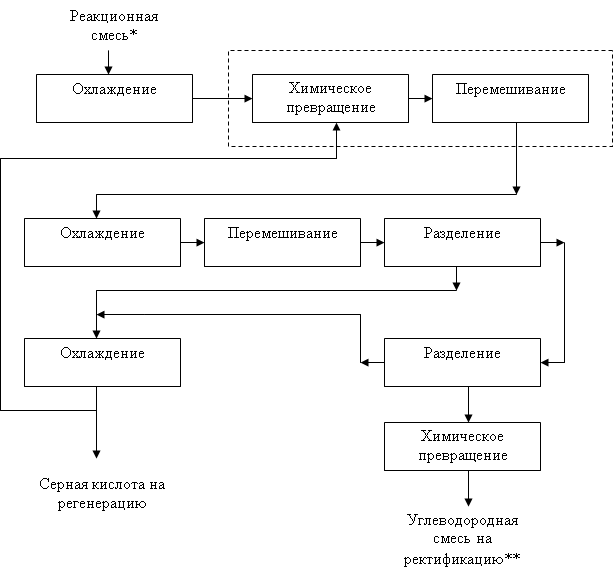
* - Гидроперекись и серная кислота в соотношении 1 : 14.
** - Фенол и ацетон.
4.6 Структурная модель ХТС
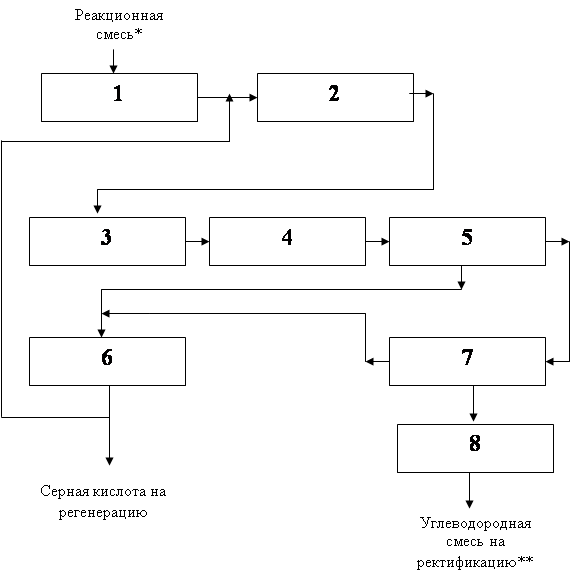
1. Холодильник
2. Центробежный насос
3. Холодильник
4. Аппарат с мешалкой
5. Разделитель
6. Холодильник
7. Разделитель
8. Нейтрализатор.
4.8 Технологическая модель ХТС
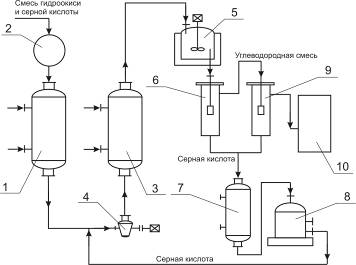
1, 3, 7 — холодильники; 2 — сборник концентрированной гидроперекиси; 4 — центробежный насос-реактор; 5 — аппарат с мешалкой; 6, 9 — разделительные сосуды; 8 — сборник смеси серной кислоты и ацетона; 10 — нейтрализатор.
Описание технологической схемы.
Гидроперекись изопропилбензола из сборника 2 подают через холодильник 1 в реактор, представляющий собой центробежный насос 4, в котором смесь дополнительно перемешивается путем применения ультразвука. Смесь из насоса 4 поступает в холодильник 3, где отводится тепло реакции. Охлажденная смесь поступает в сосуд 5, снабженный мешалкой и охлаждающим устройством. После дополнительного перемешивания и охлаждения в сосуде 5 смесь направляют в первый разделитель 6, откуда отделившаяся серная кислота стекает через холодильник 7 в сборник 8. Углеводородный слой из сосуда 6 поступает во второй разделитель 9 для окончательного отделения остатков серной кислоты. Свободный от кислоты углеводородный слой подают из сосуда 9 в нейтрализатор 10, а оттуда — на ректификацию для выделения целевых продуктов.
5. Анализ ХТС
Реакционная масса, полученная в результате разложения гидроперекиси изопропилбензола, представляет собой довольно сложную смесь. Кроме фенола и ацетона, она содержит диметилфенилкарбинол, ацетофенон, α-метилстирол, окись мезитила, ацетальдегид, изопропилбензол, кислотные катализаторы, примеси органических кислот и следы других примесей.
Первой стадией процесса выделения фенола и ацетона из этой смеси является нейтрализация кислот более сильных, чем фенол. Методы дальнейшей очистки бывают различными и зависят от того, проводилось ли разложение гидроперекиси в гетерогенной или гомогенной среде. Шервуд указывает, что при гомогенном разложении во время последующей нейтрализации образуется небольшой водный слой, в котором содержание фенола и ацетона сравнительно невелико. В процессе нейтрализации, особенно -при гомогенном процессе, осаждается сульфат натрия, что вызывает небходимость фильтрации смеси.
Процесс обработки реакционной смеси, полученной при гетерогенном разложении гидроперекиси изопропилбензола, был разработан фирмой «Distillers Company Limited». Первая стадия этого процесса состоит в отгонке ацетона. Кубовый остаток из отгонной колонны экстрагируют водой при 75—90°С (весовое соотношение вода : сырой продукт составляет около 6). Эта экстракция обеспечивает выделение основной массы фенола и около 0,25 части ацетофенона. Изопропилбензол в рафинате освобождается от ацетофенона перегонкой, а от α-метилстирола — гидрированием в мягких условиях. После такой очистки изопропилбензол можно снова направлять на окисление.
Водный слой экстрагируют бутилацетатом, в результате чего извлекают 99% содержащегося в нем фенола; ацетофенон остается в водном растворе. Некоторое количество бутилацета-та регенерируют перегонкой из водной среды, в которой его концентрация составляет 0,5%. Содержание фенола в бутилацетатном слое составляет около 40%. Растворитель регенерируют перегонкой, после чего остаются фенол и ацетофенон, последний в количестве примерно 1,5%. В процессе окончательного фракционирования фенол получается в технически чистом виде и практически не содержит ацетофенона. Степень выделения фенола, образующегося при разложении, составляет около 95%.
Для выделения целевых продуктов, получаемых в процессе разложения, гомогенизируемого ацетоном, попользуют многоступенчатую перегонку. Вначале отбирается в качестве дистиллята ацетон; изопропилбензол и α-метилстирол выделяются во второй колонне, где выгодно применять отгонку паром из щелочного раствора. Кубовый остаток из второй колонны подвергают фракционированию и фенол, собранный в виде дистиллята, кристаллизуют для получения кондиционного продукта. Кубовый остаток фенольной колонны состоит в основном из ацетофенона, который можно выделить и очистить.
Указывают, что в процессах такого типа соль, растворяющаяся в органическом слое во время нейтрализации, выкристаллизовывается в отгонных колоннах и коммуникациях, что вызывает серьезные затруднения при эксплуатации. Однако этого можно избежать, смешивая перед нейтрализацией продукт разложения с равным объемом воды. Нейтральная смесь отстаивается, водный слой перегоняют для отделения в виде дистиллята фракции, состоящей главным образом из воды и некоторого количества фенола и ацетона. Эта фракция возвращается на промывку. Углеводородный слой фракционируют для выделения ацетона и фенола в соответствии с приведенной ниже схемой технологического процесса (рис. 4).
Наиболее широкое распространение получил способ гомогенного разложения гидроперекиси с применением малых количеств серной кислоты. В этом случае процесс разделения реакционной смеси проводят следующим образом (рис. 5).
Разложенная гидроперекись после нейтрализации щелочью подается насосом 2 из сборника 1 на ректификацию в колонну 3 для отгонки ацетона-сырца. Для снижения температуры в кубе колонны смесь перед ректификацией в ряде случаев разбавляют водой. Ацетон-сырец поступает на ректификацию в колонну 10, в которую подают также водный раствор щелочи для осмоления альдегидов. Товарный ацетон собирают в емкость 12. Удаление альдегидов при получении товарного ацетона возможно и путем ректификации ацетона-сырца в несколько стадий.

Рис. 4. Принципиальная схема процесса выделения фенола и ацетона, разработанная фирмой «Distillers Company Limited».
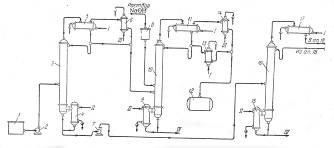
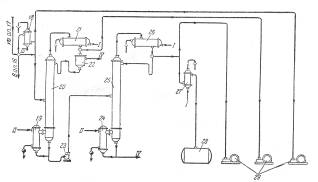
Рис. 5. Принципиальная схема процесса разделения продуктов разложения кислотного гидроперекиси изопропилбензола
1—сборник разложенной гидроперекиси; 5, 7, 23—центробежные насосы; 3—ректификационная колонна для отгонки ацетона-сырца; 4, 9, 15, 19, 24—кипятильники; 5, 11, 17, 21, 26—дефлегматоры; 6, 14, 18—конденсаторы; 8—мерник раствора едкого натра; 10—ректификационная колонна для выделения товарного ацетона; 12—сборник товарного ацетона; 13, 27—холодильники; 16—ректификационная колонна для отгонки фенола-сырца; 20—ректификационная колонна для отгонки а метилстирола; 22—разделительный сосуд; 25—ректификационная колота для выделения товарного фенола; 28—сборник товарного фенола; 29—вакуум-насосы. I—вода; II—греющий пар; III—охлаждающий рассол; IV—отходы на переработку.
Кубовый остаток колонны 3, состоящий главным образом из фенола с примесями а-метилстирола, ацетофенона, диметилфенилкарбинола, воды и смолы, подвергают разгонке в колонне 16; здесь отгоняется в вакууме от диметялфанилкарбинола и смолы фенольная фракция. Кубовой остаток направляют на дальнейшую -переработку, а дистиллят, состоящий из фенола, а-метилстирола, ацетофенона и воды, разгоняют в колонне 20. Эта колонна предназначена для отделения а-метилстирола от фенола, и от четкости ее работы во многом зависит качество товарного фенола, поскольку малейшие примеси а-метилстирола снижают температуру застывания фенола, делая его некондиционным. В качестве дистиллята из колонны 20 отбирают, гетероазеотропную смесь: фенол — а-метилстирол—вода. После расслоения смеси в сосуде 22 водный слой возращают на орошение колонны, а органический слой направляют на щелочную экстракцию для выделения фенола через фенолят натрия.
Дальнейшее выделение фенола можно производить двумя методами. По одному из них разгонку в колонне 20 осуществляют таким образом, что вся вода отгоняется с дистиллятом, а свободный от воды кубовый остаток направляется на окончательную ректификацию в колонну 25, где сверху отбирается товарный фенол. Другой метод более сложен, однако обеспечивает получение фенола самого высокого качества. В этом случае в колонне 20 отгоняется часть воды, а другая ее часть остается в кубовой жидкости, которую подвергают разгонке в дополнительной колонне (на схеме не показана), где сверху отбирается незначительное количество азеотропной смеси фенол—вода; кубовый остаток подают на окончательную разгонку в колонну 25.
Для уменьшения потерь продуктов (вследствие выделения смол), а также во избежание термической дегидратации диметилфенилкарбинола с образованием а-метилстирола в кубах колонн ректификацию в колоннах 16,
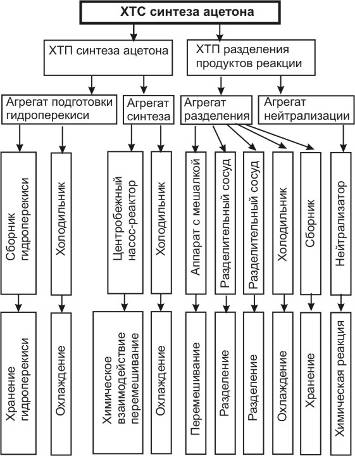
5.1 Иерархическая структура ХТС
5.3 Изучение свойств и эффективности функционирования ХТС
Изопропилбензол (кумол) С6Н5СН(СН3)2, молекулярная масса 120,20; бесцветная жидкость с запахом бензола; Тпл. - 96 °С, т. кип. 152,4°С, 38,2°С/10 мм рт. ст.; d420 0,8618; nD20 1,4915; давление пара (в кПа): 1 (33,22 °С), 20 (99,08 °С), 80 (143,5 °С); h 0,791 мПа×с (20°С), 0,612 мПа×с (40°С); γ 28,2 мН/м (20°С); tкрит 351,4°С, ркрит 3220 кПа; С0р 197 Дж/(моль.К); DH0исп 367 кДж/кг (25 °С), ΔH0обр -41,3 кДж/моль (25 °С); смешивается с этанолом, диэтиловым эфиром, ацетоном, бензолом, хлороформом; р-римость в воде менее 0,01% (20 oC). Изопропилбензол - типичное ароматическое соединение (легко алкилируется, хлорируется, сульфируется, нитруется в ядро). В промышленности изопропилбензол получают каталитическим алкилированием бензола пропиленом; реакция осложняется последовательным введением алкильных радикалов в образовавшийся И. вплоть до получения гексаизопропилбензола. В способе производства изопропилбензол, осуществленном в РФ, катализатором алкилирования служит хлоралюминиевый каталитический комплекс (АlСl3 с НСl и алкилароматическим углеводородом). Процесс осуществляют при 100-130°С (давление определяется т-рой), мольное соотношение бензол : пропилен (с учетом возвращаемых в реакцию полиалкилбензолов) составляет 3:3,5. Полученный изопропилбензол отмывают от катализатора последовательно 17-25%-ным раствором АlСl3, 3-5%-ным раствором NaOH и водой, подвергают ректификации. Расход бензола и пропилена на производство 1 т И. составляет 0,692 и 0,372 т соотв., АlСl3 - 5,5кг. Недостаток метода - необходимость использования коррозионностойкого оборудования. Все большее промышленное использование находит гомофазное алкилирование в присутвии растворимых количеств хлоралюминиевого каталитического комплекса. В этом методе упрощается технологическая схема процесса, возрастает скорость реакции, уменьшается коррозионная активность реакции среды и снижается выход побочных продуктов. За рубежом для производства И. используют фосфорнокислотные катализаторы на твердом носителе - глине, кизельгуре, силикагеле или алюмосиликате. Процесс осуществляют при температуре около 200 °С и давлении 2,8-4,2 МПа. Чтобы предотвратить дезактивацию катализатора, в реакционную зону вводят воду (0,06-0,08% по массе от массы сырья). С целью сокращения образования полиалкилбензолов процесс ведут при мольном соотношении бензол: пропилен, равном 10:1. Выход изопропилбензола 96-97% в расчете на бензол и 91-92% в расчете на пропилен. Применяют изопропилбензол для производства главным образом фенола и ацетона (через кумилгидропероксид) и α-метилстирола, а также как добавку к авиационным бензинам, повышающую октановое число, Твсп. 38 °С, КПВ 0,88-6,5%. При ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки).
Ацетон (от латинского acetum - уксус) (2-пропанон, диметилкетон) СН3СОСН3, мол. м. 58,079; летучая бесцветная жидкость с характерным запахом; Тпл. - 94,6°С, Ткип. 56,1 °С; d420 0,7920, nD20 1,3588; η 0,36 мПа×с (10°С), 0,30 мПа×с (30 С); γ 0,0237 Н/м (20°С); tкрит 235,5°С, pкрит 4,75 МПа; С°р 749,3 Дж/(кмоль×К); ΔH°исп 29,1 кДж/моль (56,1 °С), ΔН°сгор -1787кДж/моль, ΔН°обр - 216,5 кДж/моль (газ; 25°С) и - 248 кДж/моль (жидкость). Смешивается с водой и органическими растворителями, например эфиром, метанолом, этанолом, сложными эфирами. Ацетон обладает всеми химическими свойствами, характерными для алифатических кетонов. Образует кристаллические соединения с гидросульфитами щелочных металлов, напр. с NaHSO3 - (CH3)2C(OH)SO3Na. Только сильные окислители, например щелочной раствор КМnО4 и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее - до СО2 и воды. Каталитически восстанавливается до изопропанола, амальгамами Mg или Zn, а также Zn с СН3СООН - до пинакона (СН3)2С(ОН)С(ОН)(СН3)2. Атомы водорода легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи ацетон превращается в хлороформ, который взаимодействуя с ацетоном с образованием хлорэтона (СН3)2С(ОН)СС13, применяемого как антисептик. Ацетон окисляет вторичные спирты в присутствии алкоголятов А1 до кетонов (реакция Оппенауэра):
![]()
Вступает в альдольную конденсацию с образованием диацетонового спирта (СН3)2С(ОН)СН2СОСН3, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3, форона (СН3)2С=СНСОСН=С(СН3)2 и мезитилена. В присутствии сильной минеральной кислоты ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид-ион с образованием ацетонциангидрина (CH3)2C(OH)CN. При пиролизе (700°С) ацетон образуются кетен СН2=С=О и метан. В промышленсти ацетон получают преимущественно так назеваемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме, рассмотренной подробнее выше:
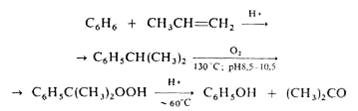
Ацетон - широко применяемый растворитель органических веществ, в первую очередь нитратов и ацетатов целлюлозы; благодаря сравнительно малой токсичности он используется также в пищевой и фармацевтической промышленности; ацетон служит также сырьем для синтеза уксусного ангидрида, кетена, диацетонового спирта, окиси, мезитила, метилизобутилкетона, метилметакрилата, дифенилолпропана, изофорона и многих других соединений. Для ацетон Твсп. -20°С, Тсамовоспл. 500°С; КПВ 2,15-13,00%. Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3.
6. Заключение
В процессе производства применяются токсичные вещества, оказывающие вредное влияние на обслуживающий персонал и окружающую среду. Это исходные компоненты для синтеза – серная кислота и гидроперекись изопропилбензола и основные продукты синтеза – ацетон и фенол.
Серная кислота - чрезвычайно агрессивное вещество. Она поражает дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания, кашель, нередко - ларингит, трахеит, бронхит и так далее. ПДК аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты. 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов хим. и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей. Изопропилбензол - при ингаляции вызывает острые и хронические поражения кроветворных органов (костного мозга, селезенки)
Фенол вызывает нарушение функций нервной системы, дыхания и кровообращения, раздражает слизистые оболочки дыхательных путей и глаз, вызывает ожоги при попадании на кожу. ПДК в атмосферном воздухе 0,003 мг/м3, в воздухе рабочей зоны 0,3 мг/м3, в воде водоемов рыбохозяйственного и хозяйственно-бытового пользования 0,001 мг/л. ЛД50 427 мг/кг (мыши, внутрижелудочно). Ацетон при вдыхании накапливается в организме. Т.к. выводится из организма медленно, возможны хронические отравления. ПДК 200 мг/м3. Для снижения экологической напряжённости производства применяется регенерация серной кислоты, позволяющая снизить отходы производства. В цехах должны быть реализованы эффективные системы приточно-вытяжной вентиляции для обеспечения безопасных условий работы персонала.
Химическая наука и химическая промышленность в настоящее время являются одними из ведущих отраслей, которые обеспечивают научно технический прогресс в обществе. Интенсивный рост данной отрасли требует создания мощной производственной базы в области основных растворителей и крупнотоннажных реагентов.
В данной работе приведён критический анализ разнообразных способов получения ацетона. Выбрана оптимальная технологическая схема. Проведена оценка экологической безопасности производства.
Благодаря тому, что в рассмотренной схеме серная кислота работает в замкнутом цикле, снижается экологическая напряжённость процесса. Таким образом в курсовой работе разработана технологическая модель являющаяся прогрессивной, экономически эффективной и экологически безопасной.
7. Список использованных источников
1. Кутепов А. М., Бондарева Т. И., Беренгартен М. Г. Общая химическая технология. М.: Высшая школа, 1990. 520 с.
2. Общая химическая технология / Под ред. И. П. Мухлёнова М.: Высшая школа, т 1, 2. 1984, 419 с.
3. Расчёты химико-технологических процессов / Под ред. И. П. Мухлёнова, изд М.: Химия. 1982, 245 с.
4. Бесков С. Д. технологические расчёты. М.: Высшая школа,1966, 519 с.