
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Экологическое содержание темы "Основания" в курсе неорганической и органической химии средней школы
Курсовая работа: Экологическое содержание темы "Основания" в курсе неорганической и органической химии средней школы
КУРСОВАЯ РАБОТА
экологическое содержание темы
«Основания» в курсе неорганической и органической химии средней школы
Введение
Актуальность выбранной темы не может вызывать сомнений, так как основания, как неорганические, так и органические, и соединения на их основе применяется самым широким образом. Это и горно-перерабатывающая, и фармацевтическая промышленность, производство красителей, поверхностно-активных веществ, гербицидов, инсектицидов (применение в сельском хозяйстве) и др., применение в органическом синтезе, например, в синтезе ускорителей для каучуков, в качестве ингибиторов коррозии, и прочее.
При разработке данной темы, на наш взгляд, особое внимание следует уделить экологическому аспекту производства, применения и утилизации оснований. Реализацию целей школьного экологического образования можно осуществлять разными путями: это и экологизация учебных дисциплин, и создание интегрированных курсов, и введение в практику обучения специального предмета, раскрывающего вопросы экологии и защиты окружающей среды от загрязнения.
В процессе обучения химии в VII–IX классах важно сосредоточить внимание на проблемах защиты окружающей среды; развитии представлений о взаимосвязи состава, свойств и биологической функции веществ, их двойственной роли в живой природе; биологической взаимозаменяемости химических элементов и последствиях этого процесса дли организмов, причинах нарушения биологических циклов.
На завершающем этапе школьного обучения в X–XI классах создаются предпосылки для понимания таких экологических закономерностей, как цикличность и непрерывность процессов обмена веществ между составляющими компонентами биосферы.
Учитывая соответствующую подготовку учащихся, на любых этапах школьного курса можно разъяснять вопросы, касающиеся состояния окружающей среды: глобальное потепление климата, уменьшение толщины слоя стратосферного озона, кислотные дожди, накопление в почве токсичных металлов и пестицидов, загрязнение больших территорий радионуклидами, истощение природных ресурсов планеты.
Экологические проблемы многоаспектны, поэтому для своего решения они требуют комплексного подхода и, как правило, знаний из различных областей науки. Наиболее подходящей формой организации деятельности учащихся, отмечающей этому требованию, являются учебно-исследовательские экологические проекты [1]. В процессе работы над проектом у учащихся формируется комплекс специфических умений, подкрепленный соответствуй теоретической базой. Немаловажную роль в реализации экологического подхода играет включение в учебный процесс наряду с общеучебными также задач и тестовых заданий с экологическим содержанием.
В нашей работе особое внимание уделено экологическим аспектам промышленного использования неорганических и органических оснований, их токсичности и утилизации. Данный акцент сделан для привлечения внимания учащихся к этой проблеме.
Цель работы:
1. На основе анализа как теоретического материала по основаниям, так и экологических аспектов их использования, сформировать у учащихся экологическое понимание проблемы загрязнения окружающей среды.
2. Сформировать навыки решения и составления тестов, связанных с понятием «предельно допустимая концентрация».
3. Сформировать навыки решения и составления задач, связанных с понятием «предельно допустимая концентрация».
1. Проблема экологизации химического образования в тематическом планировании VIII–XI классов
В процессе обучения химии в VIII–IX классах важно рассматривать проблемы защиты окружающей среды от химического загрязнения. В основу экологизации положены представления о взаимосвязи состава, строения, свойств и биологической функции веществ, их двойственной роли в живой природе; биологической взаимозаменяемости химических элементов и последствиях этого процесса для организмов, причинах нарушения биогеохимических циклов.
Для реализации экологического подхода к изучению школьного курса химии автор [2] анализирует учебную программу по химии VIII–XI классов. Особое внимание обращаются на вопросы, вызывающие серьезную обеспокоенность за состояние окружающей среды: глобальное потепление климата, истощение стратосферного озонового слоя, кислотные дожди, накопление в почве токсичных тяжелых металлов и пестицидов, загрязнение больших территорий радионуклидами, истощение природных ресурсов планеты.
Экологический подход реализуется и через задачи с экологическим содержанием, практические работы, а также при изучении производств и проведении ролевых уроков.
При составлении тематического планирования учитываются вопросы экологического образования следующим образом.
VIII КЛАСС
Введение. Взаимосвязь экологии и химии. Создание экологически безопасных технологий.
Первоначальные химические понятия. Вещества-загрязнители и их источники.
Демонстрационный опыт «Очистка поверхности воды от загрязнителей (масла, нефть)».
Лабораторная работа «Очистка пшена (гречки, риса) от примесей».
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Понятие о биогенных элементах, их положение в периодической системе. Распространенность химических элементов в природе, содержание в живых организмах, степень проявления токсичности, возможность биологической взаимозаменяемости. Изотопы. Проблемы радиоактивного загрязнения природной среды; причины, последствия, возможные пути решения.
Демонстрационный опыт «Роль биогенных элементов в жизни растений:
1) замена в питательной среде магния – важнейшего элемента пигмента хлорофилла – на кальций (имитация процесса биологической взаимозаменяемости элементов);
2) участие углекислого газа в процессе фотосинтеза растений (биогенный элемент углерод) и угнетающее действие соединений свинца – ядов».
Химическая связь. Зависимость биологических функций веществ от их состава, строения, видов связи, типов кристаллических решеток, химических свойств.
Кислород. Масштабы использования кислорода в промышленности, быту, энергетике. Продукты полного и неполного сгорания веществ как загрязнители окружающей среды. Роль зеленых растений в поддержании постоянного состава атмосферного воздуха. Приемы поддержания чистоты воздуха в помещениях.
Водород. Водород как источник экологически чистой тепловой энергии в будущем. Гидриды металлов – источники водородного топлива для автомобилей сегодня.
Кислоты. Соли. Роль кислот и солей в организме человека. Закисление организма – одна из причин быстрого и преждевременного старения. Кислотные дожди: причины, последствия и пути предупреждения. Засоление почвы и воды как фактор ухудшения качества природной среды.
Демонстрационный опыт «Влияние кислотности почв и воды на рост и развитие растений (имитационный опыт)».
Лабораторные опыты: «Определение кислотности образца почвы», «Известкование как способ понижения кислотности среды (взаимодействие карбоната кальция и соляной кислоты)».
Вода. Основания. Растворы. Химический состав природных вод. Основные источники загрязнения водных бассейнов. Водоочистительные станции. Методы, применяемые для очистки воды, и их эффективность. Внедрение бессточных процессов, работающих по замкнутому циклу. Охрана природных вод.
Демонстрационный опыт «Очистка воды от содержащихся в ней солей и примесей».
Лабораторный опыт «Сравнение чистой и загрязненной воды по запаху, цвету, прозрачности, рН, наличию осадка после отстаивания».
Обобщение сведений о важнейших классах неорганических веществ. Неорганические вещества в быту, промышленности, медицине. Экологические требования к качеству производимой продукции.
Техногенные источники веществ – загрязнителей биосферы. Важнейшие природоохранные меры.
IX КЛАСС
Электролитическая диссоциация веществ. Применение электролитов в промышленности, сельском хозяйстве, медицине, быту. Механизм закисления почв, воды. Понятие о буферных системах и их роли в самоочищении водоемов. Ионы, проявляющие токсичность. Окислительно-восстановительные реакции как источники появления токсичных веществ в природной среде.
Подгруппа кислорода. Озон – сильнейший окислитель и токсикант. Сера как элемент, входящий в состав веществ – загрязнителей природной среды. Сероводород и оксиды серы как загрязнители природной среды. Последствия образования сернокислотных дождей (влияние на водоемы, хвойные породы деревьев). Промышленные способы обезвреживания оксидов серы и сероводорода.
Демонстрационный опыт «Моделирование сернокислотных дождей».
Исследование «Влияние диоксида серы на рост и развитие растений».
Подгруппа азота. Применение жидкого азота для утилизации вышедшей из употребления продукции. Аммиак как загрязнитель окружающей среды. Положительное и отрицательное воздействие аммиака и его соединений на живые организмы. Производство аммиака как пример экологически чистой технологии.
Проблемы накопления оксидов азота в атмосфере, их участие в фотохимическом смоге, образовании кислотных дождей. Химические методы очистки газообразных выбросов, содержащих оксиды азота.
Лабораторные опыты: «Обезвреживание оксидов азота методом адсорбции с использованием растворов аммиака и карбоната аммония», «Обнаружение нитратов в овощах, фруктах, продуктах питания».
Подгруппа углерода. Адсорбция как один из методов улавливания отравляющих веществ.
Оксиды углерода – загрязнители атмосферы. Влияние углекислого газа на жизнедеятельность организмов; снижение фотосинтеза у растений и ухудшение дыхания у животных, человека. Отравляющее действие угарного газа. Парниковый эффект: причины возникновения, возможные последствия и пути их предотвращения. Соединения кремния как загрязнители среды обитания живых организмов. Силикоз как следствие повышенной концентрации кремнезема в воздухе.
Демонстрационный опыт «Адсорбция углем различных веществ (красителей, газов)».
Лабораторный опыт «Моделирование действия кислотных дождей на скорлупу яиц птиц».
Общие свойства металлов. Двойственная роль ионов металлов в природе в зависимости от их концентрации.
Коррозия – фактор загрязнения окружающей среды. Влияние продуктов коррозии на обитателей водоемов.
Демонстрационные опыты: «Действие ионов тяжелых металлов на развитие растений», «Действие продуктов коррозии металлов на развитие водных растений».
Металлы I – Ш групп. Кальций, магний – макроэлементы, входящие в состав животных и растительных организмов. Загрязнение среды обитания: замена кальция на стронций в организмах человека и животных.
Влияние алюминия на нервную систему человека. Отрицательное действие алюминия на дыхательную систему рыб.
Железо. Соединения железа. Общетоксическое действие солей двухвалентного железа на организм человека.
Металлургия. Основные природоохранные мероприятия, предусмотренные в доменном производстве.
Внедрение на металлургических предприятиях прогрессивного метода получения стали прямым восстановлением железа из руды – путь к сохранению природной среды. Понятие о безотходном производстве.
В курсе химии IX класса выделяю два урока на проведение урока – ролевой игры «Влияние диоксида серы на животные и растительные организмы» (при изучении подгруппы кислорода) и урока-практикума «Ис-следование сточных вод городских предприятий» (при изучении металлов).
Х КЛАСС
Введение. Проблема загрязнения окружающей среды органическими веществами, не свойственными живой природе. Некоторые пути ее решения.
Предельные углеводороды. Двойственная роль метана в биосфере: источник углерода для метанокисляющих бактерий и загрязнительразрушитель озонового слоя Земли.
Фреоны – загрязнители окружающей среды.
Непредельные углеводороды. Полиэтилен и полипропилен как примеры стойких загрязнителей природной среды.
Ароматические углеводороды. Влияние ядохимикатов на наследственность человека. Биологические способы борьбы с вредителями сельскохозяйственных культур и сорняками.
Природные источники углеводорода. Загрязнение биосферы продуктами сгорания природного газа, нефти, нефтепродуктов, угля. Парниковый эффект: пути решения проблемы.
Демонстрационный опыт «Действие нефти на растения».
Кислородсодержащие органические соединения. Токсичность спиртов. Этанол – социальный токсин. Метанол – топливо будущего.
Причины попадания фенолов в природную среду, их отрицательное действие на живые организмы.
Демонстрационный опыт «Действие фенола на водную экосистему (аквариум)».
Альдегиды. Карбоновые кислоты. Токсичность альдегидов. CMC как загрязнители природной среды. Способы нейтрализации CMC, удаления их с поверхности воды.
Демонстрационные опыты: «Действие CMC на водную экосистему», «Способы очистки воды от CMC».
Жиры. Совершенствование способов утилизации отходов в производстве и переработке жиров.
Углеводы. Целлюлозно-бумажная промышленность и проблемы загрязнения воздуха, водоемов.
XI КЛАСС
Азотсодержащие органические вещества. Понятие о биотехнологии. Отходы биотехнологической промышленности как загрязнители окружающей среды.
Практические занятия: «Действие солей тяжелых металлов на белок», «Действие кислот (минеральных и органических) и щелочей на белок».
СВС. Создание полимеров, способных разрушаться в природной среде под воздействием природных факторов.
ОБЩАЯ ХИМИЯ
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Химический состав организма как отражение химического состава окружающей человека среды. Изменение качества среды обитания – причина экологического кризиса на планете.
Неметаллы. Примеры соединений неметаллов – основных загрязнителей биосферы.
Металлы. Двойственная роль металлов в отношении живой природы. Проблема «металлизации» окружающей среды.
1.1 Программа экологизированного школьного курса химии 8 класс. Тема: «Кислород, оксиды, горение»
Демонстрации: Наблюдение за выделением О2 при фотосинтезе.
Материалы и оборудование: элодея, пробирка, стеклянная воронка, источник света (настольная лампа), 5%-ный раствор гидрокарбоната натрия, стакан на 40 мл, лучинка, спички, пластилин.
В стакан с водой или с раствором гидрокарбоната натрия (для обогащения среды углекислым газом) помещают водное растение, например, элодею, ставят его на яркий свет и собирают выделенный кислород.
Обнаруживается кислород при помощи тлеющей лучинки. Следует учесть, что лучинка вспыхивает, если в газовой смеси содержится не менее 28% кислорода, если же в смеси кислорода меньше 16%, то лучинка гаснет. Опыт закладывается за 5–8 дней до урока.
9 класс. Тема: «Подгруппа кислорода»
Демонстрации: Влияние оксида серы (IV) на растения.
Под стеклянным колпаком помещают два растения, одно из которых уже накрыто колпаком, но меньшего размера. Для получения оксида серы (IV) используют взаимодействие концентрированной серной кислоты с медью. Стакан с концентрированной серной кислотой и погруженной в нее медной проволокой помещают под большой колпак. Через 5 дней можно наблюдать результаты. Растение, развивающееся под маленьким колпаком, развивается нормально, растение же, помещенное только под большим колпаком, угнетается.
Лабораторный опыт «Распознование сульфат-ионов в растворе»
Учащимся предлагают с помощью раствора хлорида бария провести анализ пробы воды, взятой из сточных вод местного предприятия, или заранее приготовленного раствора соответствующего состава на присутствие сульфат-ионов. Для этого исследуемый раствор подкисляют разбавленной соляной кислотой и добавляют к нему по каплям реактив. При наличии сульфат-ионов выпадает белый осадок сульфата бария. По окончании исследования учащимся предлагают с помощью таблицы растворимости найти еще несколько реактивов на сульфат-ионы и самостоятельно провести исследования.
Тема: «Подгруппа азота»
Демонстрация. Обнаружение азота в органических соединениях.
Чтобы выяснить, входит ли в состав вещества азот, пробу нагревают в пробирке с избытком натронной извести (в верхней части пробирки не должно быть приставших частиц извести). В верхнюю часть пробирки помещают кусочек ваты, накрывают увлажненной плоской лакмусовой бумагой. Пробирку нагревают на горелке (над маленьким пламенем) сначала слабо, потом сильнее. Синее окрашивание лакмусовой бумажки указывает на присутствие азота: содержащийся в органических веществах азот связывается при нагревании с натронной известью и затем превращается в аммиак.
Тема: «Подгруппа углерода»
Демонстрация. Исследование консервных банок на примесь свинца.
Место для исследования очищают от жира кусочком ваты, смоченной эфиром. Другой кусочек ваты смачивают 10%-ным раствором уксусной кислоты и накладывают на 3–4 мин на очищенное место. Затем на то же место накладывают кусочек ваты, смоченный 4%-ным раствором иодида калия. Быстрое пожелтение ваты (из-за образовавшегося иодида свинца (II)) указывает на примесь свинца выше нормы, т.е. более 1% (допускается не более 0,004%).
Лабораторный опыт «Воздействие кислот на карбонаты»
Яичную скорлупу помещают в пробирку и капают на нее соляной кислотой. Пробирку закрывают пробкой, в которую вставлена изогнутая в двух местах и оттянутая на конце трубка для отвода газа. Выделяющийся газ пропускают через известковую или баритовую воду.
Выпадение осадка карбоната кальция или бария свидетельствует, что пропускали углекислый газ. Опыт иллюстрирует факт снижения численности птиц в районах выпадения кислотных дождей.
Тема: «Общие свойства металлов»
Демонстрации. Влияние ионов тяжелых металлов на растения.
За две недели до урока «Физические и химические свойства металлов» готовят растворы: полную питательную смесь Прянишникова. В 5 литровых банок помещают по 245 мг NH4NO3, 123 мг MgSO4·7H2O, 160 мг KCl, 25 мг FeCl3 · 6H2O, 172 мг CaHPO4 и 344 мг CaSO4 ·2H2O, ППСП с избытком ионов цинка, ППСП без ионов цинка, ППСП с избытком ионов меди и ППСП без ионов меди. Затем высаживают в эти растворы рассаду и через 2 недели на уроке обсуждают результаты эксперимента (при недостатке цинка наблюдается задержка роста растений, при избытке цинка – пожелтение кончиков листьев, снижение интенсивности фотосинтеза; при недостатке меди – усыхание листьев, гниение корневой системы, при ее избытке – полегание растений), делают вывод о двойственной роли металлов в природе в зависимости от их концентрации.
Тема: «Металлы главных подгрупп I и III групп периодической системы химических элементов Д.И. Менделеева».
Демонстрации. Влияние роли ионов кальция в свертывании крови.
Перед демонстрацией опыта необходимо объяснить учащимся, что сущность процесса свертывания крови состоит в превращении фибриногена в фибрин, для чего необходим фермент тромбин, который образуется в присутствии ионов кальция.
В две пробирки наливают по 3 мл крови, к которой добавлен оксалат натрия для осаждения ионов кальция с целью предотвращения свертывания крови. Одну пробирку оставляют в качестве контрольной, а к другой прибавляют 0,5 мл 2%-го раствора хлорида кальция.
Через 10–15 мин должен образоваться сгусток фибрина, т.е. произойдет свертывание крови. Если же кровь не свернется, значит весь хлорид кальция пошел на образование осадка – оксалата натрия в крови. В этом случае в пробирку приливают еще 0,5 мл раствора хлорида кальция до образования сгустка крови. Сравнивают содержимое этой пробирки с содержимым контрольной пробирки, в которой сгустка крови нет.
Тема: «Железо – представитель элементов побочных подгрупп периодической системы химических элементов Д.И. Менделеева».
Демонстрации. Разложение пероксида водорода каталазой крови.
В цилиндр наливают 10–15 мл 1%-го раствора пероксида водорода и добавляют 1 мл крови. Наблюдают бурное выделение кислорода: жидкость вспенивается и пена заполняет весь цилиндр. Это опыт демонстрирует одну из биологических функций железа. По химической природе, каталаза – геминовый фермент, содержащий железо. [3]
2. Разработка темы «Основания» в курсе неорганической и органической химии
2.1 Урок по теме «Основания»
Цели урока: познакомить учащихся с новым классом химических соединений – основаниями, их свойствами (отношение к воде, действие на индикаторы, взаимодействие с кислотами), практическим использованием оснований в быту и народном хозяйстве; развивать умения работать с химическим оборудованием и реактивами, сравнивать, анализировать, делать выводы; прививать интерес к предмету.
Оборудование и реактивы. На столах учащихся: твердые гидроксиды натрия, кальция, меди, железа (III), вода, соляная кислота, растворы индикаторов (метиловый оранжевый, фенолфталеин, лакмус), пробирки, спиртовка, тигельные щипцы, предметное стекло.
На демонстрационном столе: растворы щелочи (концентрированные), фенолфталеина, соляная кислота, растворы индикаторов в кислоте, щелочи, нейтральной среде, шерстяная ткань, стеклянная палочка, лабораторный штатив, химический стакан.
Ход урока
I. Организационный момент:
¨ проверка готовности
¨ учет посещаемости
II. Изучение нового материала
Учитель: Ребята, вы уже много узнали о веществах, их практическом использовании человеком. Вы знакомы с такими классами неорганических соединений, как оксиды, кислоты и соли. Сегодня мы познакомимся с новым классом неорганических веществ – основаниями.
Что же из себя представляют вещества, называемые основаниями. На столах у вас есть пробирки с основаниями, на пробирках написаны формулы NaOH, Ca(OH)2, Cu(OH)2, Fe(OH)3. Выясните, есть ли какое-либо сходство в составе этих веществ.
Учащиеся отмечают, что во всех веществах присутствует группа ОН.
Учитель: Группу ОН называют гидроксогруппой, она одновалентна.
I
Н – ОН ¬ гидроксогруппа
вода
Учитель: А чем еще схожи основания?
Учащиеся: гидроксогруппы в основаниях связаны с атомами металлов.
Учащиеся записывают определение оснований в тетради.
Вывод: Сложные вещества, состоящие из атома металла и одной или нескольких гидроскогрупп, называют основаниями.
Учащиеся записывают формулу оснований в общем виде:
n
Ме(ОН)n
Затем учащиеся знакомятся с правилами номенклатуры оснований и называют вещества, имеющиеся у них на столах.
Учитель: Опишем физические свойства оснований.
Учащиеся делают вывод, что все основания – твердые вещества. Затем выясняют растворимость оснований в воде.
Лабораторный опыт
К гидроксидам приливают по 3 – 4 мл воды и взбалтывают смесь.
Учащиеся делают вывод, что основания делятся на растворимые и нерастворимые.
Учитель: Сейчас мы введем в наш химический лексикон еще один новый термин. Растворимые основания называются щелочами.
По учебнику учащиеся выясняют, какие основания относятся к щелочам.
Далее учитель знакомит учащихся с правилами обращения со щелочами, проводит демонстрационный опыт (воздействие щелочи на шерсть). Затем рассказывает о применении щелочей (используется таблица).
Таблица 2.1. Применение щелочей
|
NaOH Гидроксид натрия |
Каустик едкий натр каустическая сода |
применяют для производства мыла, в текстильной промышленности |
|
Са(ОН)2 Гидроксид кальция |
гашеная известь известковая вода |
используется в строительстве, для известкования почв, для побелки деревьев |
Учитель: Выясним, изменяют ли растворы щелочей окраску индикаторов.
Лабораторный опыт
Учащиеся разливают раствор гидроксида натрия в 3 пробирки, добавляют индикаторы и отмечают изменение окраски. Проверяют, изменяется ли окраска фенолфталеина в гидроксиде меди (II).
Учащиеся делают вывод: В растворах щелочей индикаторы изменяют окраску, а в нерастворимых основаниях – нет.
Учитель: Ребята, с индикаторами вы встречаетесь не только в химлаборатории, но и дома. Так, в качестве индикатора мы можем воспользоваться заваренным чаем, соками некоторых растений – свеклы, черной смородины.
Для выяснения химических свойств оснований учитель проводит демонстрационный опыт (взаимодействие щелочи с кислотами) и записывает уравнение реакции. О прохождении реакции учащиеся судят по изменению окраски фенолфталеина.
NaOH + HCl = NaCl + H2O
Учащиеся выполняют подобную реакцию, выясняя, реагируют ли нерастворимые основания с кислотами. Проводят химическую реакцию между гидроксидом меди (II) и серной кислотой. Для доказательства образования соли в результате реакции учащиеся выпаривают каплю раствора.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Учащиеся делают вывод: щелочи и нерастворимые в воде основания вступают в реакции с кислотами с образованием соли и воды.
Учитель: Химические реакции между основаниями и кислотами называются реакциями нейтрализации.
III. Закрепление знаний и умений учащихся
В конце урока проводится обобщение того, что нового узнали и чему научились учащиеся на уроке:
¨ научились составлять формулы оснований и давать им названия
¨ познакомились с классификацией оснований
¨ узнали о способности щелочей изменять окраску индикаторов и о взаимодействии оснований с кислотами.
IV. Домашнее задание
Учебник «Химия – 8»/ Ф.Г. Фельдман, Г.Е. Рудзитис/ § 31, стр. 81, 83, упр. 2, задача 1 (стр. 86).
2.2 Амины. Аминокислоты. Азотсодержащие гетероциклические соединения
Амины. Строение аминов. Аминогруппа. Амины как органические основания, взаимодействие с водой и кислотами. Анилин как представитель ароматических аминов. Получение анилина из нитробензола (реакция Н.Н. Зинина), практическое значение анилина.
Аминокислоты. Строение аминокислот. Особенности химических свойств аминокислот, обусловленные сочетанием аминной и карбоксильной групп. Изомерия аминокислот. a-Аминокислоты, их значение в природе и применение. Синтез пептидов, их строение.
Понятие об азотсодержащих гетероциклических соединениях на примере пиридина и пиррола.
Демонстрации. Опыты с метиламином (или другим летучим амином): горение, щелочные свойства раствора, образование солей. Доказательство наличия функциональных групп в растворах аминокислот. Взаимодействие анилина с хлороводородной кислотой и бромной водой. Окраска ткани анилиновым красителем [4].
2.2.1 Амины – органические основания
Задачи урока: сформировать понятие аминов как производных аммиака; научить составлять структурную и электронную формулы метиламина и уравнения химических реакций, доказывающих его основные свойства.
Оборудование: прибор для получения метиламина хлоридметиаммония (соль), едкий натр (концентрированный раствор), вода, фенолфталеин; на столах учащихся – набор для изготовления моделей молекул веществ.
2.2.1.1 Опорный конспект «Амины как органические основания. Токсическое действие»
получение аминов
СН3NО2 + 3Н2 ® 2Н2О + СН3NН2
С2Н5NO2 + 3Н2 ® 2Н2О + С2Н5NН2
С3Н7NO2 + 3Н2 ® 2Н2О + С3Н7NН2 и т.д.
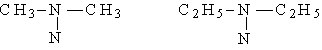 |
СН3NH2, С2Н5NH2
первичные
вторичные
третичные
Изложение нового материала. Учителю известно, что амины генетически связаны с нитросоединениями. Однако у учащихся почти нет знаний об этих соединениях, и поэтому рассматривать генетический переход от углеводородов к аминам через нитросоединения, конечно, не имеет смысла.
Объяснение можно построить на основе имеющихся у учащихся знаний об аммиаке, тем более что они должны были вспомнить их в процессе подготовки домашнего задания. Объяснение строят в форме рассказа, по возможности используя изготовленные учащимися модели молекул и демонстрационный эксперимент [5]. В ходе объяснения необходимо осветить следующие вопросы:
1. Состав и формулы аминов (метиламин, этиламин, диметиламин), их названия.
2. Физические свойства (низшие амины – газы, имеют запах аммиака, хорошо растворяются в воде).
3. Химические свойства (горение, взаимодействие с водой и кислотой).
Заметим, что обсуждение растворимости аминов в воде – это переход к их химическим свойствам, так как в основе растворения лежит химическое взаимодействие с водой. Рассмотрение этого взаимодействия предоставляет возможность по усмотрению учителя рассмотреть такие вопросы, как образование ковалентной связи по донорно-акцепторному механизму, проявление растворами аммиака и аминов основных свойств; сделать вывод о сходстве и различиях их свойств. В связи с тем, что ранее не рассматривался вопрос о взаимном влиянии атомов в молекулах органических веществ, причины различий обсуждать не следует.
С целью закрепления знаний учащимся можно предложить ответить на вопрос и выполнить задания:
1. Составьте формулы изомеров пропиламина СH3 – CH2 – CH2 – NH2.
2. С какими из перечисленных ниже соединений вступает в реакцию этиламин: H2O, NaOH, NaCl, HNO3? Напишите уравнения возможных реакций.
Задание на дом: § 40, выполнить задания 2, 4, повторить строение бензола (§ 17).
2.2.2 Анилин – представитель ароматических аминов, его практическое применение
Задачи урока: на примере анилиза закрепить знания учащихся о химических свойствах аминов; дать представление об ароматических аминах; показать практическую значимость анилина как важнейшего продукта химической промышленности [5].
Оборудование: на демонстрационном столе – анилин, вода, фенолфталеин, соляная кислота, раствор щелочи, пробирки.
Анилин изучается с целью конкретизации общего понятия об аминах и как важнейший представитель этого класса соединений.
В связи с этим урок можно провести в форме рассказа с максимальным привлечением учащихся для обсуждения заданий и вопросов:
1. Назовите гомологические ряды углеводородов и укажите особенности их строения.
2. Какие вещества относятся к аминам?
3. Какова формула ароматического амина?
4. Как доказать, что анилин проявляет основные свойства? Составьте уравнение химической реакции.
Далее внимание учащихся привлекают к реакции взаимодействия анилина с бромом, не останавливаясь на влиянии аминогруппы на бензольное кольцо, а лишь указывая, что особенности строения молекулы анилина обусловливают возможность осуществления этой реакции.
О получении и применении анилина для изготовления красителей, различных фармацевтических препаратов, фотореагентов, взрывчатых веществ, пластических масс и т.д. рассказывает учитель.
На этом уроке, по нашему мнению, целесообразно отметить в рассказе о производстве и применении анилина и токсическое воздействие выбросов как производства, так и побочных продуктов при использовании аминосоединений.
2.2.3 Развернутый план-конспект урока
При изучении данной темы надо закрепить основную идею о развитии органических веществ и причинах, порождающих их многообразие; углубить понятие о ковалентной связи на примерах аминов; расширить знания о водородных связях и амфотерных соединениях [6].
Азотсодержащие органические вещества изучаются методом сравнения, с привлечением ранее изученного материала, что дает возможность для широкого его обобщения.
Приступая к рассмотрению темы, предлагают учащимся вспомнить, какие соединения, содержащие азот, им известны. Учащиеся называют нитробензол, нитроглицерин, тринитроклетчатку. Коротко повторяют сведения о свойствах нитробензола и его получении в лаборатории. При этом составляют на доске уравнение реакции, отмечают ее тип (замещения) и дают название (реакция нитрования). На вопрос, могут ли быть проведены реакции нитрования предельных углеводородов, учащиеся дают утвердительный ответ. После этого записывают уравнения реакций нитрования до пятого гомолога. Учитель отмечает, что впервые эти реакции были проведены русским ученым М.И. Коноваловым в 1886 г. По аналогии с нитробензолом дает названия вновь полученным азотсодержащим веществам – нитрометан, нитроэтан и т.д. Далее коротко учитель знакомит учащихся с физическими свойствами полученных гомологов. Из химических свойств нитросоединений следует подчеркнуть их способность восстанавливаться водородом. Для того, чтобы учащиеся убедились в образовании гомологического ряда новых азотсодержащих веществ и самостоятельно их назвали, составляют уравнения реакций:
СН3NО2 + 3Н2 ® 2Н2О + СН3NН2
С2Н5NO2 + 3Н2 ® 2Н2О + С2Н5NН2
С3Н7NO2 + 3Н2 ® 2Н2О + С3Н7NН2 и т.д.
Обращают внимание на образование новой функциональной группы атомов, – NН2 – аминогруппы. Здесь надо отметить, что аминами их называют по тем радикалам, которые входят в состав молекулы, с прибавлением слова «амин». После этого учащиеся без труда дают названия полученным веществам: метиламин, этиламин и др. Сопоставляя записанные ранее уравнения реакций нитрования с реакциями восстановления, делают вывод о генетической связи между гомологическими рядами органических веществ: углеводороды можно превратить в нитросоединения, а нитросоединения – в амины:
СН4 + НNО3 ® Н2О + СН3NО2;
СН3NО2 + 3Н2 ® 2Н2О + СН3NH2.
Эти соединения являются аминами жирного ряда, так как они получены от предельных углеводородов. Затем описывают физические свойства первых представителей ряда аминов. Прежде чем перейти к изучению их химических свойств, обращают внимание на состав функциональной группы. Аминогруппа – остаток от аммиака, в котором один атом водорода замещен на углеводородный радикал. Далее предлагают рассмотреть амины как производные аммиака. Учащиеся отмечают, что в аммиаке могут быть заменены на углеводородные радикалы и два других атома водорода. Тогда в зависимости от числа остатков углеводородов, входящих в молекулу, амины могут быть
СН3NH2, С2Н5NH2
первичные
вторичные
третичные
В природе амины встречаются при разложении белковых соединений; например, в селедочном рассоле содержится метиламин, диметиламин, три-метиламин. Все амины являются производными от аммиака, поэтому они должны обладать и сходством с ним. Этот вопрос учащиеся могут решать самостоятельно (к этому уроку они должны повторить свойства аммиака). Например, один из учащихся записывает в левой части доски уравнения реакций, характеризующих химические свойства аммиака (взаимодействие с водой, с кислотами, горение в токе кислорода). Здесь же демонстрируют эти опыты, особо подчеркивая способность аммиака гореть только в токе кислорода.
Затем проводят подобные опыты с аминами (см. пп. 1.1.3.1.). На основании опытов делают выводы о свойствах аминов.
В отличие от аммиака амины горят на воздухе. Делают вывод: амины по химическим, свойствам сходны с аммиаком, но в отличие от него горят на воздухе. Это свойство привело ученого Вюрца к открытию аминов в 1848 г. Во время объяснений в правой части доски параллельно со свойствами аммиака записывают уравнения реакций с аминами. В результате сопоставления свойств аммиака и аминов учащиеся убеждаются, что среди органических веществ существуют вещества со свойствами оснований органические основания. Объясняют это, исходя из электронного строения, рассматривая на примере образования иона аммония. Напоминают, что у атома азота из пяти валентных электронов три неспаренных идут на образование ковалентных связей с атомами водорода, образуя молекулу аммиака, а два спаренных электрона остаются необобщенными, свободными. За счет их у атома азота устанавливается ковалентная связь с ионом (протоном) водорода воды или кислоты. При этом в первом случае освобождаются ионы гидроксила, которые определяют свойства оснований, во втором – ионы кислотного остатка. Рассматривают электронное строение аминов:
![]()
![]()
![]()
![]()
|
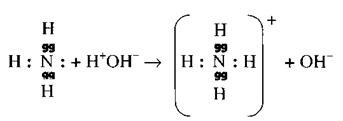
Особое внимание обращают на неподеленную электронную пару азота, которая, так же как и в аммиаке, идет на образование ковалентной связи с протоном водорода. При этом образуется органическое соединение со свойствами оснований (1) или соли (2), если протон (ион) водорода был от кислоты:

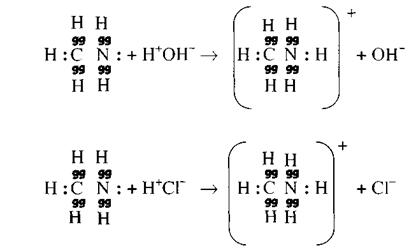
Формула соли может быть записана и по-иному:
СН3. NH2. НС1
Хлористоводородный метиламин
Учащимся известно, что свойства веществ определяются их строением. Сравнивая электронное строение гидрооксида аммония и метиламмония. они могут установить, какие вещества – амины или аммиак – являются более сильными основаниями.
Целесообразно напомнить, что метальный радикал способен оттеснять от себя электронную плотность. Тогда на азоте возникает повышенная электронная плотность и он прочнее будет удерживать протон водорода в молекуле. Ион гидроксила освобождается, концентрация его в растворе увеличивается, поэтому амины жирного ряда и являются более сильными основаниями, чем аммиак. Для закрепления материала учитель предлагает вопрос: усиление или ослабление основных свойств ожидается у диметиламина и триметиламина? Учащиеся знают, что радикал способен оттеснять от себя электронную плотность, поэтому они самостоятельно делают вывод, что двух- и трехзамещенные амины по сравнению с однозамещенными должны быть более сильными основаниями. Два радикала в большей степени увеличат электронную плотность на азоте, и, следовательно, азот сильнее будет удерживать ион водорода, а гидроксильные ионы станут поступать в раствор, т.е. сила основных свойств аминов зависит от величины отрицательного заряда на атоме азота: чем он больше, тем больше сила оснований. Казалось бы, третичный амин должен быть самым сильным основанием, но эксперимент показывает обратное. Видимо, три метальных радикала экранируют неподеленную пару электронов азота, мешают свободному присоединению ионов водорода, а, следовательно, в раствор мало поступает ионов гидроксила, поэтому среда слабоосновная.
Для того чтобы учащиеся лучше усвоили генетическую связь между классами органических веществ, разбирают образование ароматических аминов от «родоначальника» всех ароматических углеводородов – бензола через нитросоединения. Прежде всего, коротко напоминают способы получения аминов жирного ряда от предельных углеводородов, затем предлагают вспомнить свойства изученного ранее бензола и объяснить их, исходя из электронного строения бензола. Для этого желательно вывесить таблицу электронного строения бензола, подготовить модель его молекулы. Таким образом, учащиеся сами «протянут ниточку» от бензола к фениламину через нитробензол и без труда запишут соответствующие уравнения реакций.
Здесь же демонстрируют опыт получения нитробензола в колбе с обратным холодильником. На доске записывают уравнение соответствующей реакции. Затем проводят опыт восстановления полученного нитробензола в анилин. Во время выполнения этого опыта сообщают учащимся о реакции Н.Н. Зинина и ее значении для народного хозяйства.
Затем демонстрируют чистый анилин (если он есть в школе), рассказывая о его токсичности и об осторожном обращении с ним. Демонстрируют некоторые физические свойства: агрегатное состояние, цвет, запах, растворимость в воде.
Затем переходят к изучению химических свойств анилина. По аналогии с аминами жирного ряда предполагают наличие у анилина основных свойств. Для этого в стакан, в котором проверяли растворимость анилина в воде, приливают несколько капель фенолфталеина. Окраска раствора не меняется. Проверяют взаимодействие анилина с концентрированными соляной и серной кислотами. После охлаждения смеси учащиеся наблюдают кристаллизацию солей, следовательно, анилин проявляет свойства оснований, не слабее, чем амины жирного ряда. В ходе обсуждения этих опытов составляют уравнения реакций, дают названия образующимся веществам.
Далее демонстрируют взаимодействие солей анилина со щелочью (проводим аналогию с солями аммония). Здесь попутно ставят вопрос: в виде каких соединений амины жирного ряда находятся в селедочном рассоле, если он взаимодействует со щелочью с образованием аминов? (Как правило, учащиеся отвечают: в виде солей). Проверяют растворимость их в воде и взаимодействие солей анилина с окислителями, например с двухромовокислым калием. Этой реакцией обнаруживают вещества, разнообразные по окраске. Сообщают учащимся, что на свойствах анилина основано производство мно-гочисленных анилиновых красителей (в том числе и такого ценного, как синтетическое индиго), лекарственных веществ, пластических масс. В заключение демонстрируют опыт взаимодействия анилина с хлорной известью. Отмечают, что эта реакция является характерной на анилин. Для проверки предлагают обнаружить анилин в смеси веществ, полученных при постановке опыта восстановления нитробензола металлами. Учащиеся еще раз убеждаются в существовании генетической связи между классами. Для закрепления изученного предлагают составить уравнения реакций, подтверждающие возможность осуществления следующих превращений:
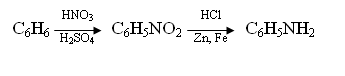
Учащиеся на опыте увидят, что основные свойства анилина по сравнению с аминами предельного ряда ослаблены. Объясняется это влиянием ароматического радикала фенила С6Н5. Для пояснения вновь расссматривваем электронное строение бензола. Учащиеся вспоминают, что подвижное p-электронное облако бензольного ядра образовано шестью электронами (хорошо иметь модель молекулы или хороший рисунок молекулы бензола). Необходимо подчеркнуть, что в бензольном ядре вместо одного атома водорода стоит аминогруппа, нарисовать электронное строение молекулы амина и еще раз обратить внимание на свободную неподеленную пару электронов атома азота в аминогруппе, которая вступает во взаимодействие с p-электронами бензольного кольца. Вследствие этого на азоте электронная плотность уменьшается, свободная пара электронов с меньшей силой удерживает протон водорода и в раствор поступает мало гидроксильных ионов. Все это определяет более слабые основные свойства анилина, что наблюдалось при реакции его с индикаторами.
Неподеленная пара электронов азота аминогруппы, вступая во взаимодействие с p-электронами бензольного ядра, смещает электронную плотность в орто- и пара-положения, делая ядро бензола в этих местах химически более активным. Это легко подтверждается опытом взаимодействия анилина с бромной водой, который тут же показывают:
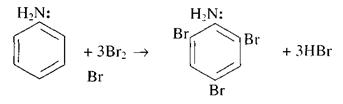
В заключение следует обратить внимание учащихся на существующую в природе связь между веществами, на их развитие от простого к сложному.
2.2.3.1 Демонстрационные опыты и практические работы по теме
Получение аминов из селедочного рассола. В селедочном рассоле содержится значительное количество аминов, преимущественно диметиламина (СН3)2NН и триметиламина (СН3)3N.
1. В большую круглодонную колбу с отводной трубкой наливают 15–20 мл селедочного рассола, добавляют 6–7 мл концентрированного раствора едкого натра и, нагревая колбу на голом пламени, отгоняют амины в пробирку с водой, охлаждаемую снегом или льдом. Через несколько минут образуется раствор, с которым можно проделать следующие опыты, иллюстрирующие основные свойства аминов:
а) К части раствора приливают нейтральный раствор лакмуса или раствор фенолфталеина. Лакмус синеет, фенолфталеин становится малиновым. Делается вывод о том, что продукт соединения аминов с водой (рассматривать можно на примере метиламина) обладает щелочными свойствами подобно раствору аммиака:
NH3 + НОН ® NН4ОН
CH3NH2 + НОН ® СН3NH3ОН
б) К части раствора приливают раствор хлорида железа FеС13. Параллельно ставят опыт взаимодействия хлорида железа с раствором аммиака. Наблюдают образование одинаковых осадков, что подтверждает основные свойства водного раствора амина:
FеС13 + 3NH4ОН ® Fе(ОН)3 + 3NH4С1
FeС13 + 3СН3NH3ОН ® Fе(ОН)3 + 3СН3NН3С1
в) Кипятят в пробирке немного полученного раствора с добавкой щелочи и к выделяющимся парам подносят лучинку, смоченную концентрированной соляной кислотой. Образуется белый дым хлористоводородной соли амина (черный фон!).
г) Предыдущие опыты показывают большое сходство аминов с аммиаком. Для установления отличия их от аммиака и принадлежности к органическим соединениям демонстрируют горючесть аминов. Кипятят раствор амина и поджигают пары его у отверстия пробирки.
Последние два опыта получаются лишь в том случае, если, пользуясь селедочным рассолом, удается получить не слишком слабый раствор аминов.
2. Нагревают в колбе смесь селедочного рассола со щелочью, как было указано выше. К отводной трубке колбы подносят влажную лакмусовую бумажку; бумажка синеет. Подносят стеклянную палочку, смоченную концентрированной НС1, образуется белое облачко хлористоводородных солей аминов. Поджигают пары аминов у отводной трубки, они горят бледным пламенем. Пропускают пары в раствор хлорида железа, образуется осадок гидроокиси железа.
Получение метиламина из хлористоводородной соли и опыты с ним
Предварительно учащиеся знакомятся с запахом метиламина. Для этого в пробирке или на стекле к небольшой щепотке хлористоводородного метиламина они прибавляют 5–7 капель концентрированного раствора щелочи. Отмечают сходство запаха выделяющегося метиламина с запахом аммиака.
Для демонстрации опытов с метиламином в небольшую колбочку с отводной трубкой и капельной воронкой помещают 2–3 г. соли, в капельную воронку наливают концентрированный раствор щелочи. Метиламин получают, прибавляя понемногу из воронки щелочь к взятой соли. С метиламином проделывают следующие опыты:
а) Пропускают выделяющийся газ в воду, подкрашенную фиолетовым или красным лакмусом. Лакмус синеет. Делают заключение о том, что не только по запаху метиламин имеет сходство с аммиаком, но и по химическим свойствам (щелочные свойства водного раствора). Составляется уравнение гидратации метиламина.
б) Получают снова раствор метиламина, пропуская газ в воду (без лакмуса), и проводят реакцию с раствором хлорида железа, как было указано выше (пункт «б»). Подтверждаются щелочные свойства гидроокиси мети-ламмония.
в) К отводной трубке колбы подносят открытую склянку с концентрированной соляной кислотой или палочку, смоченную кислотой. Образуется густое облако дыма хлористоводородной соли (черный фон!). Параллельно ставят опыт с аммиаком. Составляют уравнение реакции солеобразования и, проводя далее аналогию с аммиаком и солями аммония, объясняют реакцию получения амина из соли (см. выше).
г) Чтобы показать отличие метиламина от аммиака, демонстрируют горючесть метиламина, поджигая газ у отводной трубки колбы. Учащиеся знают, что аммиак на воздухе не горит. Для большей убедительности над пламенем горящего метиламина помещают стакан, сполоснутый известковой или баритовой водой. Появление мути на стенках свидетельствует о наличии углерода в горящем веществе (чего нет в аммиаке) и о принадлежности его к органическим соединениям.
Получение метиламина из ацетамида. Для получения метиламина и постановки опытов с ним можно воспользоваться реакцией амида уксусной кислоты с хлорной известью:
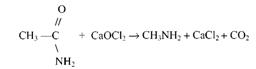
В маленькую колбочку с отводной трубкой помещают около 3 г ацетамида и двойное количество смеси хлорной извести с гидроокисью кальция, замешанной на воде. Вещества перемешивают и нагревают. Выделяется газообразный метиламин. С ним проводят опыты, как указано выше (растворение в воде, окраска лакмуса, горение и т.д.). Уравнение реакции образования метиламина с учащимися не разбирается.
Ацетамид, необходимый для опытов, может быть синтезирован учащимися в химическом кружке.
Получение ацетамида. Ацетамид может быть получен взаимодействием карбоната аммония и уксусной кислоты:
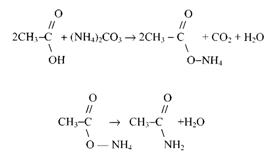
В круглодонную колбу наливают 15 г. уксусной кислоты и прибавляю: небольшими порциями 8 г карбоната аммония (выделение СО2). Колбу закрывают пробкой с вертикальным воздушным холодильником и нагревают около часа до слабого кипения. Затем содержимое переливают в колбу для перегонки, закрывают колбу пробкой с термометром, присоединяют небольшой нисходящий воздушный холодильник и медленно производят перегонку, пока температура не поднимется до 160° С. При этой температуре удаляют холодильник и отводную трубку колбы помещают непосредственно в приемник. Продолжают перегонку до 200° С. Затем меняют приемник и после этого отгоняют ацетамид в интервале температур 200–220° С. Полученный продукт без очистки можно применять для получения метиламина. Ввиду гигроскопичности ацетамид нельзя держать на открытом воздухе.
Анилин
Опыты с анилином должны показать, что это вещество принадлежит к классу аминов, имеет свойства основания и в то же время отличается от алифатических (жирных) аминов по степени проявления основных свойств. Большое внимание также должно быть уделено получению анилина из нитробензола ввиду особого исторического значения этой реакции и ее роли в современной промышленности. Ввиду ядовитости паров анилина опыты следует проводить в вытяжном шкафу.
Отношение анилина к индикаторам. К 100 мл воды в демонстрационном стакане прибавляют 1 мл анилина и взбалтывают смесь стеклянной палочкой. Половину раствора отливают в другой такой же бокал. После этого к одной половине раствора приливают раствор фенолфталеина, к другой – фиолетовый раствор лакмуса. Окраска индикаторов не изменяется.
Взаимодействие анилина с кислотами. После того как показано, что анилин не действует на индикаторы, т.е. не обладает щелочными свойствами, возникает вопрос о том, обладает ли вообще он свойствами оснований, вступает ли он, например, в реакции солеобразования с кислотами.
1. В пробирку с 5 мл воды учащиеся наливают около 0,3 мл анилина. Смесь взбалтывают. Убеждаются, что анилин почти не растворился в воде. Добавляют по каплям концентрированную соляную кислоту. Анилин растворяется. Составляют уравнение реакции образования хлористоводородного анилина.
К раствору соли анилина добавляют по каплям концентрированный раствор щелочи. Снова выделяется анилин в виде маслянистой жидкости. Составляют уравнение реакции.
При проведении опыта следует пользоваться концентрированными растворами кислоты и щелочи с той целью, чтобы не вводить большого количества воды, иначе из-за частичной растворимости анилина (1 г анилина растворяется в 30 мл воды) выделение его будет мало заметно.
2. В демонстрационную пробирку наливают 5 мл анилина и затем примерно такой же объем концентрированной соляной кислоты или 50-процентной серной кислоты. Дают некоторым учащимся убедиться, что проходит экзотермическая реакция. Охлаждают пробирку в струе холодной воды. Выделяются кристаллы соли. Растворяют соль по возможности в небольшом количестве воды (воду добавляют небольшими порциями и пробирку встряхивают). Если остался непрореагировавший анилин, отфильтровывают от него раствор, а к раствору соли добавляют концентрированный раствор щелочи. Выделяется свободный анилин.
Тем или другим из этих опытов устанавливается, что анилин является основанием; отсутствие же действия его на индикаторы говорит о том, что он основание более слабое, чем жирные амины.
Так как по составу молекул жирные амины и анилин отличаются тем, что вместо предельного радикала здесь имеется бензольное ядро, то, очевидно, что ослабление основных свойств аминогруппы обусловлено влиянием ароматического радикала – С6Н5.
Взаимодействие анилина с бромной водой. Как известно, влияние атомов друг на друга в молекуле взаимно. Если бензольное кольцо влияет на аминогруппу в анилине, ослабляя проявление ею свойств основания, то можно ожидать, что и бензольное ядро под влиянием этой группы будет обладать свойствами, отличными от свойств бензола. С подобным изменением свойств ядра учащиеся уже встречались на примере фенола.
Встает вопрос, не ослабляет ли аминогруппа связь атомов водорода с ядром, подобно тому как эту связь ослабляет гидроксильная группа в феноле, и не будет ли анилин реагировать с бромной водой, как реагирует с ней фенол.
1. В колбе или демонстрационной пробирке растворяют при встряхивании в 10 мл воды 1 мл анилина. К полученному раствору (эмульсии) добавляют бромную воду до образования белого осадка.
Осадок представляет собой триброманилин:
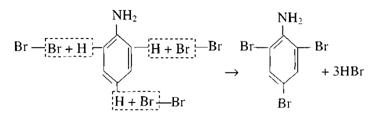
Необходимо, чтобы растворы анилина и брома были достаточно концентрированными. Вместо раствора анилина можно воспользоваться раствором его соли.
Окисление анилина. Анилин сравнительно легко окисляется в разнообразные продукты. При окислении анилина хромовой смесью и некоторыми другими окислителями образуется так называемый черный анилин, применяемый для окраски в черный цвет тканей, дерева кожи.
1. В демонстрационной пробирке к 3–4 мл водной эмульсии анилина приливают 10–12 мл хромовой смеси. Жидкость взбалтывают и подогревают. Вначале она приобретает зеленую окраску, затем синеет, при дальнейшем нагревании образуется осадок черного анилина. Характер осадка выявляется при сильном взбалтывании смеси в пробирке.
2. В 100 мл воды растворяют 2 г бихромата калия К2Сr2О7 и 1 мл концентрированной серной кислоты. К полученному раствору добавляют 2 г солянокислого анилина или по 1 мл анилина и концентрированной соляной кислоты. Смесь перемешивают стеклянной палочкой. В образующийся раствор быстро вносят кусок хлопчатобумажной ткани. Краситель с тканью нагревают, затем ткань достают, отжимают валиком на гладкой поверхности и развешивают на стеклянных палочках.
3. Готовят раствор солянокислого анилина, приливая к 50 мл воды 2 мл анилина и 3 мл концентрированной соляной кислоты. К раствору добавляют еще 1 г хлорида аммония. Полученный раствор наносят кисточкой на гладкую поверхность доски.
После того как раствор впитается, таким же способом покрывают дерево вторым раствором, приготовляемым растворением 4 л бертолетовой соли и 6 г медного купороса в 50 мл воды. Бертолетова соль окисляет анилин, и поверхность доски постепенно принимает черную окраску. Хлористый аммоний и медный купорос способствуют ускорению процесса окисления и получению плотной и прочной окраски. После высыхания поверхности на нее еще несколько раз наносят попеременно первый и второй растворы.
Реакция анилина с хлорной известью. При взаимодействии анилина с хлорной известью даже при очень сильных разбавлениям образуется характерное фиолетовое окрашивание. Хлорная известь поэтому может служить реактивом на анилин.
В цилиндр или стакан наливают 200–300 мл воды, растворяют в ней несколько капель анилина и приливают очень немного свежеприготовленного и профильтрованного водного раствора хлорной извести. Образуется фиолетовое окрашивание (белый фон!). Если раствор анилина взят слишком концентрированный, опыт проходит менее наглядно, так как окраска образуется слишком темная. В таком случае смесь растворов следует разбавить водой. Химизм этой реакции с учащимися не рассматривается.
Получение анилина. Современное производство анилина основано на реакции восстановления нитробензола, открытой Н.Н. Зининым.
В промышленном способе производства для восстановления нитробензола используются соляная кислота и железные или чугунные опилки. Все эти вещества загружаются в реактор; образующийся водород в наиболее активной своей форме – «в момент выделения» – энергично восстанавливает нитробензол в анилин.
В школьных опытах получения анилина для ускорения реакции вместо железа используют обычно олово или цинк. Опыт с железом может быть перенесен на практические занятия или в химический кружок и поставлен там не только для иллюстрации основной химической реакции, но и с целью отражения важнейших производственных операций.
1. В колбочку емкостью 100 мл вносят 2–3 капли нитробензола, приливают 1–2 мл концентрированной соляной кислоты и вносят 2–3 маленьких кусочка цинка (или олова). Если реакция пойдет слишком бурно, колбочку охлаждают в струе холодной воды или в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливают концентрированный раствор щелочи (30–40-процентной) до тех пор, пока образующийся вначале осадок гидроокиси цинка Zn(ОН)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи:
Zn(ОН)2 + 2NаОН ® Na2ZnО2 + 2Н2О
Это будет гарантией того, что щелочь выделит анилин из хлористоводородной соли. Чтобы констатировать образование анилина, присоединяют к колбе холодильную трубку и отгоняют около 0,5–1 мл жидкости. Анилин гошпся вместе с парами воды в виде белой эмульсии. Разбавляют дистиллят водой, чтобы анилин растворился, и открывают его с помощью раствора хлорной извести. Одновременно убеждаются, что нитробензол не дает окрашивания хлорной известью.
Получение анилинформальдегидной смолы. Анилин по ряду свойств напоминает фенол (бромирование, нитрование и т.п.). Подобно фенолу он дает высокомолекулярные смолы с формальдегидом (формалином).
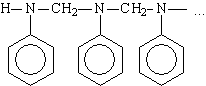 |
В зависимости от соотношения исходных веществ и условий реакции анилинформальдегидные смолы имеют различное строение, например:
Вместо анилина берется насыщенный раствор хлористоводородной его соли, что дает возможность провести реакцию в гомогенной среде и поэтому достаточно быстро.
В небольшой химический стакан наливают 10 мл формалина (40-процентного) и такой же объем заранее приготовленного насыщенного раствора хлористоводородного анилина в воде. В середину стакана тотчас же ставят стеклянную палочку. Образуется густая смола. Палочка прочно удерживается в вертикальном положении. За палочку можно поднять стакан с его содержимым.
Полученная плотная масса имеет резкий удушливый запах от примеси формальдегида.
Продукт обносят по классу или извлекают его из стакана, разламывают на кусочки и на часовых стеклах передают учащимся для ознакомления.
3. Тесты и задачи общеучебного и экологического содержания по теме «Основания»
3.1 Тестовые задания в курсе химии
Системность в использовании любого метода обучения способна обеспечить новое качество учебно-воспитательного процесса. Сказанное в полной мере относится и к использованию тестов на уроках химии [7].
Для качественной подготовки учащихся к итоговому тестированию необходимо использование тестов в системе работы учителя. Ученик, знакомый с этим методом контроля, успешнее выполнит тестовые задания и легче адаптируется в мировом образовательном пространстве, тем более что каждому выпускнику российских школ предстоит сдавать единый государственный экзамен в форме теста.
В отличие от опроса или контрольной работы хорошо подготовленный тест – это и обучающее, и контролирующее средство. Он намного привлекательнее для учащихся, потому что результат не зависит от характера их взаимоотношений с учителем.
Если задание составлено грамотно, то в поисках правильного ответа учащимся приходится думать, сопоставлять один правдоподобный ответ с другим. Таким образом, создается проблемная ситуация, которая активизирует мышление учащихся. Выполняя традиционные упражнения, ученик идет по пути, предложенному учителем, а при выполнении тестовых заданий он сам выбирает путь решения.
При отборе тестовых заданий, прежде всего, необходимо обратить внимание на то, в какой степени данный тест соответствует задачам обучения и воспитания, которые должны быть решены при изучении той или иной темы. По мнению С.Л. Рубинштейна, «собственное воспроизведение материала учащимися целесообразно не приурочивать к моменту, непосредственно следующему за восприятием материала, а дать ему сначала несколько отлежаться. Экспериментальные исследования свидетельствуют о том, что наилучшее воспроизведение имеет место через 2–3 дня после первого восприятия материала».
Для проведения тестирования необходимо приготовить тексты тестовых заданий в нескольких вариантах и инструкцию по проверке теста. Результат тестирования зависит от содержания теста, процедуры проведения тестирования и от готовности учителя и учащихся к тестированию. Нужно обращать большое внимание на процедуру проведения тестирования: соблюдение полной тишины, запрещается задавать вопросы и консультироваться, оборачиваться друг к другу, строго соблюдать регламент.
Лучше всего каждому учащемуся выдать карточку для выполнения заданий с выбором ответа и небольшой лист бумаги для выполнения заданий со свободным ответом.
Образец карточки для учащихся
|
Фамилия |
||||||
|
Вариант |
||||||
|
№ знания |
||||||
|
Код ответа |
||||||
Учащиеся указывают фамилию и номер варианта на карточке и на листке, после этого с помощью лаборанта или дежурного выдаются тексты заданий, и класс начинает работу.
Опыт показывает, что на выполнение закрытых заданий (с выбором ответа) учащиеся затрачивают 4–5 мин и 7–8 мин – на выполнение заданий со свободным ответом. По истечении определенного времени с начала тестирования ученики завершают работу и сдают карточки и листки.
После этого учащиеся приступают к самопроверке по текстам, которые остаются на партах. Таким образом, при проведении тестирования и последующей самопроверки учащиеся включаются в различные виды деятельности: выполнение собственного задания, самопроверка, прослушивание правильных ответов одноклассников, определение уровня собственных знаний и оценивание своей работы. Такой подход к организации тестирования приводит к активизации познавательной деятельности учащихся.
Поскольку тестовый контроль подразумевает специфическую процедуру проведения, к нему должны быть готовы и учитель, и учащиеся. Так, если ранее тестирование не проводилось, необходимо на предыдущем уроке подготовить к нему обучаемых. Практика показала, что пробные решения надо проводить 1–2 раза, впоследствии процедура тестирования не вызывает вопросов и строго соблюдается.
Весьма интересно, на наш взгляд, предложить учащимся самостоятельно составить тесты по теме.
Предлагается образец теста по теме «Амины» (XI класс) [8]. Время выполнения 12 мин. Каждое задание оценивается двумя баллами. За 16 баллов отметка «5», 14 баллов – «4», 10–12 баллов – «3», меньше 10 баллов – «2».
1. Анилин получают при восстановлении:
1) нитробензола; 2) толуола; 3) фениламина; 4) бензойного альдегида.
2.
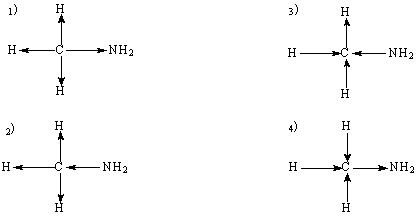 |
Какая схема строения молекулы метиламина объясняет то, что предельные амины более сильные основания, чем аммиак:
3. Водный раствор метиламина имеет реакцию среды:
1) кислую; 2) нейтральную; 3) щелочную; 5) слабокислую.
4. Ароматические амины по сравнению с аммиаком:
1) более слабые основания, так как электронная плотность на атоме азота больше, чем в молекуле аммиака;
2) более слабые основания, так как электронная плотность на атоме азота меньше, чем в молекуле аммиака;
3) более сильные основания, так как электронная плотность на атоме азота больше, чем в молекуле аммиака;
4) более сильные основания, так как электронная плотность на атоме азота меньше, чем в молекуле аммиака.
5. Чем больше атомов водорода в молекуле аммиака замещено предельными радикалами, тем:
1) сила оснований меньше; 2) вещество легче загорается; 3) активнее амин взаимодействует с кислотами; 4) больше растворимость соединения в воде.
6. Сила оснований возрастает в ряду:
1) метиламин ® аммиак ® анилин; 2) аммиак ®диметиламин ® анилин;
3) триметиламин ® анилин ® аммиак; 4) анилин ® аммиак ® метиламин.
7. Реакция между какими веществами характеризует амин как очень слабое органическое основание:
1) Анилин и бромная вода; 2) Анилин и бромоводородная кислота;
3) Хлорид фениламмония и аммиачная вода;
4) Хлорид фениламмония и раствор гидроксида натрия.
8. Укажите гомолог вещества N(CH3)3:
1) пропиламин; 2) диметиламин; 3) фениламин; 4) метилэтиламин.
3.1.1 Тестовые задания с экологическим содержанием
1. Предельно допустимая концентрация (ПДК) анилина – 0,1 мг/л. В цеховом помещении объемом 600 м3 содержится 45,4 г. анилина. Его концентрация:
1) превышает ПДК; 2) соответствует ПДК; 3) меньше ПДК.
2. В лаборатории размерами 3 ´ 5 ´ 10 м произошла утечка 12 мл метиламина (r = 0,699 г./см3, ПДК = 1 мг/м3). Его концентрация в помещении:
1) превышает ПДК; 2) соответствует ПДК; 3) меньше ПДК.
3. В объеме 50028 л (этиленимин, 0,02 мг/м3) содержание вещества массой m не превышает его ПДК:
1) m = 0,025 г.; 2) m = 0,0025 г.; 3) m = 0,001 г.; 4) m = 0,0025 г.
4. Дана смесь метиламина (45 об.%, r = 0,699 г./см3), диметиламина (25 об.%, r = 0,6804 г./см3) и триметиламина (30 об.%, r = 0,662 г./см3). Укажите объем помещения (н.у.), где эта смесь объемом в 0,5 л не будет представлять угрозы. ПДК равны соответственно 1 мг/м3, 1 мг/м3 и 5 мг/м3.
1) 100 м3; 2) 150000 л; 3) 160000 л; 4) 200 м3.
Токсическое действие аминосоединений жирного ряда возрастает с увеличением числа атомов углерода в радикале, хотя возможность ингаляционного отравления уменьшается с падением летучести. Уменьшается также раздражающее действие, объясняемое щелочностью соединений (у первичных аминосоединений она сильнее, чем у вторичных и третичных), но увеличивается всасывание через кожу в связи с увеличением растворимости в жирах. Первичные аминосоединения токсичнее вторичных и третичных. Изомеры, обладающие более длинной цепью атомов углерода, ядовитее. Диамины токсичнее моноаминов. На основе этой информации предлагаем учащимся составить тесты по следующей схеме:
1. Расположите предлагаемые соединения в порядке возрастания их токсического действия: …
Здесь можно провести следующие параллели:
- по возрастанию числа атомов углерода;
- по сравнению токсичности первичных, вторичных и третичных аминов;
- по сравнению токсичности моноаминов и диаминов;
- по сравнению токсичности изомеров с различной длиной углеводородной цепи.
3.2 Задачи по теме «Основания» с экологическим содержанием
1. В помещении V = 54 м3 разлилось 5,0 мл этиламина (r = 0,689 г./см3). Превышает ли его концентрация пдк (18 мг/м3)?
Решение:
Зная объем вещества и его плотность, найдем массу:
m = V. r
m = 5,0. 0,689 = 3,445 г. = 3445 мг
Для сравнения концентрации со значением ПДК этиламина найдем его концентрацию в приведенном помещении:
С = m/V = 3445 мг/ 54 м3 = 63,8 мг/м3.
63,8 / 18 = 3,5 раза
Ответ: Концентрация этиламина в помещении превышает значение его ПДК в 3,5 раза.
2. В результате аварии в цеху, размеры которого составляют 4 ´ 9 ´ 10 м произошла утечка 23 г. 50%-ного раствора триэтиламина (ПДК = 10 мг/м3). Превышает ли концентрация триэтиламина а помещении его ПДК?
Решение:
Найдем объем помещения:
V = 4´9´10 = 36000 м3
Найдем массу триэтиламина, зная его концентрацию:
23 г. ´ 0,5 = 11,5 г триэтиламина
С = m/V = 1150 мг/3600 м3 = 0,32 мг/м3
Ответ: концентрация триэтиламина не превышает значение его ПДК
3. В цеху хранится 8,5 г аллиламина. Каков должен быть объем помещения, чтобы в случае аварии концентрация аллиламина не превысила значение его ПДК (ПДК = 0,5 мг/м3)?
Решение:
Найдем объем помещения из выражения для его концентрации:
С = m/V; V = m/C
V = 8500 / 0,5 = 17000 м3
Ответ: Объем помещения должен быть больше 17000 м3.
4. В лаборатории размерами 28 ´ 20 ´ 3 м было разлито 1,62 мл бутиламина (ПДК = 10 мг/м3, r = 0,7401 г./мл) и 1,2 мл дипропиламина (ПДК = 5 мг/м3, r = 0,7384 г./мл). Составляет ли угрозу здоровью персонала такая ситуация?
Решение:
Найдем массу веществ:
m = r ´ V
для бутиламина m = 0,7401 ´ 1,62 = 1,2 г = 1200 мг
для дипропиламина m = 0,7384 ´ 1,2 = 0,9 г = 900 мг
Найдем объем помещения:
V = 28 ´ 20 ´ 3 = 1680 м3
Концентрация веществ:
С1 = m/V = 1200 / 1680 = 0,71 мг/м3
С2 = m/V = 900 / 1680 = 0,54 мг/м3
Ответ: Данная утечка не представляет особой угрозы здоровью персонала.
По вышеприведенным схемам учащимся предлагается составить задачи.
Задача 5. Самый дешевый щелочной реагент для нейтрализации кислотных промышленных стоков – гашеная известь (гидроксид кальция). Используют как суспензию гидроксида кальция («известковое молоко»), так и прозрачный раствор («известковую воду»). Рассчитайте рН 0,02М раствора Ca(OH)2.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
Ca(OH)2 = Ca2+ + 2 OH-; рН > 7
c {Ca(OH)2} = 0,02 моль/л; pH =?
В соответствии с уравнением реакции равновесная молярная концентрация анионов OH – вдвое больше концентрации гидроксида кальция c {Ca(OH)2}:
[OH-] = 2c {Ca(OH)2}
рН = 14 – pOH = 14 + lg[OH--] = 14 + lg 2c {Ca(OH)2} = 12,6
Ответ. Водородный показатель известковой воды равен 12,6.
Задача 6. Одно из самых дешевых азотных удобрений – аммиачная вода, раствор аммиака. Определите степень диссоциации гидрата аммиака NH3. H2O в 0,002М растворе, если его рН равен 10,3 при 25 oС.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
NH3. H2O <<здесь знак обратимости>> NH4+ + OH-; рН > 7
c(NH3. H2O) = 0,002 моль/л; pH = 10,3
a =?
В соответствии с уравнением реакции равновесная молярная концентрация анионов OH – связана с концентрацией гидрата аммиака и степенью диссоциации:
[OH-] = a. c(NH3. H2O)
рН = 14 – pOH = 14 + lg[OH--] = 14 + lg {a. c(NH3. H2O)}
a = (10 pH - 14): с = 10 10,3 - – 14 / 0,002 = 0,093 = 9,3%
Ответ. Степень диссоциации гидрата аммиака равна 9,3. [9 – 11]
Выводы
Как известно, изложение материала тем доступнее, чем оно ближе к практике. Благодаря тому, что в преподавании темы «Основания», наряду с общеучебными, преследуются и экологические цели, происходит сближение теории и практики. В этом ключе, на наш взгляд, и следует преподавать многие разделы общей, неорганической и органической химии.
На основе материала, рассмотренного и проанализированного в данной курсовой работе, можно сделать следующие выводы:
1. Анализ литературных данных по проблеме преподавания темы «Основания» как с общеучебной, так и с экологической точки зрения позволил выявить наиболее целесообразные приемы преподавания.
2. Предложен блок, освещающий демонстрационные опыты и практические работы по теме «Амины как органические основания».
3. Разработаны варианты тестовых заданий по теме «Основания», имеющие как общеучебное, так и с экологическое направление.
4. В работе приведены варианты задач по теме «Основания» экологического характера, а также предлагается самостоятельное составление задач.
Литература
1. Т.Н. Кровельщикова, А.В. Коршунов. Из опыта реализации экологического подхода к обучению химии / Химия в школе. 2002, №8, с. 40–42.
2. H. В. Егорова. Вопросы Экологического образования при изучении химии / Химия в школе, 2001, №5, с. 46 – 49.
3. Зверев И. Охрана природы и экологическое воспитание школьников. // Воспит. школьников. – 1985. – N6. – с. 30–36.
4. Программы для средних общеобразовательных учебных заведений. Химия. // Под ред. В.И. Сивоглазова. М., «Просвещение», 1993.
5. Обучение химии в 11 классе. В 2 ч. Ч 1: Кн. Для учителя / Под ред. И.Н. Черткова. – М.: просвещение, 1992. – с. 6 – 20.
6. Азотсодержащие органические соединения. // Химия в школе. №6, 1996, с. 18–22.
7. И.Г. Афонина. Тестовые задания в курсе химии. // Химия в школе. №7, 2002, с. 43 – 45.
8. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А.А. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М-во образования РФ. – М.: Просвещение, 2002. – с. 20–35.
9. Безуевская В.А. Химические задачи с экологическим содержанием / Химия в школе, 2000, №2, с. 59 – 61.
10. A.B. Краснянский. Экологические проблемы расчетных задачах по химии / Химия в школе, 1996, №6, с. 22 – 27
11. А.В. Краснянский. Экологические проблемы в расчетных задачах по химии / Химия в школе, 1996, №5, с. 32 – 37.