
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Контрольная работа: Равновесный состав газа в металлургических реакциях
Контрольная работа: Равновесный состав газа в металлургических реакциях
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Магнитогорский государственный технический университет им. Г.И.Носова
Контрольная работа по дисциплине "Физическая химия металлургических процессов"
"Равновесный состав газа в металлургических реакциях"
Магнитогорск, 2010
Задача №1
Для реакции водяного газа
CO + H2O = CO2 + H2
Определить возможное направление реакции и равновесный состав газа при температурах :
t = 700° C
t2 = 800° C
t3 = 900° C
t4 = 1000° C
если исходная газовая смесь содержит 23% СО и 27% H2O, 20% CO2 и 30% H2.
Решение:
Равновесный состав газа в реакции водного газа
CO + H2O = CO2 + H2
Данная реакция имеет место во многих процессах горения топлива, определяя в значительной степени состав газа в доменной печи при взаимодействиях водяного пара с коксом при мокром и сухом тушении.
Равновесие реакции количественно характеризуется константой равновесия:
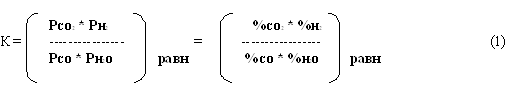
Данная система трехкомпонентная и однофазная, поэтому
C = k – f + n = 3 – 1 + 1 = 3
Значит, равновесный состав газа зависит от трех факторов: температуры Т и 2-х исходных концентраций.
Константа равновесия реакции может быть рассчитана по эмпирическому уравнению:
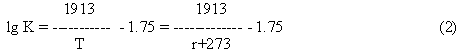
По условию задачи известен исходный состав газа:
23% CO
27% H2O
Значит, в 100 моль исходного газа содержалось такое же количество моль каждого компонента:
ni = %i
Допустим, что при некоторой температуре t° C реакция возможна в прямом направлении и к моменту достижения равновесия прореагирует Х моль СО с Х моль H2O и появилось Х моль H2 и Х моль СО2. Тогда при равновесии количества молей газов ( об.%)
(23-Х) моль СО (27-Х) моль H2O
(20+Х) моль СО2 (30+Х) моль H2
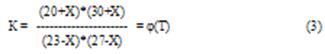
Решая уравнение (3) относительно Х при различных температурах, получаем два значения корня уравнения (3), приведенных в таблице 1.
Таблица 1.
| t° C | Кр | Х1 моль | Х2 моль | % СО | % H2O | % CO2 | % H2. |
| 700 | 1,645 | 3,24 | 202 | 19,8 | 23,7 | 23,2 | 33,2 |
| 800 | 1,080 | 0,67 | 1322 | 22,3 | 26,3 | 20,7 | 30,7 |
| 900 | 0,760 | -1,46 | -365 | 24,5 | 28,5 | 18,5 | 28,5 |
| 1000 | 0,566 | -3,23 | -177 | 26,2 | 30,2 | 16,8 | 26,2 |
Из таблицы следует, что только корень Х1 имеет физический смысл. По знаку этого корня оцениваем возможные направления реакции каждой температуре. Отрицательные значения вызваны протеканием реакции влево. Направление процесса можно определить по известному уравнению изотермы реакции:
∆G = RT (ln Пр – ln Кр) (4)
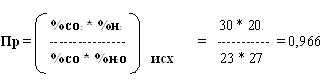
При 700, 800 ° C Кр > Пр ∆G < 0 , прямая реакция
При 900, 1000 ° C Кр < Пр ∆G < 0 , обратная реакция
Температура, при которой исходная смесь находится в равновесии :
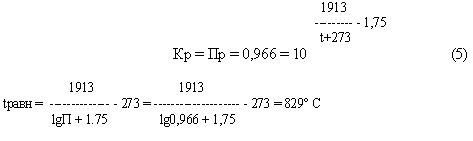
Таблица 1 иллюстрирует влияние температуры на равновесный состав газа. Повышение температуры вызывает увеличение концентрации исходных веществ, т.е. равновесие смещается в обратном направлении. Это характерно для экзотермических реакций. Оценим среднее значение теплового эффекта реакции

Сравнивая это уравнение с уравнением 2, получаем
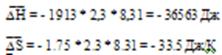
Равновесная температура для исходной смеси может быть найдена и графически:
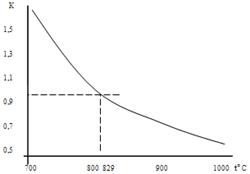
Рисунок 1. К определению равновесной температуры.
Задача №2
Равновесный состав газа в реакции Бела-Будуара
Ств + CO2 = 2СО
Данная реакция имеет место во всех процессах взаимодействия газовой фазы с твердым углеродом в коксохимическом производстве и металлургии. Поскольку система двухкомпонентная и двухфазная, то вариантность:
C = k – f + n = 2 – 2 + 2 = 2
т.е. равновесный состав зависит от 2-х параметров ( Т и Р )
%CO равн = φ (Т,Р)
Преобразуем уравнение №1, получим:
Р * %CO² + Кр * 100%СО - 100² * Кр = 0 (4)
Решение этих уравнений относительно %СО является решением квадратного уравнения. Один из корней этого уравнения положительный, а другой всегда отрицательный и не имеет физического смысла.
Результаты расчетов равновесного состава газа при разных давлениях представлены в таблице №2.
Таблица 2. Равновесный состав газа.
| t° C | Кр | Об. %CO при давлениях (атм.) | ||
| 0,5 | 1,0 | 3,5 | ||
| 402 | 0,0001 | 1,26 | 0,89 | 0,48 |
| 579 | 0,0445 | 27,5 | 19,0 | 10,7 |
| 690 | 0,7152 | 67,8 | 56,1 | 36,1 |
| 829 | 10,53 | 95,7 | 92,0 | 79,2 |
| 936 | 54,74 | 99,1 | 98,2 | 94,3 |
Данные расчета представлены на рисунке №2
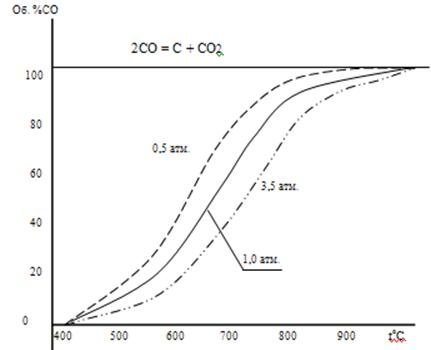
Рисунок 2. Равновесный состав газа при разных давлениях.
Из таблицы 2 и рисунка 2 следует, что повышение температуры вызывает увеличение %СО, т.е. смещение равновесия реакции вправо, что характерно для эндотермических процессов.
∆H = + 8920 * 2,3 * 8,31 = 170 488 Дж,
увеличение давления смещает равновесие влево, т.к. в этом направлении уменьшается число моль газов.
На рисунке 2 изобары %СО = ср(Т) делят поле графика на две части: левую и правую от изобары. В каждой из этих частей равновесие реакции отсутствует и возможно необратимое протекание процесса или реакции вправо (в правой части) и в левой части в обратном направлении.
2СО = Ств + СO2
Задача №3
Рассчитать равновесный состав газа в реакциях восстановления оксидов железа водородом и монооксидом углерода
Уравнения и константы равновесия реакций:
восстановления монооксидом углерода
1. 3Fe2O3 + CO = 2Fe3O4 + CO2 lg K1 = 2726/T + 2,14
2. Fe3O4 + CO = 3FeO + CO2 lg K2 = -1850/T + 2,10
3. FeO + CO = Fe + CO2 lg K3 = 688/T – 0,90
4. ¼ Fe3O4 + CO = ¾ Fe + CO2 lg K4 = 54/T – 0,155
восстановления водородом
1a. 3Fe2O3 + H2 = 2Fe3O4 + H2O lg K1a = 813/T + 3,02
2a. Fe3O4 + H2 = 3FeO + H2O lg K2a = -3736/T + 3,85
3a. FeO + H2= Fe + H2O lg K3a = -1225/T + 0,85
4a. ¼ Fe3O4 + H2= ¾ Fe + H2O lg K4a = -1859/T + 1,59
В любой из приведенных реакций газ – восстановитель В превращается в оксид ВО, поэтому в газовой фазе:
1. %Вравн + %ВОравн = 100 2. Кр = %ВОравн / %Вравн
Решая систему уравнений (1) и (2), получим: %Вравн = 100 / (1 + К)
Значения константы равновесия Кр реакции определяются из эмпирических уравнений, приведенных выше. Результаты расчета приведены в таблицах 3 и 4 и на рис. 3-8.
Таблица 3. Равновесный состав газа в реакциях восстановления оксидов железа монооксидом углерода
| Темпе-ратура |
Константа равновесия Кр |
%COравн в реакции |
||||||
|
t, oC |
K1 |
K2 |
K3 |
K4 |
1 (*103) |
2 | 3 | 4 |
| 300 | 7914000 | 0,07 | 2,0 | 0,87 | 0,05 | 93,1 | 33,4 | 53,5 |
| 400 | 1554000 | 0,22 | 1,33 | 0,84 | 0,1 | 81,7 | 43,0 | 54,3 |
| 500 | 465000 | 0,51 | 0,98 | 0,82 | 0,2 | 66,3 | 50,6 | 55,3 |
| 600 | 183000 | 0,96 | 0,77 | 0,81 | 0,5 | 51,0 | 56,4 | 55,7 |
| 700 | 87630 | 1,58 | 0,64 | 0,80 | 1,1 | 38,8 | 60,9 | 56,0 |
| 800 | 48030 | 2,38 | 0,55 | 0,79 | 2,1 | 29,6 | 64,5 | 56,2 |
| 900 | 29171 | 3,33 | 0,49 | 0,78 | 3,4 | 23,1 | 67,3 | 56,4 |
| 1000 | 19160 | 4,43 | 0,44 | 0,77 | 5,2 | 18,4 | 69,6 | 56,8 |
| 1200 | 9809 | 6,98 | 0,37 | 0,76 | 10,2 | 12,5 | 73,0 | 56,9 |
| 1300 | 7402 | 8,39 | 0,34 | 0,75 | 13,4 | 10,6 | 74,4 | 60,0 |
Таблица 4 Равновесный состав газа в реакциях восстановления оксидов железа водородом
| Темпе-ратура |
Константа равновесия Кр |
%H2равн в реакции |
||||||
|
t, oC |
K1a |
K2a |
K3a |
K4a |
1a (*103) |
2a | 3a | 4a |
| 300 | 203600 | 0.01 | 0,05 | 0,02 | 0,5 | 98,8 | 95,1 | 97,8 |
| 400 | 125300 | 0.02 | 0,11 | 0,07 | 0,8 | 98,2 | 90,3 | 93,7 |
| 500 | 87450 | 0.10 | 0,18 | 0,15 | 1,1 | 91,1 | 84,4 | 86,7 |
| 600 | 66260 | 0,35 | 0,28 | 0,29 | 1,5 | 74,3 | 78,1 | 77,6 |
| 700 | 53160 | 0,96 | 0,39 | 0,48 | 1,9 | 51,0 | 71,9 | 67,7 |
| 800 | 44430 | 2,20 | 0,51 | 0,72 | 2,3 | 31,2 | 66,2 | 58,1 |
| 900 | 38290 | 4,39 | 0,64 | 1,02 | 2,6 | 18,2 | 61,0 | 49,7 |
| 1000 | 33780 | 7,83 | 0,77 | 1.75 | 3,0 | 11,3 | 56,4 | 42,6 |
| 1200 | 26660 | 19,7 | 1,04 | 2,13 | 3,6 | 4,8 | 48,9 | 32,0 |
| 1300 | 18500 | 25,0 | 1,50 | 2,70 | 4,0 | 3,4 | 45,0 | 28,0 |
На основании данных таблицы №3 и №4 построим графики.
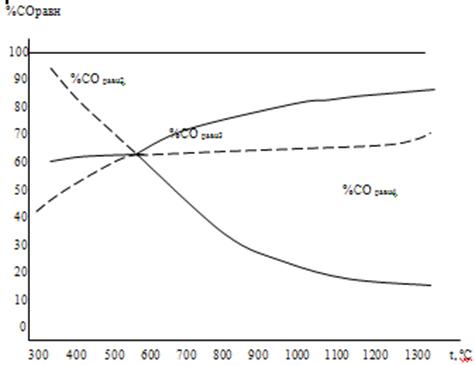
Рисунок 3. Равновесный состав газа в реакциях восстановления оксидов железа монооксидом углерода.
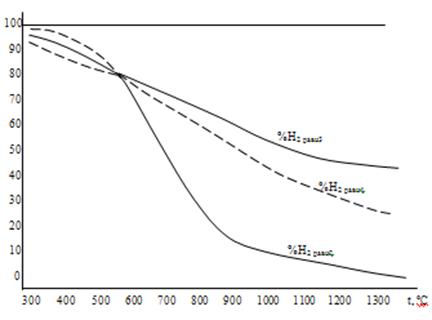
Рисунок 4. Равновесный состав газа в реакциях восстановления оксидов железа водородом.
В энтропийных методах расчета константы равновесия
ln Kp = - ΔH0т / RT + ΔS0т/ R ≈ - ΔH / RT + ΔS/ R ≈ - А / Т + В
где ΔH0т и ΔS0т - тепловой эффект реакции и изменение энтропии при температуре Т;
∆H и ∆S –средние значения теплового эффекта реакции и изменения энтропии в изучаемом интервале температур.
Зависимость равновесного состава газа от температуры в любой из приведенных реакций определяется изменением константы равновесия Кр, т.е. уравнением изобары реакции d(ln Kp) / dT = ΔH0т / RT2 и качественно – по правилу Ле Шателье. В реакциях эндотермических (ΔН > 0) повышение температуры смещает положение равновесия в прямом направлении, т.е. в сторону уменьшения концентрации газа-восстановителя.
Равновесный состав газа в реакциях восстановления оксидов железа водородом и СО приведен на рисунках 3-6. На всех по оси ординат представлен объемный процент газа восстановителя, поэтому поле каждого рисунка, кроме рис.6, ограничено сверху асимптотой %В = 100.
Линии ( % В = φ(t) ) на рис. 3, 4, 5, 6, 7, описывающие равновесие эндотермических реакций - убывающие кривые, а для экзотермических реакций – возрастающие.
По эмпирическим уравнениям зависимости константы равновесия реакции от температуры вида lg Ka = A/T + B можно рассчитать средние значения теплового эффекта реакции ∆H и изменения энтропии ∆S:
∆H = - 2,3 R A , Дж ; ∆S = 2,3 R B, Дж/К
Средние значения теплового эффекта реакции ∆H и изменения энтропии ∆Sв интервале температур 300-1300оС.
Таблица 5.
| Реакция | 1 | 2 | 3 | 4 | 1а | 2а | 3а | 4а |
| ∆Н, кДж | -52,0 | 35,3 | -13,1 | -1,04 | -15,5 | 71,3 | 23,4 | 35,5 |
| ∆S Дж/К | 40,9 | 40,1 | -17,2 | -2,96 | 57,7 | 73,5 | 16,2 | 30,4 |
Реакции 1,3, 4, 1а –экзотермические, а реакции 2, 2а, 3а, 4а – эндотермические.
В реакциях восстановления оксидов железа монооксидом углерода ∆Н3>∆Н4<∆Н2, а водородом ∆Н3а<∆Н4а<∆Н2а, что приводит к соответствующей разнице в темпе кривых на рисунках 3 и 4.
В системе Fe – O известны оксиды FeO, Fe3O4, и Fe2O3, из которых монооксид железа устойчив лишь при температуре выше 570оС. Равновесные составы газа, приведенные в таблицах 3 и 4, в реакциях с участием этого оксида не реализуются, и на рисунках 3 и 4 кривые 2, 3, 2а и 3а выполнены пунктирно при t < 570оС. При температуре выше 570оС не реализуются линии реакций 4 и 4а.
Реакции 1 и 1а восстановления высшего оксида железа отличаются высоким значением константы равновесия (Кр " 1), поэтому протекают необратимо в прямом направлении, и равновесная (остаточная) концентрация газа восстановителя составляет тысячные доли процента (рис. 5). Различный темп кривых на этом рисунке объясняется разницей тепловых эффектов реакций 1 и 1а.
Равновесные кривые на рис. 3, 4, 5 делят поля рисунков на области устойчивости отдельных конденсированных фаз. Выше равновесной кривой фактический процент газа восстановителя больше равновесного, и устойчивой фазой является восстановленная форма оксида железа, а под кривой – окисленная форма. Таким образом, на названных рисунках показаны области устойчивости отдельных фаз.
Восстановление оксидов железа монооксидом углерода. На рис. 3 представлен равновесный состав газа в реакциях восстановления Fe3O4 и FeO газом СО. Номера кривых соответствуют номеру уравнения реакции. Для реакций 2, 3 и 4 кривые сходятся в точке "О" c координатами: 570оС и 61 %СО, и в равновесии с газовой фазой находятся металлическое железо, и оксиды FeO и Fe3O4. В системе из трех компонентов (Fe-C-O) равновесие 4 фаз безвариантно ( С = К – f + 1 = 3-4+1=0), поэтому состав газа и температура фиксированы.
Восстановление оксидов железа водородом. На рис. 4 представлен равновесный состав газа в реакциях восстановления FeO и Fe3O4 водородом. Все кривые имеют убывающий характер вследствие эндотермичности реакций. Различный темп кривых вызван разным тепловым эффектом реакций. Координаты безвариантной точки "O1": 570oC – 80 % H2.
Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода представлено на рис. 5 и 6. Для всех оксидов железа равновесные кривые восстановления водородом и монооксидом углерода пересекаются при температуре 810оС. При этой температуре химическое сродство водорода и СО к кислороду одинаково, поэтому водород и монооксид углерода обладают одинаковой склонностью в реакциях восстановления любых оксидов, в частности, FeO, Fe3O4 и Fe2O3. При температуре ниже 810 оС химическое сродство СО к кислороду больше, чем у водорода, поэтому остаточная концентрация газа восстановителя ниже в реакциях восстановления оксидов железа монооксидом углерода. При температурах, превышающих 810 оС, более сильным восстановителем является водород. Его остаточная концентрация в реакциях 1а, 2а и3а меньше, чем у СО в реакциях 1, 2 и 3 (рис. 5 и 6).
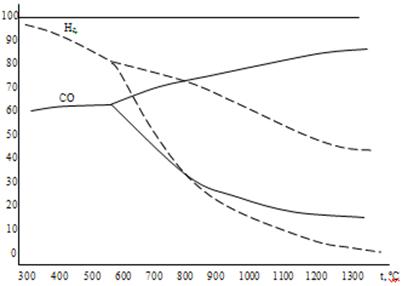
Рисунок 5. Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода.
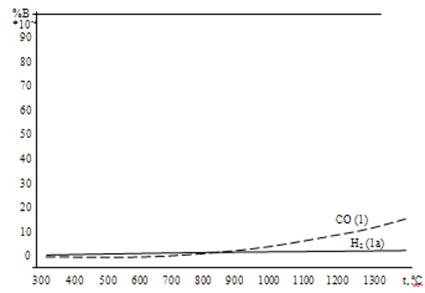
Рисунок 6. Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода.
Восстановление оксидов железа твердым углеродом. Твердый углерод (графит) - универсальный восстановитель оксидов. Реакции восстановления оксидов углеродом графита (коксом) принято называть прямым восстановлением в отличие от реакций восстановления газом, называемых косвенным восстановлением. В доменном процессе доля прямого восстановления оксидов железа составляет 30-40 %. Уравнения реакций:
2в. Fe3O4 + Cтв = 3 FeO + CO
3в. FeO + Cтв = Fe + CO
В трехкомпонентной системе Fe – C – O равновесие четырех фаз (три твердых + газ) одновариантно (С=К-f + n = 3 – 4 +2 = 1) , т.е. состав газа и температура определяются давлением. При Р= const C=0 и равновесие возможно лишь при единственном значении температуры. Равновесное значение температуры можно найти как координату точки пересечения кривой %CОравн = φ(t) на рис. 3 с изобарой реакции Ств + СО2 =2 СО из задачи 2 (рис. 2). Так определяют температуру начала прямого восстановления оксида углеродом. Наложение изобар рисунка 2 на диаграмму рис.3 представлено на рис.7. На этом рисунке видно, что температура начала восстановления конкретного оксида зависит от общего давления, возрастая с его повышением.
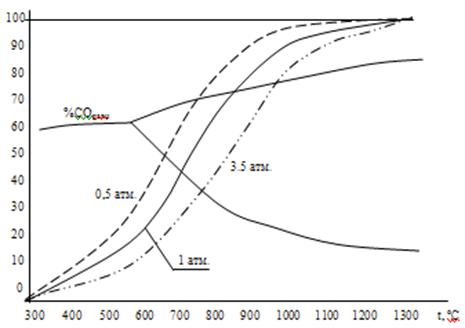
Рисунок 7. Определение температур начала восстановления Fe3O4 и FeO твердым углеродом.
