
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Синтез зтилового спирта, этилбензола и алкилирование фенолов
Реферат: Синтез зтилового спирта, этилбензола и алкилирование фенолов
Методы получения этилового спирта. Для прямой гидратации этилена в паровой фазе запишите основную и побочные реакции, укажите катализатор процесса, приведите механизм, запишите уравнение скорости накопления спирта. Обоснуйте выбор условий проведения процесса. Технологические особенности процесса и связанные с ними решения. Обоснуйте выбор типа и конструкции реактора.
Способы получения этилового спирта:
1. Брожение пищевого сырья (крахмалсодержащих и сахаристых веществ) – картофеля , хлебных злаков, отходов сахарных заводов.
![]()
Сначала идет осахаривание крахмала с образованием дисахарида – мальтозы, которая в процессе брожения гидролизуется в глюкозу.
2. Гидролиз древесины с последующим брожением. Для получения спирта древесину обрабатывают (гидролизуют) серной или соляной кислотой. При этом из целлюлозы образуется глюкоза
![]() ,
,
которая затем проходит стадию спиртового брожения.
3. Получение этанола из сульфитных щелоков – отходов целлюлозно-бумажного производства) - сульфитный спирт. Сульфитный щелок – жидкость, оставшаяся после обработки щепы раствором бисульфита Ca или Mg. Часть сухого вещества этих щелоков, представляющая собой сахара, способна сбраживаться в этиловый спирт.
4. Получение этилового спирта сернокислотной гидратацией. Концентрированная серная кислота способна реагировать с этиленом, образуя моно- и диалкилсульфат:
![]() ;
;
![]()
Эти эфиры при взаимодействии с водой превращаются в этиловый спирт, выделяя кислоту:
![]() ;
;
![]() .
.
5. Получение этилового спирта прямой гидратации этилена, т.е. путем непосредственного гетерогенно-каталитического присоединения воды к этилену:
![]() .
.
При прямой гидратации помимо основной протекают следующие побочные реакции:
Образование диэтилового эфира межмолекулярной дегидратацией этанола и алкилированием этанола этиленом;
образование изопропилового спирта при алкилировании пропилена, содержащегося в виде примеси в этилене;
образование ацетальдегида путем гидратации ацетилена (микропримесь в этиленовой фракции) и дегидрированием этанола;
образование кротонового альдегида конденсацией ацетальдегида;
образование уксусной кислоты окислением ацетальдегида;
образование этилацетата этерификацией уксусной кислоты этанолом;
образование полимеров этилена;
образование бутанола-2 при гидратации бутена-2 (продукт димеризации этилена).
В качестве катализатора используется фосфорная кислота, нанесенная на силикагель.
Механизм гидратации – карбкатионный:
протонирование олефина через промежуточное образование Пи- и сигма-комплексов,
присоединение молекулы воды с образованием иона алкоксония;
отщепление протона с образованием спирта.
При гидратации олефинов вода всегда находится в избытке, поэтому тормозящим влиянием спирта можно пренебречь:
 .
.
Температура гидратации 280-3000С, что неблагоприятно для равновесия, однако на практике не найдено катализатора, который давал бы приемлемые выходы спирта при более низкой температуре. При данной температуре степень конверсии не доводят до равновесной (10-11%), а держат на уровне 4-5%, т.к. при приближении к равновесной степени конверсии снижается скорость реакции.
Реакции гидратации, идущей с уменьшением объема, благоприятствует повышенное давление, поэтому процесс ведут при давлении 80 атм, дальнейшее повышение давления нецелесообразно из-за близости области конденсации водяного пара и больших затрат по созданию давления.
Соотношение водяной пар : олефин поддерживается на уровне 0,5-0,7 : 1, хотя с позиций термодинамики рекомендуется использовать избыток водяного пара. Соотношение ограничено с одной стороны близостью области конденсации водяного пара, с другой – увеличением затрат на ректификацию разбавленного водно-спиртового конденсата.
Наличие инертного разбавителя равноценно снижению общего давления в системе и не выгодно в данном процессе. Однако из-за низкой конверсии этилена за проход его приходится рециркулировать, в результате в нем накапливаются инертные примеси, что по действию аналогично введению инертного разбавителя. Поэтому для выведения инертов из системы часть рециклового этилена необходимо отдувать.
Технологические особенности процесса и связанные с ними решения:
Малая степень конверсии этилена за проход – большие рецикловые потоки; необходимость отдувать инерты; необходимость использования высокочистого исходного этилена; с другой стороны - возможность использования адиабатического реактора простой конструкции;
Высокое давление – использование аппаратуры для создания давления и толстостенного реакционного аппарата;
Высококоррозионная среда – необходимость защищать реактор футеровкой;
Унос фосфорной кислоты с поверхности катализатора – необходимость ее нейтрализации и отделения солей; возможность подпитки катализатора свежей фосфорной кислотой;
Высокая температура реакции и использование пара высоких параметров - необходимость утилизации большого количества тепла; значительное количество теплообменной аппаратуры
В данном процессе можно использовать адиабатический реактор простой конструкции, футерованный изнутри медными листами для защиты от коррозии. Из-за высокого рабочего давления, реактор должен быть толстостенным. Катализатор насыпается на опорный перфорированный конус внавал. Для продления срока службы катализатора может быть предусмотрена его подпитка свежей фосфорной кислотой на входе.
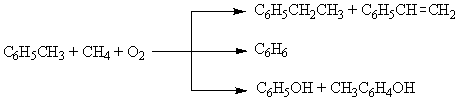
Способы получения этилбензола. Технологические особенности процесса, какими стадиями он представлен. Варианты аппаратурного оформления реакторного блока. Рекомендуйте оптимальные условия проведения процесса. Технологические особенности процесса, из каких стадий он состоит. Приведите варианты аппаратурного оформления реакторного блока.
Способы получения этилбензола:
1. Алкилирование бензола:
а) алкилирование бензола этиленом на протонных кислотах (HF > H2SO4 (ж.ф. 10-400С, 0,1-1,0 МПа > H3PO4 г.ф. 200-4000С, 2-6 МПа);
б) алкилирование бензола этиленом на апротонных кислотах; жидкофазное, kt – AlCl3 – стандартное (20-40% AlCl3) и гомогенное (2 г kt на 1 кг алкилата);
в) алкилирование бензола этиленом на гетерогенных катализаторах – алюмосиликатах и цеолитах (парофазный процесс, 210-2500С, 1,4-2,8 МПа; соотношение бензол:этилен 7:1
г) алкилирование бензола этилгалогенидами на AlCl3;
2. выделение ректификацией из фракции C8 ароматических углеводородов – продуктов каталитического риформинга;
3. выделение из смолы пиролиза;
4. окислительное метилирование толуола (700-7500С, радикально-цепной механизм, без катализатора)
 .
.
Основное количество этилбензола получают алкилированием бензола этиленом в присутствии AlCl3.
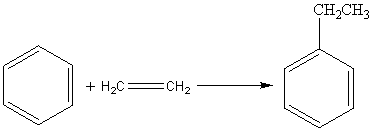
Побочные реакции:
1. на AlCl3 протекают реакции последовательного алкилирования, а т.к. алкилирование проводится под термодинамическим контролем, то среди диэтилбензолов будут преобладать мета- и пара-изомеры, а среди триэтилбензолов – 1,3,5-триэтилбензол.
2. деструкция этильной группы с образованием толуола;
3. олигомеризация этилена
4. смолообразование за счет конденсации ароматических соединений (диарилалканы).
Механизм – карбкатионный: протон уже имеется в виде σ-комплекса. Он передается молекуле олефина, образовавшийся карбокатион атакует ароматическое соединение, причем вся реакция протекает в слое каталитического комплекса, который обменивается своими лигандами с углеводородным слоем. Далее карбокатион атакует ароматическое ядро, образуются последовательно π-комплекс и карбокатион с последующей быстрой стадией отщепления протона.
Оптимальные условия: температура – 100-1100С (при этой температуре переалкилирование уже протекает достаточно быстро, но полициклических веществ, дезактивирующих катализатор еще мало); давление 0,1-0,2 МПа; соотношение бензол : этилен = (2-3) : 1моль/моль.
Технологические особенности процесса:
1. необходимость использовать избыток бензола по отношению к олефину – рецикл бензола;
2. реакция экзотермичная – необходимо предусмотреть съем тепла;
3. катализ осуществляется катализаторным комплексом на основе AlCl3 - его готовят отдельно;
4. реакция идет в слое катализаторного комплекса – необходимо активное перемешивание;
5. необходимость осушки бензола и, при необходимости, олефиновой фракции, т.к. наличие влаги приводит к дезактивации катализатора – осушка бензола, возможность отгонять непрореагировавший бензол с водой и возвращать его в рецикл;
6. на AlCl3 протекает обратимая реакции переалкилирования;
7. необходимость разлагать катализаторный комплекс – промывки, сточные воды;
8. абгазы содержат HCl – очистка абгазов.
Стадии, из которых состоит процесс:
1. гетероазеотропная осушка бензола;
2. блок приготовления катализатора;
3. реакторный узел;
4. очистка отходящих газов от HCl;
5. отделение реакционной массы от катализаторного комплекса;
6. разложение катализаторного комплекса и очистка продуктов алкилирования от HCl;
7. разделение продуктов алкилирования;
8. блок переалкилирования (оформленный отдельно или в возврат ди- и триалкилбензолов на переалкилирование в основной реактор).
Варианты оформления реакторного блока:
1. реактор с мешалкой и рубашкой периодического действия;
2. изотермический реактор трубчатого типа;
3. каскад реакторов с мешалками и рубашками;
4. реактор колонного типа, работающий в автотермическом режиме (съем тепла осуществляется кипящим бензолом).
Продукты, получаемые алкилированием фенолов и их назначение. Существующие катализаторы и алкилирующие агенты. Катализатор и оптимальные условия получения 2,6-дитретбутилфенола, запишите основную и побочные реакции, механизм превращения. Технологические особенности процесса, из каких стадий он состоит. Выбор конструкции реактора.
Газофазным метилированием фенола метанолом над гетерогенным катализатором получают о-, м- и п-крезолы и изомерные ксиленолы.
Из моноалкилфенолов практический интерес представляет п-третбутилфенол, используемый в производстве лакокрасочных покрытий. Моноалкилфенолы с алкильной группой из 5-8 атомов углерода являются сильными бактерицидными средствами, а с 8-12 атомами С – ценными промежуточными продуктами для синтеза ПАВ.
2-Треталкил-, 2,4- и 2,6-дитреталкилфенолы являются промежуточными продуктами для синтеза стабилизаторов полимеров и масел против термооокислительной деструкции.
Катализаторы и алкилирующие агенты:
На AlCl3 образуется сложная смесь продуктов, содержащая соли PhOAlCl2, поэтому в промышленности AlCl3 для алкилирования фенолов не используют.
Чаще всего применяют протонные кислоты и металлоксидные катализаторы. Поэтому в качестве алкилирующих агентов используют только спирты и олефины.
В качестве катализаторов – протонных кислот – в промышленности чаще всего применяют серную кислоту. Она дешевле и доступнее других кислот, но и сильнее катализирует побочные реакции, приводя дополнительно к сульфированию фенола и сульфатированию олефина.
п-Толуолсульфокислота - CH3C6H4SO2OH - катализатор, не вызывающий побочных реакций сульфирования и более мягкий по действию. Имеет меньшую активность и большую стоимость, чем серная кислота.
Глобальный недостаток этих катализаторов – образование большого количества кислых сточных вод в результате отмывки р.м. от катализатора.
Гетерогенные катализаторы – катионообменные смолы (КУ-2, КУ-23), которые отделяются от реакционной массы простым фильтрованием. Реакция идет при 120-1400С, но медленнее, чем серной кислотой.
Оксид алюминия, алюмосиликаты – гетерогенные катализаторы кислого типа применяются только для газофазного процесса метилирования фенола метанолом.
Феноляты алюминия (PhO)3Al – катализаторы селективного орто-алкилирования фенолов. В этом случае даже при незанятом пара-положении алкильная группа направляется преимущественнон в орто-положение.
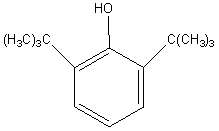
2,6-Дитретбутилфенол образуется в небольших количествах при алкилировании фенола изобутиленом в присутствии обычных кислотных катализаторов, но его трудно выделить из реакционной массы.
Основной промышленный способ получения – жидкофазное алкилирование фенола изобутиленом в присутствии фенолята алюминия (5-10 г на 1 кг фенола). Температура процесса 100-1100 С, т.к. при более высоких температурах становится все более заметным пара-алкилирование. Изобутилен берется в избытке.
Основная реакция:
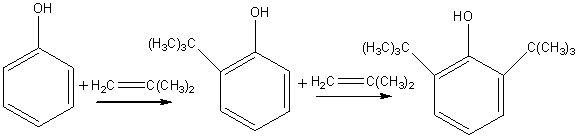
Побочные: 2-, 4-третбутилфенолы; 2,4-дитретбутилфенол, 2,4,6-тритретбутилфенол.
Механизм – карбокатионный, фенолят алюминия как апротонная кислота образует с фенолом комплекс (феноксиалюминиевую кислоту), имеющий значительную кислотность. Олефин дает с протоном карбокатион, который не выходит в объем и при внутрикомплексной реакции атакует ближайшее к нему орто-положение фенола.
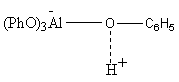
Технологические особенности:
необходимость использовать осушенный фенол, т.к. фенолят алюминия легко гидролизуется, теряя каталитическую активность;
экзотермичность реакции приготовления катализатора (нужно предусмотреть нагрев, а затем съем тепла);
экзотермичность самой реакции алкилирования (нужно предусмотреть съем тепла);
необходимость разложения и отделения катализатора;
побочные можно деалкилировать в исходные вещества и возвратить на реакцию.
Основные стадии процесса: осушка фенола (при необходимости), приготовление катализатора (обработка фенола металлическим алюминием при 150-1600С), алкилирование фенола изобутиленом, разрушение и отделение катализатора (разрушают водой, гидроксид алюминия отфильтровывают), выделение 2,6-дитретбутилфенола (1 колонна - отделяют фенол и 2-ТБФ, 2 – отделяют 2,6-диТБФ, 3 – разделяют 2,4-диТБФ от 2,4,6-триТБФ).