
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Методика определения и показатели устойчивости бактерий к дезинфеткантам
Курсовая работа: Методика определения и показатели устойчивости бактерий к дезинфеткантам
курсовая работапо микробиологии
на тему "методика определения и показатели устойчивости бактерий к дезинфеткантам"пенза, 2010
содержание
Введение
1. Общие положения об устойчивости бактерий к дезинфектантам на примере четвертичных аммонийных соединений
2. Методики определения и показатели устойчивости бактерий к дезинфектантам
2.1 Методика Е.И. Гудковой и А.П. Красильникова
2.1.1 Описание предлагаемой методики
2.1.2 Сравнительная оценка предлагаемой и референтной методик
2.1.3 Показатели чувствительности (устойчивости) бактерий к дезинфектантам
2.2 Методика, основанная на применении цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками
Заключение
Библиография
Введение
Актуальность темы курсовой работы не вызывает сомнений.
Ученым было давно известно, что бактерии могут приобретать сопротивляемость к дезинфектантам, но новые опыты показывают, что в результате воздействия дезинфицирующих препаратов бактерии становятся устойчивыми к некоторым видам лекарств. Более того, бактерии становятся невосприимчивыми к некоторым антибиотикам, с которыми они прежде не сталкивались. Устойчивость бактерий является антонимом термина чувствительность. В соответствии с этим устойчивость бактерий к дезинфектантам - свойство бактерий, проявляющееся в их способности к росту и размножению в присутствии дезинфицирующего средства в определенных концентрациях [17; С. 78].
Дезинфицирующие препараты, как явствует из последних исследований, могут фактически "обучать" бактерии, придавая им устойчивость к антибиотикам.
Например, ученые выяснили, что внесение растущих доз дезинфицирующих препаратов в лабораторные культуры так называемой синегнойной палочки (pseudomonas aeruginosa) приводит к тому, что бактерии вырабатывают резистентность не только к дезинфектанту, но также к ципрофлоксацину - распространенному антибиотику - даже без контакта с этим препаратом. По заключению ученых, бактерии приобретают способность вырабатывать антимикробные агенты, которые сопротивляются как дезинфектантам, так и антибиотикам.
В бактериях также происходят мутации ДНК, в результате которых они обретают сопротивляемость конкретно к антибиотикам типа ципрофлоксацина. Синегнойная палочка - вид бактерии, которая с наибольшей вероятностью атакует человека, который уже серьезно болен.
Она вызывает целых ряд инфекционных заболеваний, особенно у людей, чья иммунная система ослаблена - больных СПИДом, раком, диабетом, кистозным фиброзом или пострадавших от сильных ожогов. Для борьбы с распространением этих бактерий применяются поверхностные дезинфектанты. Однако если бактериям удается пережить обработку и проникнуть в организм, для лечения применяются антибиотики [9].
Ирландские ученые в результате последних исследований представляют доказательства того, насколько серьезную опасность для больного могут представлять бактерии, которым удается пережить оба этапа воздействия.
При обычно применяемых высоких уровнях концентрации такая проблема возникать не должна, но "в принципе это означает, что следы неправильно приготовленного раствора дезинфектанта в больничных помещениях могут способствовать возникновению невосприимчивых к антибиотикам бактерий".
Это не первое исследование, результаты которого вызывают озабоченность тем, что дезинфектанты приводят к повышению устойчивости бактерий к антибиотикам. В 2009 году уже был опубликован доклад Евросоюза, в котором подчеркивается важность "надлежащего и разумного" применения дезинфектантов с тем, чтобы минимизировать риск возникновения в бактериях сопротивляемости к обоим видам воздействия [18].
Целью исследования является изучение методик определения и показателей устойчивости бактерий к дезинфектантам.
Для достижения указанной цели поставлены следующие задачи:
- рассмотреть общие положения об устойчивости бактерий к дезинфектантам на примере четвертичных аммонийных соединений;
- описать методики определения и показатели устойчивости бактерий к дезинфектантам;
В качестве предмета исследования выступили методика определения и показатели устойчивости бактерий к дезинфектантам.
Методологической основой работы служит диалектический метод познания и анализ рассматриваемых явлений.
Характер рассматриваемых в курсовой работе вопросов обусловил использование комплекса основных методов:
– материалистические;
– исторические;
– метод сравнительного анализа;
– формально-юридический метод;
– эмпирические;
– источниковедческие.
Выбор структуры курсовой работы обусловлен последовательностью решения поставленных задач и логикой изучения темы.
– В первой главе рассматриваются общие положения об устойчивости бактерий к дезинфектантам на примере четвертичных аммонийных соединений.
– Во второй главе описываются методики определения и показатели устойчивости бактерий к дезинфектантам.
При написании курсовой работы были изучены учебные материалы, монографии, публикации на страницах периодической печати.
1. Общие положения об устойчивости бактерий к дезинфектантам на примере четвертичных аммонийных соединений
Известно бактерии имеют характерный спектр и уровень естественной устойчивости к конкретной группе химических средств или конкретному дезинфицирующему средству. Наряду с естественной (природной) устойчивостью бактерий, может формироваться приобретенная устойчивость. Приобретенная устойчивость является результатом изменчивости, в результате которой бактерия приобретает новые или утрачивает исходные признаки. У большинства бактерий изменчивость выражена значительнее, чем у высших организмов, что связано с коротким периодом генерации и другими факторами. И если генотипическая изменчивость передается по наследству, то фенотипическая - не передается [8; С. 141].
Установлена возможность формирования устойчивости бактерий к некоторым четвертичным аммониевым соединениям.
Четвертичные аммонийные соединения (ЧАС) - это соли с четвертичным атомом азота в качестве характерной химической группы. Одна из четырех углеродных связей, как правило, имеет более 10 углеродных атомов.
В настоящее время ЧАСы имеют широкую область применения, терапевтическая антисептика местных гнойно-воспалительных процессов, профилактическая антисептика неповрежденной кожи перед операциями, антисептика слизистых оболочек, консервирование глазных капель, инъекционных растворов, зубных паст, косметических средств; дезинфекция и очистка поверхностей, дезодорирование.
Современные ЧАСы характеризуются умеренно широким спектром антимикробной активности, не имеют запаха, бесцветны, обладают слабой коррозийной активностью, эффективностью е широком диапазоне рН, устойчивостью к высоким температурам, стабильностью концентратов и рабочих растворов, относительной толерантностью к присутствию органических веществ, остаточным бактериостатическим действием на обрабатываемых поверхностях, низкой токсичностью, прекрасными моющими свойствами [11].
Устойчивость бактерий к дезинфицирующим средствам подразделяется на естественную (видовую) и приобретенную. Естественная устойчивость к ЧАС характерна для грамотрицательных бактерий, бактериальных спор. Механизм такой устойчивости: непроницаемость клеточной стенки для молекул ЧАС. Среди фамотрицательных бактерий наибольшей резистентностью обладает Р.aerruginosa. Это обусловлено высоким содержанием ионов магния в клеточной стенке псевдомонад, что способствует созданию сильных связей между молекулами липополисахаридов, кроме того, малые размеры пор не позволяют осуществлять диффузию молекул ЧАС через клеточную стевку.
Механизм высокой резистентности микобактерий связан с повышенным содержанием арабиногалактана, липидов и восков, придающим выраженную гидрофобность клеточной стенке. Вследствие этого гидрофильные молекулы дезинфектантов не способны проникать через клеточную стенку в количествах, необходимых для достижения микобактерицидного эффекта. Показано, однако, что уровень активности ЧАС в отношении микобактерий может быть значительно увеличен с помощью изменений в составе формул и создания новых препаратов.
Наличие естественной устойчивости к соединениям из групп ЧАС отмечено также у некоторых мукоидных штаммов стафилококков. Слизистый слой, окружающий бактериальные клетки, является барьером для проникновения молекул ЧАС, кроме того, наблюдаются взаимодействие компонентов слизи с дезинфектантом и поглощение (нейтрализация) активно действующих веществ.
Приобретенная устойчивость к ЧАС обусловлена генотипическими (наличие генов устойчивости, локализованных в плазмидах, хромосоме или транспозонах) или фенотипическими механизмами. Плазмидная устойчивость установлена для Е.соli, S.аureus, S.epidermidis. Показано, что около 40% изолятов коагулазоотрицательных стафилококков имеют гены устойчивости к ЧАС, локализованные в Р-плазмиде, детерминирующей резистентность к лактамным антибиотикам и солям тяжелых металлов.
Биохимический механизм такой устойчивости - выведение молекул дезинфектанта из клетки. Мутационный механизм генотипической устойчивости к ЧАС выявлен у Р.аеroginosa. Такой тип устойчивости обусловлен изменением профилей жирных кислот и белков клеточной стенки, вследствие чего ограничивается проникновение через нее молекул дезинфектанта.
Фенотипичсская устойчивость к ЧАС, как и к другим биоцидам, связана со способностью бактерий образовывать биопленки, фиксированные на различных поверхностях, К бактериям, находящимся во внутренних слоях пленки, доступ молекул дезинфектантов ограничен. Кроме того, возможно химическое взаимодействие между дезинфектантом и биопленкой, в результате которого происходит нейтрализация активно действующих веществ.
Больничные изоляты бактерий являются менее чувствительными к дезинфектантам по сравнению с типовыми и внеболъничными штаммами. В появлении и распространения устойчивых к ЧАС вариантов бактерий, вероятно, имеют значение описанные выше генетические механизмы резистентности и селекции устойчивых культур при длительном применении в больницах дезсредств на основе одной группы активно действующих веществ [12; С. 10].
Исследования проведены с использованием тест-объектов, контаминированных микробными культурами.
К новым дезинфектантам на основе ЧАС, в состав которых входили также этанол, полигуанидин, амин, не было обнаружено устойчивых вариантов бактерий. Асфен 381 оказался неактивным в отношении 20,0% псевдомонад. К рекомендованным для практического применения концентрациям Микробак-форте были устойчивыми от 9,1 до 40,9% энтеробактерий, от 18,9 до 24,3% псевдомонад и от 0 до 20,0% стафилококков. Септабик в 0,12% концентрации проявил недостаточную активность в отношении большинства изученных изолятов энтеробактерий и псевдомонад. После действия 0,3% концентрации дезинфектанта при 60 - минутной экспозиции выживали 15,4% энтеробактерий и 7,2% стафилококков [6; С. 92].
Таким образом, ЧАС как монопрепараты вследствие относительно ограниченного спектра и невысокого уровня антимикробной активности могут применяться для дезинфекции и очистки некритических поверхностей в клиниках, на предприятиях пищевой промышленности и общественного питания. Введение в состав дезсредств на основе ЧАС активно действующих веществ, характеризующихся другими механизмами действия, приводит к расширению спектра и повышению уровня активности, способствует замедлению процессов формирования у микробов устойчивости [14; С. 341].
2. Методики определения и показатели устойчивости бактерий к дезинфектантам
2.1 Методика Е.И. Гудковой и А.П. Красильникова
В связи с появлением и распространением в природных средах устойчивых к дезинфектантам вариантов бактерий - возбудителей инфекционных болезней произошло снижение эффективности дезинфекционных мероприятий. Для предупреждения негативного действия этого явления на уровень заболеваемости инфекционными болезнями предложено установить контроль за циркуляцией устойчивых к дезинфектантам вариантов и изменять режим дезинфекции, исходя из полученных результатов. Ожидается, что введение этой меры должно повысить эффективность противомикробных мероприятий и затормозить селекцию и распространение устойчивых к дезинфектантам вариантов бактерий в окружающих человека экологических средах [15].
Реализация этого ценного предложения осложняется отсутствием адекватной методики. Применяемые в разных странах методики предназначены для определения активности дезинфектантов. Для испытания чувствительности (устойчивости) к дезинфектантам большого количества штаммов бактерий дикого типа они мало пригодны.
Для определения активности дезинфектантов в большинстве стран отдается предпочтение методикам с различными тест-носителями (батистовые тесты в методике, принятой в нашей стране, цилиндрики из нержавеющей стали в методике, принятой в США). Предлагаемая модификация относится к этой группе методов, но она специально предназначена для испытания чувствительности (устойчивости) бактерий к дезинфектантам.
2.1.1 Описание предлагаемой методики
Показания к применению методики: а) контроль за циркуляцией устойчивых к дезинфектантам штаммов бактерий в лечебно-профилактических учреждениях и эпидемических очагах; б) расследование причин неэффективности дезинфекционных мероприятий; в) установление причин микробной контаминации дезинфицирующих растворов; г) определение противомикробной активности дезинфектантов.
Материалы, необходимые для выполнения методики: испытуемые культуры, стандартные дезинфектанты; питательная среда АГВ для определения чувствительности бактерий к антибиотикам, специальные для отдельных групп бактерий среды, скошенный питательный агар; 0,9% раствор хлорида натрия, лошадиная сыворотка; нейтрализаторы дезинфектантов; штампы-репликаторы из нержавеющей стали с 50 штифтами, высота которых должна соответствовать 10 мм, диаметр 3 мм, площадь концевой площадки 7,1 см2, посевной объем 0,001 мл; опорные кольца для высушивания контаминированных репликаторов; бумажный эталон с номерами штифтов репликатора; термостат, пипетки, бактериологические чашки, стандарт мутности и др. [7; С. 48-50].
Для испытания на устойчивость используют чистые культуры бактерий, выделенные с помощью стандартных методик. Испытание проводят не позже 1-2 дней после выделения. Перед испытанием культуры засевают на скошенный питательный агар, выращивают в термостате при 37° С в течение 16-20 ч, смывают 0,9% раствором хлорида натри с 20% лошадиной сыворотки, стандартизируют плотность" в 2-109 бактерий/мл. Культуры испытывают раздельно; при массовых исследованиях допустимо объединение нескольких культур из одного объекта.
Поскольку подавляющее большинство дезинфектантов применяют в виде водных растворов, функциональные свойства которых определяются концентрацией присутствующего в них активно действующего начала, объективной характеристикой чувствительности к препарату служит концентрация дезинфектанта, вызывающая гибель 100% внесенных бактерий в фиксированное время. Такой подход в отличие от использования различных временных интервалов при фиксированной концентрации, кроме того, обеспечивая большую возможность количественной оценки и более привычен для практических бактериологов.
Дезинфектанты разводят стерильной теплой водой в асептических условиях в концентрациях, зависящих от используемых показателей.
По описанной в п. 1.3 методике готовят взвеси испытуемых культур.
Взвесями бактерий контаминируют штифты штампа - репликатора (одновременно в одном репликаторе может быть испытано 50 культур, а в случае смешанных культур - в несколько сколько раз больше). Для этого в лунки основания репликатора пастеровской пипеткой вносят взвеси испытуемых культур до образования вогнутого мениска (2-3 каш штифты крышки репликатора опускают в лунки, содержал взвеси бактерий, глубина погружения штифтов должна составлять 2-3 мм; спустя 5 мин крышку с штифтами снимают с лунок и помещают на опорное кольцо для высушивания бактериальной взвеси. Высушивают в асептических условиях на воздухе при комнатной температуре в затемненном месте.
Дезинфекцию штифтов проводят в лунках репликатора, в которые предварительно пипеткой вносят заданный раствор дезинфектанта. После этого в лунки с дезинфектантом осторожно опускают контаминированные бактериями штифты. Глубина погружения должна соответствовать примерно 4-5 мм, что контролируется ограничителем штифта.
После 10-минутной экспозиции в дезинфектанте штифты переносят в лунки штампа-репликатора, заполненные нейтрализатором, и выдерживают в нем 10 мин. Глубина погружения штифтов должна быть больше, чем уровень погружения штифтов в дезинфектант, что также обеспечивается ограничителем. Для нейтрализации хлорамина, диконита, перекиси водорода, препаратов йода используют 1% раствор тиосульфита натрия (гипосульфита хлоргексидина-0,6% раствор сульфонола, формалина- 1% раствор сульфита натрия, фенола и его препаратов-3% твин-80 (полисорбат) с 0,3% лецитина (или 1,5% эмулз куриного желтка).
В контроле роста бактериальных культур контаминированные описанным выше способом штифты погружают на 20 минут в лунки со стерильной водой, в контроле нейтрализатора контаминированные штифты екают на 10 мин в раствор нейтрализатора.
После истечения экспозиции опытные и контрольные репликаторы извлекают из нейтрализатора (воды) и концевые площадки штифтов репликаторов на 5 с слегка прижимают к поверхности АГВ или другой питательной среды на бактериологических чашках. На дне чашки чертой обозначают верх, который при посеве-реплике должен совпадать с чертой на крышке репликатора. Посевы выдерживают в термостате 37° С в течение 48 ч, после чего на фоне бумажного эталона с номерами культур учитывают наличие или отсутствие роста бактерий в зонах посевов-отпечатков. Культуру считают устойчивой ко взятой в опыт концентрации дезинфектанта, если в зоне отпечатка опытной чашки вырастает хотя бы одна колония при условии сплошного роста на отпечатках контролей. Для повышения достоверности каждой испытуемой культурой (или ее субкультурами) следует контаминировать 3 штифта или проводить исследование 3-кратно.
2.1.2 Сравнительная оценка предлагаемой и референтной методик
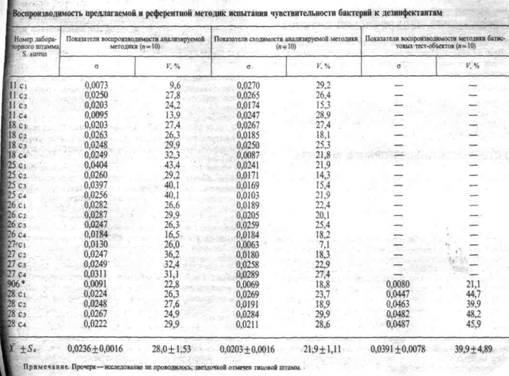
Определены правильность и воспроизводимость предлагаемой и референтной методик (ГОСТ 16263-70). В качестве референтной взята широко применяемая в России методика батистовых тест-объектов ВНИИДиС.
Правильность оценивали путем сравнения результатов 10-ратного определения минимальной бактерицидной концентрации (МБК) хлорамина Б для 5 штаммов S. aureus с помощью предлагаемой и референтной методик. X ±SX МБК хлорамина в предлагаемой методике равнялась (в г/100 мл): у039±0,04, 0,085+0,016, 0,089 ±0,011, 0,107 ±0,033, 1,074 + 0,011, в референтной соответственно: 0,038 ±0,05, 1,098±0,022, 0,116±0,024, 0,098 ±0,018, 0,106 + 0,021. Показатель р между сравниваемыми методиками во всех случаях был меньше 0,05, (-колебался от 0,16 до 1,33. Следовательно, различия между результатами предлагаемой и референтной методик недостоверны, что является показателем правильности первой.
Воспроизводимость (в серии и во времени) оценивали путем сравнения результатов 10-кратного испытания чувствительности 25 штаммов S. aureus к хлорамину с установлением ДБК в ряде. Мерилом разброса результатов вокруг средней арифметической служили среднеквадратическое отклонение (о) и коэффициент вариации (К). Как видно из таблицы, разброс результатов в обоих методиках относительно высок, что, вероятно, является как результатом гетерогенности популяции стафилококка по признаку чувствительности к дезинфектанту, так и следствием совершенства методик. Воспроизводимость предлагаемой методики по сравнению с референтной оказалась более высокой.
Для сравнения экономичности проведен хронометраж, который показал, что предлагаемая методика в течение 7 ч позволяет определить МБК 3 дезинфектантов у 50 культур затратой 510 мл питательной среды. Для того чтобы такой объем работы выполнить методикой батистовых тест-объектов требуется 102 ч и 15 500 мл питательной среды. Следовательно, предлагаемая методика дает экономию времени в 14,6 раза, питательных сред - 30,4 раза. Преимущество предлагаемой методики перед референтной также состоит в большей дискретности показателей и привычности постановки и оценки, поскольку близкий подход используется при определении чувствительности к антибиотикам и антисептикам.
2.1.3 Показатели чувствительности (устойчивости) бактерий к дезинфектантам
Практическое здравоохранение не имеет не только унифицированных методов испытания чувствительности культур такого типа бактерий к дезинфектантам, но и общепринятых показателей оценки этого явления. В том классе методик, которому относится предлагаемая нами, оценка активности препарата или чувствительности бактерий проводится по МБК при стабильной экспозиции или по минимальной экспозиции при стабильной концентрации препарата, причем как стандартная концентрация, так и стандартная экспозиция не унифицированы.
На выборках больничных и внебольничных штаммов энтеробактерий, псевдомонад и стафилококков кроме МБК испытан комплекс показателей, предложенный ранее для оценки чувствительности бактерий к антисептикам. Опираясь на полученные при этом результаты, мы рекомендуем для практических целей следующие показатели:
Для получения МБК испытывают ряд разведений дезинфектанта, минимальная концентрация которого не оказывает бактерицидного действия ни на один штамм, а максимальная - подавляет все штаммы. За МБК принимается минимальная концентрация дезинфектанта (в граммах на 100 мл), которая вызывает гибель всех присутствующих в стандартизованной дозе бактерий за 10-минутную экспозицию. Если МБК равна или выше рабочей концентрации дезинфектанта, культура оценивается как устойчивая, если меньше - как чувствительная. Методика определения МБК требует затраты большого количества времени, дезинфектантов и сред, поэтому в практических целях может применяться в особых случаях [2].
2. Показатель клинической устойчивости. В качестве дифференцирующей (клинически устойчивые и клинически чувствительные культуры) взята рабочая концентрация (рекомендуемая для практической дезинфекции) препарата. Культуры, погибающие при 10-минутном воздействии такой концентрации (не растущие при посеве на питательные среды), относят к клинически чувствительным; культуры, которые остаются живыми (дают рост на средах) - к клинически устойчивым. Поскольку в практике дезинфекции, как правило, не учитывают различия в уровнях видовой чувствительности, дифференцирующие уровни при определении клинической устойчивости одинаковы по отношению ко всем видам бактерий, но различны для каждого дезинфицирующего препарата. В тех случаях, когда на практике рекомендуется использовать несколько концентраций, например в зависимости от требуемой степени дезинфекции, мы рекомендуем определять устойчивость выделенных из биотопа культур к рекомендуемой для него концентрации дезинфектанта.
Лучшие результаты при определении клинической устойчивости дала бы ориентация не на вносимую на объект концентрацию, а на концентрацию, которая создается после внесения дезинфектанта. Однако такой подход пока не реален. Показатель клинической устойчивости дает врачу необходимую для эффективной дезинфекции информацию и в то же время доступен бактериологическим лабораториям больниц и санэпидстанций. Поэтому мы рекомендуем его в качестве основного.
3. Показатель биологической (статистической) устойчивости. Клиническая устойчивость отражает высокий уровень устойчивости. Однако в случаях постепенного нарастания признака устойчивости в популяциях бактерий, как показали наши исследования, часто обнаруживаются культуры, которые относятся к клинически чувствительным, но с биологических позиций не могут быть признаны таковыми, поскольку выходят из статистического ряда чувствительных культур. Это наблюдение позволило нам ввести показатель биологической устойчивости к дезинфектантам, дифференцирующей концентрацией которого является средняя величина МБК с двумя квадратическими отклонениями (Х±2о) для выборки в 100 культур из биотопа, в который не вносился дезинфектант. Ценность этого показателя состоит в том, что он дает более раннюю и полную информацию о сдвигах в чувствительности популяции к дезинфектантам, иногда еще до появления клинически устойчивых культур. Это позволяет изменить режим дезинфекции на более раннем этапе. Концентрации дезинфектантов, дифференцирующие биологически чувствительные и устойчивые культуры, специфичны для каждого дезинфектанта и для каждого вида бактерий. Их находят опытным путем.
4. Индекс активности дезинфектанта (ИАД). Показатель клинической устойчивости дает качественную оценку чувствительности культуры (чувствительная, устойчивая) или дезинфектанта (активен, неактивен), что затрудняет выбор более активного дезинфектанта. Количественную оценку можно сделать с помощью предлагаемого нами ИАД, который представляет собой отношение рабочей концентрации дезинфектанта к его МБК для конкретной культуры или Х±2а для популяции, вида или группы близкородственных по признаку чувствительности видов бактерий. Чем выше эта величина, тем более чувствительна культура или активен дезинфектант. Показатель ниже единицы указывает на устойчивость культуры или неэффективность дезинфектанта.
Для исследовательских целей ценная дополнительная информация о чувствительности (устойчивости) бактерий к дезинфектантам может быть получена при построении графика распределения индивидуальных МБК в системе абсцисса- ордината, расчете амплитуды индивидуальных МБК, определении частоты, уровней и спектров устойчивости.
Описанная в статье методика и показатели с положительными результатами опробованы на выборках из больничных и внебольничных популяций стафилококков, псевдомонад и энтеробактерий, что позволяет рекомендовать их для использования в практической медицине и Научных исследованиях.
2.2 Методика, основанная на применении цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками
Применение цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками является основой ускоренного и упрощенного способа определения антибактериальной активности дезинфекционных средств. Учет результатов испытания активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционного средства и взвеси бактерий, а также на учете мутности в лунках пластины.
Разработанная методика позволяет не только оценивать антибактериальную активность большинства дезинфекционных средств, но и определять устойчивость бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
В последние годы стали появляться сообщения, в которых приведены факты появления устойчивости бактериальных культур к дезинфекционным средствам. Авторы этих работ убеждены, что устойчивость бактерий к дезинфектантам широко распространена среди госпитальных штаммов, в связи с чем необходим мониторинг этого явления. Но в этом случае следует обладать методиками, которые позволили бы изучать выделенные в ЛПУ и других объектах штаммы в широком ассортименте, в то время как существующие методы громоздки и трудоемки.
Для определения антибактериальной активности дезинфекционных средств последние титровали в плоскодонных луночках стерильных пластинок типа Titerteck, предназначенных изначально для иммуноферментного анализа. Разведения дезинфекционных средств, как и приготовление взвеси бактериальных культур осуществляли с помощью цветной питательной среды. Учет результатов вели после термостатирования при 37°С по изменению исходного цвета питательной среды и появлению мутности, которые регистрировали визуально, но возможен учет инструментальный в аппарате типа Multiscan при использовании фильтра 450 nm.
Методика основана на хорошо известном факте, что по мере роста в цветной питательной среде бактерии сдвигают рН в кислую сторону, что влечет за собой изменение цвета среды, а эффективное дезинфекционное средство, по нашему предположению, должно предотвращать конверсию цвета. Работу начали с испытания роста некоторых эталонных штаммов бактерий в питательных средах, в состав которых входили разные индикаторы - феноловый красный, бромкрезолпурпур или бромтимоловый синий. Наиболее яркий переход от исходного цвета к желтому получили при использовании питательной среды с бромкрезол-пурпуром, но наиболее чувствительной к конверсии цвета оказалась зеленая питательная среда с бромтимоловым синим.
Чем выше концентрация бактерий, тем скорее наступает конверсия цвета, которая оказалась необратимой. Из трех индикаторов мы выбрали бромтимоловый синий, концентрация которого в среде составила 0,002%. Что касается концентрации бактерий, то мы остановились на дозе 5*107 м. кл. в луночке. При этой концентрации достаточно было 2-3 генераций бактерий, чтобы наступила конверсия цвета питательной среды в желтый [13; С. 21].
Однако не все виды бактерий меняют цвет среды на желтый. При внесении в питательную среду Ps.alcaligenes уже через 3 часа цвет питательной среды меняется на светлосиний, свидетельствующий не о снижении, а о повышении рН. Однако с увеличением времени светлосиний цвет под влиянием роста бактерий постепенно меняется на желтый. Поэтому в случае синегнойной палочки учет следует вести по перемене зеленого цвета на синий. Трудности возникли и с некоторыми дезинфекционными средствами, которые сами по себе изменяли цвет питательной среды. В качестве примера приводим результаты испытания средства "Септабик" (30% четвертичного аммониевого основания и 65% мочевины). Это средство применяют в концентрациях 2-0,2% по препарату [3; С. 65]. Но в концентрации 1-2% "Септабик" обесцвечивает питательную среду и даже в концентрации 0,5% искажает ее исходный цвет. Поэтому испытывать действие "Септабика" на бактериальные культуры следует при концентрациях средства ниже 0,5%.
Все дезинфекционные средства можно в интересующем нас плане разбить на три группы, руководствуясь рН: кислые, нейтральные и щелочные. Кислые препараты характеризуются тем, что сразу же после добавления к питательной среде меняют цвет на желтый. Испытывать такие препараты можно лишь, начиная с тех концентраций, которые не искажают исходный цвет питательной среды. Аналогичным образом щелочные препараты затруднительно использовать из-за того, что сразу после добавления меняют цвет питательной среды на светло-синий. Гораздо проще обстоит дело с нейтральными дезинфекционными средствами, которые будучи добавленными к питательной среде, не искажают ее исходный цвет. В этих случаях сохранение исходного цвета свидетельствует о губительном действии дезинфекционного средства на бактерии, а изменение цвета на желтый является указанием на то, что препарат не препятствует росту бактерий, если последние не подщелачивают среду. К нейтральным дезинфекционным препаратам можно отнести хлорамин, для которого характерна слабощелочная рН.
Относительно высокие концентрации перекиси водорода обесцвечивали питательную среду. К тому же сразу после добавления к раствору Н2О2 бактерий начиналось обильное выделение пузырьков, обязанное каталазе, которую выделяют многие бактерии. Образование пены затрудняло учет испытаний.
На примере трех дезинфекционных препаратов - "Септабик", хлорамин, перекись водорода - можно убедиться в том, что для каждого средства следует учитывать особенности применения предлагаемой ускоренной и упрощенной методики.
Не всегда рекомендованные в практике концентрации дезинфекционных средств могут быть испытаны с помощью предлагаемой методики, но не исключает ее использование в этих случаях при более низких концентрациях, например, для сравнительных испытаний.
Избранная концентрация бактерий 5-107 м. клеток не влияла на исходный цвет питательной среды и не создавала мутности. Во время термостатирования при 37°С в лунках по мере размножения бактерий легкая мутность появляется к 4 часам для хорошо натренированного глаза. Лишь через 6 часов при 37°С мутность не вызывает сомнений. Можно поступить иначе - после 4-часовой экспозиции при 37°С оставить пластины при комнатной температуре и осуществить учет мутности на следующий день. Прибавление дезинфекционного средства к смеси бактерий и питательной среды препятствует образованию мутности и этот признак может быть использован для оценки антибактериальной активности дезинфекционных средств. В редких случаях мутность в растворе образуется не за счет бактерий, а за счет взаимодействия дезинфектанта с ингредиентами питательной среды, но это наступает сразу после смешения (Дезэффект, Бромосепт).
Итак, представленная в настоящей работе методика упрощенного и ускоренного определения антибактериальных свойств дезинфекционных средств основана на учете двух признаков - изменение цвета питательной среды и появления мутности. Изменение цвета наступает раньше и может быть учтено уже через несколько часов, но имеет ряд ограничений. Появление мутности наступает позднее, но зато лишено ряда ограничений, свойственных цветовому учету. Сочетание двух перечисленных признаков позволяет характеризовать предлагаемую методику оценки антибактериальных качеств дезинфекционных средств как упрощенную и ускоренную.
Техническое исполнение предлагаемой методики укладывается в несколько операций. Вначале готовят раствор дезинфекционного средства на цветной питательной среде в концентрации, несколько превосходящей ту, которая рекомендована для практического использования, если это возможно, или в той концентрации, которая не вызывает существенного изменения цвета среды. Бактериальные культуры, эталонные или испытуемые, вначале испытывают в концентрации 5-107 м. кл. на способность вызывать изменение цвета питательной среды при термостатировании. Если испытуемая культура бактерий вызывает изменение исходной окраски питательной среды в подходящие сроки, то можно ее включать в испытания в сравнении с эталонной культурой того же вида и вынести суждение о возможной устойчивости выделенной на объекте культуры к дезинфекционному средству [10; С. 271].
Испытания ведут в 96-луночковых пластинах с плоским дном. Объем лунок - 0,2 мл. Готовят последовательные разведения дезинфекционного препарата на цветной питательной среде в объеме 0,1 мл. Затем в лунки привносят по 0,05 мл взвеси бактерий на цветной питательной среде - 5-107 м. кл. Пластины держат в термостате 37°С в течение 4 часов. Обычно этого времени достаточно, чтобы контроль культуры уже изменил свой цвет, но иногда требуется 6 часов. Если необходимости в скором учете результатов нет, то пластины переносят в комнатную температуру и учитывают на следующий день как цвет питательной среды, так и мутность (некоторые бактерии, например, бактерии чумы, успевают к этому времени осесть на дно лунок) [1; С. 241].
При использовании упрощенной и ускоренной методики не следует опасаться контаминации питательной среды в луночках посторонними бактериями, способными изменить рН среды, так как незначительное число попавших в луночки посторонних бактерий требует времени для достижения того количества, при котором возможен существенный сдвиг рН. Мы оставляли пластины с питательной средой открытыми в термостате при 37°С и только к концу 24 часа появлялись отдельные луночки. где изменялся цвет, а если такие же пластины оставляли на 4 часа при 37°С, а затем при комнатной температуре, то изменение цвета в отдельных луночках наступало на 3 сутки. Поэтому мы не очень опасались посторонних микроорганизмов и не создавали особых стерильных условий.
Те дезинфекционные препараты, рН которых существенно отклоняется от нейтральной, должны быть оценены специальным образом. Это в большей мере относится к композиционным препаратам, включающим в себя сильно кислые или щелочные компоненты.
Бондарев и др. измеряли антибактериальную активность дезинфекционных средств путем применения бумажных дисков, смоченных дезинфекционным средством по аналогии с методикой, употребляющейся для определения антибактериальной активности антибиотиков.
До сих пор наряду с определением прямого действия дезинфекционного средства на репродуктивную способность бактерий, определяемую по результатам посева на агар или в бульон, необходимо было использовать какой-либо адекватный нейтрализатор активнодействующего вещества, чтобы остановить действие дезинфектанта на бактерии после экспозиции, но перед посевом. Как известно, хлорамин удачно нейтрализуют гипосульфитом натрия, а формалин - аммиаком. Однако в других случаях катионные аммониевые основания принято нейтрализовать анионными соединениями, взятыми в эквимолярной концентрации. Наш опыт свидетельствует о том, что подобная "нейтрализация" порой неэффективна, возможно, из-за того, что взаимодействие агента и нейтрализатора обратимо. В других случаях и вовсе неизвестны эффективные и безвредные для бактерий нейтрализаторы, что затрудняет определение экспозиции, достаточной для разрушения бактерий. Не следует забывать, что в дезинфекционной практике, если и применяется экспозиция, то она достигается не применением нейтрализаторов, а чаще всего отмывкой водой дезинфекционного средства или другими способами. Поэтому применение нашей методики, ставящей своей целью упрощенное и ускоренное определение антибактериальной активности без прямого определения минимальной экспозиции, является вполне достаточным способом установления активности препарата как в сравнении с активностью других препаратов, так и самого по себе по отношению к испытуемым бактериальным культурам [4; С. 4-5].
Нам пришлось исследовать несколько образцов госпитальных культур, которых бактериологи одной из больниц г. Москвы заподозрили в устойчивости по отношению к дезинфекционному препарату "Дезэффект", но с помощью предлагаемой методики подтвердить этого не удалось, так как чувствительность испытуемых культур оказалась примерно равной чувствительности эталонных бактериальных культур [5; С. 135].
1. Применение цветных питательных сред, больших доз бактерий и пластмассовых пластин с лунками являются основой разработанной ускоренной и упрощенной методики определения антибактериальной активности дезинфекционных средств.
2. Учет результатов испытаний активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционных средств и бактерий, а также на визуальном учете мутности в лунках пластины.
3. Разработанная методика позволяет не тoлькo оценивать антибактериальную активность большинства дезинфекционных средств, но и испытывать предполагаемую резистентность бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
Заключение
Таким образом, устойчивость бактерий к дезинфектантам - свойство бактерий, проявляющееся в их способности к росту и размножению в присутствии дезинфицирующего средства в определенных концентрациях.
Известно бактерии имеют характерный спектр и уровень естественной устойчивости к конкретной группе химических средств или конкретному дезинфицирующему средству. Наряду с естественной (природной) устойчивостью бактерий, может формироваться приобретенная устойчивость. Приобретенная устойчивость является результатом изменчивости, в результате которой бактерия приобретает новые или утрачивает исходные признаки. У большинства бактерий изменчивость выражена значительнее, чем у высших организмов, что связано с коротким периодом генерации и другими факторами.
Существуют различные методики определения устойчивости бактерий к дезинфектантам.
Это методика Гудковой Е.И. и Красильникова А.П. для определения активности дезинфектантов. Для испытания на устойчивость используют чистые культуры бактерий, выделенные с помощью стандартных методик. Испытание проводят не позже 1-2 дней после выделения. Перед испытанием культуры засевают на скошенный питательный агар, выращивают в термостате при 37° С в течение 16-20 ч, смывают 0,9% раствором хлорида натри с 20% лошадиной сыворотки, стандартизируют плотность" в 2-109 бактерий/мл. Культуры испытывают раздельно; при массовых исследованиях допустимо объединение нескольких культур из одного объекта.
Также существует методика, основанная на применении цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками является основой ускоренного и упрощенного способа определения антибактериальной активности дезинфекционных средств. Учет результатов испытания активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционного средства и взвеси бактерий, а также на учете мутности в лунках пластины.
Из всего вышесказанного можно сделать вывод, что разработанные методики позволяют не только оценивать антибактериальную активность большинства дезинфекционных средств, но и определять устойчивость бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
Библиография
1. Алешукина А.В. Медицинская микробиология: Учеб. пособие для вузов.- Ростов н/Д: Феникс, 2003.
2. Афиногенов Г.Е.; Краснова М.В.; Доморад А.А. Способ оценки эффективности дезинфектантов и антисептиков // http://ru-patent.info/21/90-94/2191829.html3. Бессонова В.Я., Лившиц М.М. Применение цветных питательных среда процессе контроля стерилизации // Клиническая и лабораторная диагностика.- 1993.- № 2.- С. 65.
4. Бондарев В.А., Алтайская Г.Б., Горбунова 3.А. Организация работы Липецкого областного центра дезинфекции и стерилизации по определению активности дезинфектантов к различным микроорганизмам // Дезинфекционное дело.- 1999.- № 2 .- С. 4-5.
5. Быков А.С., Пашков Е.П., Рыбакова А.М. Микробиология: Учебник для вузов.- М.: Медицина, 2003.
6. Воробьев А.А. Медицинская и санитарная микробиология: Учеб. пособие для вузов.- М.: ACADEMIA, 2003.
7. Гудкова Е.И. , Красильников А.П. Методика определения и показатели чувствительности (устойчивости) бактерий к дезинфектантам // Клиническая лабораторная диагностика.- 1994.- № 6.- С. 48-50.
8. Гусев М.В. Микробиология: Учебник для вузов.- 4-е изд., стереотип.- М.: ACADEMIA, 2003.
9. Дезинфектанты // http://www.antibiotic.ru
10. Дикий И.Л. Микробиология. Учебник.- М.: Рыбари, 2004.
11. Красильников А.А., Рябцева Н.Л., Гудкова Е.И. Прошлое, настоящее и будущее четвертичных аммонийных соединений // http://belaseptika.by/press/publication/articles/133/
12. Леви М.И. К методике определения бактерицидной способности дезинфектантов, антисептиков и антибиотиков // Дезинфекционное дело.- 2001.- № 3.- С. 10.
13. Леви М.И., Сучков Ю.Г. Ускоренный и упрощенный способ определения антибактериальной активности дезинфекционных средств // Дезинфекционное дело.- 99.- № 3.- С. 21.
14. Медицинская микробиология, вирусология и иммунология: Учебник для студентов медицинских вузов / Под ред. А.А. Воробьева.- 2-е изд., испр. и доп.- Москва: Медицинское информационное агентство, 2008.
15. Медицинские новости // http://medwikipedia.ru/lenta-mira/48/dezinfektanty-formiruyut-ustoichivost-kantibiotikam
16. Монисов А.А. Методические рекомендации по ускоренному определению устойчивости бактерий к дезинфекционным средствам // http://www.pravoteka.ru/pst/3/1495.html
17. Пантелеева Л.Г. Научно-методические основы разработки и оценки перспективных средств дезинфекции при вирусных инфекциях журнал // Поликлиника.- 2008.- №6.- С. 78.
18. По материалам: Би-би-си. Бактерии могут приобретать устойчивость к действию дезинфектантов и антибиотиков // http://www.eurolab.ua/news/world-news/31686/