
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Качественный анализ неизвестного вещества
Курсовая работа: Качественный анализ неизвестного вещества
мИнИстерство оБРАЗОВАНИЯ И науки украИнЫ
харЬкОвский нацИональнЫй унИверситет
имени В.Н. Каразина
Кафедра химической метрологии
КУРСОВАЯ РАБОТА НА ТЕМУ:
КАЧЕСТВЕННЫЙ АНАЛИЗ НЕИЗВЕСТНОГО ВЕЩЕСТВА
Исполнитель: студент
Группы Х -147
Заруба Н.С
Руководитель: доцент, к.х.н.
Трубачев С.Д
ХАРЬКОВ 2010.
Содержание
Введение
1. Качественный анализ неизвестного вещества
1.1 Теоретические сведения по качественному анализу
1.2 Основные приемы и методы анализа неизвестного образца
1.3 Ход определения состава неизвестного образца
2.Расчет теоретической кривой титрования
2.1Теоретические основы титриметрического анализа
2.2 Комплексонометрическое титрование
2.3 Расчет кривой титрования методом комплексонометрии
2.4 Определение анионного состава сточных вод
Заключение
Список использованных источников информации
Введение
Аналитическая химия имеет огромное практическое значение в жизни современного общества, поскольку создает средства для химического анализа и обеспечивает его осуществление.
Химический анализ является важным средством контроля производства и оценки качества продукции в целом ряде отраслей промышленного производства, таких как черная и цветная металлургия, машиностроение, производство чистых и сверхчистых материалов для радиоэлектронной промышленности, горнодобывающая промышленность, химическая нефтеперерабатывающая, нефтехимическая, фармацевтическая и пищевая промышленности, геологическая служба и т.д.Без химического анализа невозможно решение проблем охраны окружающей среды, функционирование агропромышленного комплекса, проведение медицинской диагностики, развитие биотехнологии.
Научной основой химического анализа является аналитическая химия, которая разрабатывает теоретические основы методов анализа или заимствует их у смежных областей химической и физической науки и приспосабливает к своим целям. Аналитическая химия определяет границы применимости методов, оценивает их метрологические характеристики, разрабатывает способы анализа различных объектов. Итак, аналитическая химия – это область научного знания, раздел химической науки, а аналитическая служба – это система обеспечения потребностей общества в химических анализах.
Целью курсовой работы по дисциплине «Аналитическая химия и физико-химические методы анализа» является освоение основных принципов качественного и количественного анализа.
Поставленная цель достигается решением конкретного задания по анализу неизвестного вещества, проведением расчета по титриметрическому методу анализа и построением соответствующей кривой титрования.
1 Качественный анализ неизвестного вещества
1.1 Теоретические сведения по качественному анализу
Качественный анализ – раздел аналитической химии, посвященный установлению качественного состава веществ, то есть обнаружению элементов и образуемых ими ионов, входящих в состав и простых, и сложных веществ. Делают это с помощью химических реакций, характерных для данного катиона или аниона, позволяющих обнаружить их как в индивидуальных веществах, так и в смесях.
Химические реакции, пригодные для качественного анализа, должны сопровождаться заметным внешним эффектом. Это может быть: выделение газа, изменение окраски раствора, выпадение осадка, растворение осадка, образование кристаллов характерной формы.
В первых четырех случаях за протеканием реакции наблюдают визуально, кристаллы рассматривают под микроскопом.
Для получения правильных результатов необходимы реакции, выполнению которых не мешают другие присутствующие ионы. Для этого нужны специфические (взаимодействующие только с определяемым ионом) или хотя бы селективные (избирательные) реагенты.
К сожалению, селективных, тем более специфических реагентов очень мало, поэтому при анализе сложной смеси приходится прибегать к маскированию мешающих ионов, переводя их в реакционно-инертную форму, или, чаще, к разделению смеси катионов или анионов на составные части, называемые аналитическими группами. Делают это с помощью специальных (групповых) реагентов, которые с рядом ионов, реагируя в одних и тех же условиях, образуют соединения с близкими свойствами – малорастворимые осадки или устойчивые растворимые комплексы. Это и позволяет разделить сложную смесь на более простые составные части. Качественный анализ состоит из следующих этапов:
-предварительные наблюдения;
-предварительные испытания;
-действие кислот на сухой образец;
-переведение анализируемой пробы в раствор;
- систематический (или дробный) качественный анализ катионов и анионов.
При проведении аналитических реакций необходимо придерживаться определенных условий. К ним относятся концентрация реагирующих веществ, реакция среды, температура [1].
1.2 Основные приемы и методы анализа неизвестного образца
Подготовка вещества к анализу
Приступая к исследованию химического состава данного вещества, необходимо сначала внимательно его рассмотреть, определяя его внешний вид, цвет, запах, степень измельчения (порошок, крупнозернистая или мелкозернистая смесь, сплошная масса и т. д.), наличие кристаллических или аморфных фаз и подготовить соответствующим образом к анализу и лишь после этого приступить к установлению его химического состава.
Подготовка исследуемого вещества к анализу представляет собой очень, важную часть всего исследования.
По окраске анализируемого образца можно высказать предположения о наличии или отсутствии в нем тех или иных катионов. Если, например, анализируемый объект представляет собой бесцветную прозрачную или белую массу, то это указывает на отсутствие в нем значительных количеств окрашенных катионов — хрома(III) Сr 3+ (сине-фиолетовый цвет), марганца(II) Мn2+ (светло-розовый), железа(III) Fe3+ (желто-бурый), кобальта(II) Со2+ (розовый), никеля(II) Ni2+ (зеленый), меди(II) Сu2+ (голубой). Если образец окрашен, то можно предположить содержание в нем одного или нескольких из вышеуказанных катионов. Для полного анализа исследуемого вещества необходимо взять небольшое его количество, измеряемое миллиграммами. Качественный анализ выполняют в две стадии. Сначала проводят предварительные испытания, a, затем переходят к систематическому анализу катионов и анионов.
Предварительные испытания
Предварительные испытания позволяют установить присутствие некоторых элементов, обнаружение которых затруднено при систематическом ходе анализа.
Окрашивание пламени[2]
Для испытания на окрашивание пламени берут проволоку длиной 60 мм, диаметром 2-3 мм. Один коней ее сгибают в петлю, другой конец впаивают в стеклянную палочку, которая служит ручкой. Проволока должна быть хорошо очищена многократным прокаливанием в наиболее горячей несветящегося пламени горелки. Проволоку опускают в соляную кислоту и прокаливают в пламени горелки, затем охлаждают до комнатной температуры. На подготовленную таким образом проволоку помещают несколько кристаллов анализируемого вещества и вносят в пламя горелки. Различные ионы окрашивают пламя в следующие цвета:
Карминово-красный………………………Sr2+,Li2+
Кирпично-красный……………………….Са2+
Желтый…………………………………….Na+
Желто-зеленый……………………………Ba2+
Сине-зеленый…………………………......Те
Светло-голубой……………………………As,Sb,Pb2+
Ярко-голубой………………………………Cu2+,Se
Фиолетовый ……………………………….К+,Rb+ или Сs+
Смачивание проволоки хлороводородной кислотой проводят для того, чтобы получить в пламени летучие хлориды катионов, присутствующих в пробе (если она содержит нелетучий или труднолетучий компонент).
Испытание на продукты термического разложения[7]
По характеру продуктов термолиза (прокаливания) пробы твердого анализируемого вещества иногда можно судить о присутствии в анализируемом веществе некоторых катионов и анионов.
Для проведения этого теста небольшую порцию анализируемого вещества помещают на дно тугоплавкой пробирки (длиной ~7 см) и нагревают пробу, закрепив пробирку в горизонтальном положении, в пламени газовой горелки. При термическом разложении пробы выделяются газообразные продукты термолиза, часть которых конденсируется на холодном конце пробирки.
По окраске возгона можно сделать некоторые предварительные выводы:
Цвет возгона Возможные продукты термолиза
Белый …………………………………… Соли аммония, Hg2Cl2, HgCl2,
Желтый…………………………………...HgI2, As2S3, S
Зеркальный металлический …………….Мышьяк или ртуть (налет)
При термическом разложении наряду с возгонкой может происходить выделение паров и газов. Появление капелек воды на стенках холодной части пробирки (трубки) свидетельствует о том, что либо испытуемый образец содержит кристаллизационную воду, либо вода образуется в процессе термолиза пробы (с выделением воды разлагаются гидроксиды, кислые и основные соли, органические соединения).
Выделение фиолетовых паров иода и их конденсация в виде темных кристалликов указывает на возможность присутствия иодид-ионов или других йодсодержащих анионов:
Кроме фиолетовых паров иода могут выделяться бурые пары брома (возможно присутствие бромид-ионов и других бромсодержащих анионов), желто-бурые пары оксидов азота (возможно присутствие нитратов и нитритов), а также газообразные СО (возможно присутствие оксалатов), СО2 (возможно присутствие карбонатов, оксалатов), С12 (возможно присутствие хлорид-ионов и других хлорсодержащих анионов), SO2 (возможно присутствие сульфитов, тио-сульфатов), SO3 (возможно присутствие сульфатов), NH3 (возможно присутствие солей аммония), О2 (возможно присутствие пероксидов, нитратов, хроматов, дихроматов и т. п.).
Действие разбавленной (~1 моль/л) серной кислоты [7]
Разбавленная серная кислота вытесняет слабые кислоты из их солей — карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов.
При наличии в анализируемом образце карбонатов выделяется газообразный диоксид углерода СО2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 с запахом горящей серы; при наличии сульфидов — сероводород H2S с запахом тухлых яиц; при наличии цианидов — пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов — бурые пары диоксида азота NO2, при наличии ацетатов — пары уксусной кислоты СН3СООН с запахом уксуса.
Тест проводят следующим образом: отбирают небольшое количество анализируемого вещества в пробирку и по каплям прибавляют к нему разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой пробе вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты [7]
Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, иодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов — пары НС1 и газообразный хлор С12; при наличии бромидов — пары НВг и желтый газообразный бром Вг2; при наличии иодидов — фиолетовые пары иода J2; при наличии тиоцианатов — газообразный диоксид серы SO2; при наличии оксалатов — бесцветные газообразные оксид СО и диоксид СО2 углерода.
Тест проводят следующим образом. К небольшой массе твердого анализируемого вещества (0,010 г) в пробирке медленно, осторожно, по каплям прибавляют концентрированную серную кислоту. Если наблюдается газовыделение, то это свидетельствует о присутствии в анализируемом образце вышеуказанных анионов.
Проба на присутствие окислителей [7]
Для проведения этой пробы берут смесь разбавленной Н2SO4 с KJ, добавляют несколько кристалликов исследуемого вещества, предварительно измельченного до порошкообразного состояния, или 3-4 капли раствора анализируемого вещества (если вещество растворимо). При наличии окислителей выделяется свободный иод, который обнаруживается по бурой окраске раствора или с помощью крахмала. Эту реакцию дают NO2-,NO3-, MnO4-, CrO42-, ионы Fe3+, Cu2+.
Проба на присутствие восстановителей[7]
Для обнаружения восстановителей берут смесь разбавленных растворов KMnO4 + H2SO4.Обесцвечивание этого раствора вызывают SO32-, S2-, S2O32-, J-, NO2-,Cl-, Fe2+, Cr3+-ионы:
Растворение в воде [3]
Небольшое количество анализируемого вещества вносят в пробирку, прибавляют несколько миллилитров дистиллированной воды и перемешивают смесь некоторое время. Если вещество при этом полностью растворилось в воде, то большую часть вещества, отобранную для анализа, растворяют в возможно минимальном объеме дистиллированной воды и полученный раствор анализируют далее. Небольшую часть исходной твердой анализируемой пробы оставляют для проведения повторных или проверочных тестов, если это окажется необходимым.
Анализ на катионы
Аналитическая группа – группа катионов, которая с каким – либо одним реактивом (при определенных условиях) может давать сходные аналитические реакции. Деление катионов на аналитические группы основано на их отношении к различным анионам. Приняты две классификации: сульфидная и кислотно-щелочная.
По кислотно-щелочной классификации катионы делятся на шесть аналитических групп (таблица 1)
Таблица 1-Разделение катионов на группы по кислотно-щелочной классификации
| Катионы |
Групповой реактив |
Получаемые соединения |
Групповая характеристика |
|
K+, Na+, NH4+ |
нет | - | Хлориды, сульфаты и гидроокиси растворимы в воде |
|
Ag+, Pb2+ |
2н HCl |
Осадок AgCl, PbCl2 |
Хлориды нерастворимы в воде |
|
Ba2+,Ca2+ |
2н H2SO4 |
Осадок BaSO4, CaSO4 |
Сульфаты нерастворимы (или плохо растворимы) в воде и кислотах |
|
Zn2+,Al3+, Cr3+, |
Избыток 4н КОН или NaOH |
Раствор ZnO22-, AlO2-, CrO2-, |
Гидроксиды растворимы в избытке едкой щелочи |
|
Mg2+, Mn2+, Fe2+, Fe3+ |
Избыток 25%-ного NH3 |
Осадок Mg(OH)2, Mn(OH)2, Fe(OH)2, Fe(OH)3 |
Гидроксиды нерастворимы в избытке едкой щелочи |
|
Ni2+, Co2+, Cu2+ |
Избыток 25%-ного NH3 |
[Ni(NH3)4]2+, [Co(NH3)4]2+, [Cu(NH3)6]2+ |
Гидроксиды растворимы в избытке аммиака |
Анализ анионов
В основу классификации анионов положено различие в растворимости солей бария и серебра. В соответствии с наиболее распространенной классификацией анионы делятся на три аналитические группы, как это представлено в таблице 2.
Таблица 2 – Классификация анионов
| № гр. | Анионы | Групповой реактив | Характеристика группы |
| 1 |
SO42-,SO32, CO32-, PO43-, |
BaCl2 в нейтральной или слабощелочной среде |
Соли бария нерастворимы в воде |
| 2 |
Cl-, I- |
AgNO3 в присутствии HNO3 |
Соли серебра нерастворимы в воде и в разбавленной азотной кислоте |
| 3 |
NO3-, NO2-, CH3COO- |
Группового реагента нет | Соли бария и серебра растворимы в воде |
Обычно сначала проводят исследование объекта на катионы. Из отдельных проб раствора при помощи групповых реактивов определяется, катионы каких аналитических групп присутствуют в растворе, а затем уже определяют в нём анионы.
1.3 Ход определения состава неизвестного образца
Для анализа выдано вещество представляющее собой смесь двух солей (пробирка №13). В состав солей по условию могут входить только следующие ионы:
Катионы:
1. К + ,Na+,NH4+
2. Ag+,Pb2+
3.Ba2+,Ca2+
4. Zn2+,Al3+,Cr3+
5.Mg2+,Fe2+ ,Fe3+
6. Cu2+,Co2+,Ni2+
Анионы:
1. SO42-, SO32-,СO32-, РO42-
2. Сl-,I-
3. NO3-, NO2-,CH3COO-
Анализ вещества проводится в соответствии со схемой, описанной в пункте 1.2.
Предварительные испытания
Выданное вещество представляет собой мелкозернистую смесь бесцветных кристаллов и крупинок. По окраске вещества можно предположить, что в нем отсутствуют катионы Fe3+,Cr2+, Cu2+,Co2+,Ni2+.
Окрашивание пламени
Нихромовую проволоку смоченную в разбавленной соляной кислоте прокаливаем в пламени горелки, затем охлаждаем до комнатной температуры. На подготовленную подобным образом проволоку помещаем несколько кристалликов анализируемого вещества. Пламя горелки окрашивается в бледно-голубой цвет, что свидетельствует о возможном наличии в анализируемом веществе катиона Pb2+ и отсутствии катионов К +, Ba2+,Ca2+, Cu2+
Испытание на продукты термического разложения
Небольшую порцию анализируемого вещества помещаем на дно тугоплавкой пробирки и нагреваем в пламени горелки. Наблюдаем выделение желтых паров, на основании этого можно сделать предположение о возможном наличии в анализируемом образце нитратов. Уравнения(1,2) образования этих веществ приведены ниже:
Разложение нитратов:
а) от щелочно-земельных до меди (включительно) Me(NO3)2 → 2MeO + +2NO2 + O2 (1)
б) нитратов серебра, ртути и др. 2MeNO3 →2Me + 2NO2 + O2 (2)
Отсутствие темного налета на стенках холодной части пробирки также указывает на отсутствие йодидов в присутствии окислителей.
Вывод: в анализируемом веществе, возможно, присутствуют нитраты и отсутствуют йодсодержащие ионы.
Действие разбавленной серной кислоты
К небольшому количеству выданного вещества добавляем несколько капель разбавленной H2SO4 и нагреваем в пламени горелки. Выделяется газ с характерным запахом уксуса.
Химизм процесса приведен ниже (уравнение (3)):
CH3COO- + H+ → CH3COOH↑ (3)
Следовательно, в анализируемом веществе, возможно, присутствует анион CH3COO-.
Действие концентрированной серной кислоты
К небольшой массе анализируемого образца медленно добавляем концентрированную серную кислоту. Выделяются бесцветные пары с характерным запахом уксусной кислоты, что еще раз подтверждает наличие в анализируемом образце аниона CH3COO-.
Выделения паров с характерным запахом хлора и фиолетовых паров йода в соответствии с уравнениями (4-6):
Cl- + H+ → HCl↑ (4)
2Cl- + SO42- + 2H+ → Cl2↑ + SO32- + H2O (5)
2J- + H2SO4 → J2 + SO32- + H2O (6)
не наблюдаем, следовательно, в анализируемом веществе, возможно, отсутствуют анионы Cl-,I-.
Проба на присутствие окислителей
Берем смесь Н2SO4 с KI , добавляем несколько кристаллов анализируемого вещества. Выделения свободного йода, который вызывает окрашивание раствора в бурый цвет в соответствии с уравнениями (7-9)не происходит, на основании чего можно сделать предположение об отсутствии в данном веществе анионов NO2- , Fe3+, Cu2+
Химизм процесса:
2J- + 2NO2- + 4H+ → J2 + 2NO + 2H2O (7)
2J- + 2Fe3+ → J2 + 2Fe2+ (8)
4J- + 2Cu2+ → J2 + 2CuJ↓ (9)
Проба на присутствие восстановителей
К небольшой порции анализируемого вещества добавляем смесь разбавленных растворов KMnO4+H2SO4. Обесцвечивание раствора в соответствии с ниже приведенным уравнениями (10-14) не наблюдаем ,что свидетельствует о возможном отсутствии в анализируемом образце NO2-, SO32- , J-, Cl-, Fe2+
2J- + 2NO2- + 4H+ → J2 + 2NO + 2H2O (10)
5SO32- + 2MnO4- + 6H+ → 5SO42- + 2Mn2+ + 3H2O (11)
16H+ + 10J- + 2MnO4- → 5J2 + 2Mn2+ + 8H2O (12)
16H+ + 10Cl- + 2MnO4- → 5Cl2 + 2Mn2+ + 8H2O (13)
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O (14)
Растворение в воде
Анализируемое вещество полностью растворяется в воде. На основании этого можно сделать предположение об одновременном нахождении в растворе ионов Ag, Pb2+,CH3COO-,NO3- (поскольку только с этими анионами, открытый в предварительных испытания катион свинца, полностью растворяется в воде).
Проба на присутствие NH4
В анализируемую смесь добавляем несколько капель едкого натра и нагреваем в пламени газовой горелки, запаха аммиака не чувствуется следовательно анион NH4+ отсутствует.
Проба на Fe2+
В пробирку с анализируемым веществом вносим несколько капель раствора HCl и раствор красной кровяной соли K3[Fe(CN)6] синего окрашивания раствора в соответствии с нижеприведенным уравнением (15) не наблюдаем, следовательно, катион Fe2+ отсутствует.
[Fe(CN)6]3-+ Fe2+→Fe3[Fe(CN)6]2 (15)
Проба на Fe3+
В пробирку с раствором анализируемого вещества прибавляем несколько капель воды и несколько капель концентрированного раствора роданида аммония. Кроваво-красного окрашивания в соответствии с уравнением (16) не наблюдаем, следовательно, катион Fe3+ отсутствует.
Fe3++3CNS-→Fe(CNS)3 (16)
Вывод : по результатам предварительным испытаний можем сделать предположение о присутствии в анализируемой смеси следующих ионов: Pb2+,CH3COO-,NO3-
Систематический анализ
Проба на катионы
Проба на катионы второй аналитической группы
К анализируемому образцу добавляем, несколько капель соляной кислоты HCl наблюдаем, выпадение осадка в соответствии с уравнениями(17,18), что подтверждает возможное присутствие в данном веществе катионов Pb2+,Ag+
Химизм процесса:
Pb2++2HCl→PbCl2↓ (17)
Ag++HCl→AgCl↓ (18)
Проверим образовавшийся осадок на растворение в горячей воде. Добавим к полученному осадку немного горячей воды. Осадок растворяется, следовательно, катион Ag2+ отсутствует.
Для того, чтобы точно удостовериться в присутствии в анализируемом образце катиона Pb2+ проведем следующий опыт. К нескольким каплям раствора анализируемого вещества добавим такое же количество KI. Выпадает желтый осадок (уравнение (19)).
Pb2++2KI→PbI2↓ +2K+ (19)
В пробирку прибавляем несколько капель воды и 2М раствора СН3СООН, нагреваем, при этом осадок растворяется. Погружаем пробирку в холодную воду. Выпадают блестящие золотистые кристаллы в соответствии с уравнением (20).
PbI2 ↓ + CH3COOH→ [PbCH3COO]I+HI. (20)
Таким образом доказали наличие в анализируемом веществе катиона свинца, что согласуется с предварительными испытаниями (проба на окрашивание пламени).
Поскольку катион свинца мешает открытию катионов третьей и первой аналитических групп, необходимо его отделить. Для этого к раствору анализируемого вещества добавим несколько капель 10н HCl, перемешиваем стеклянной палочкой и фильтруем. Промоем осадок водой подкисленной 2н. раствором соляной кислоты (для понижения растворимости хлорида свинца). Фильтрат №1 возможно содержит следующие катионы Ca2+,Ba2+,K+,Na+ ,а также небольшое количество уже открытого катиона Pb2+.Затем к фильтрату добавляем несколько капель раствора сульфата аммония (NH4)2SO4 , нагреваем на кипящей водяной бане несколько минут, даем, немного постоять, и снова фильтруем. Фильтрат№2 возможно содержит катионы К+, Na+ , Ca 2+ .Осадок, содержащий Pb2+ и возможно содержащий катионы Ba2+ , Ca2+обрабатываем, горячим 30% раствором CH3COONH4 до полного удаления PbSO4, фильтруем, осадок промываем дистиллированной водой и переносим в фарфоровую чашку, добавляем несколько миллилитров раствора карбоната калия K2CO3 кипятим несколько минут, нагревая на асбестовой сетке в пламени газовой горелки. После охлаждения в фарфоровую чашку добавляем несколько миллилитров воды, перемешиваем, даем отстояться и прозрачный слой жидкости сливаем. Затем снова добавим карбонат калия K2CO3, опять нагреваем несколько минут, и фильтруем. Осадок промываем теплой водой до полного удаления анионов SO42- . Осадок растворяем в пробирке в небольшой порции уксусной кислоты и промываем небольшим количеством дистиллированной воды. Далее проведем анализ на присутствие катиона Ва2+, для этого к полученному раствору прибавим несколько капель раствора хромата калия K2CrO4 осадка не образуется следовательно катион Ва2+ отсутствует. Проверим полученный раствор на наличие катиона Ca2+ , добавим карбонат натрия, перемешаем стеклянной палочкой, образования осадка не наблюдаем, следовательно, катион Ca2+ отсутствует. Проверим фильтрат№2 на наличие катиона К+ для этого к фильтрату добавим раствор Na3[Co(No2 )6 ] и немного уксусной кислоты, желтого осадка комплексной соли кобальта не образуется следовательно катион К+ отсутствует. Проверим фильтрат № 2 на присутствие катиона Na+, добавим несколько капель раствора KH2SbO4 ,белого кристаллического осадка не образуется, следовательно катион Na+ отсутствует[3]. Для открытия катионов четвертой, пятой и шестой аналитических групп, к фильтрату, оставленному после отделения свинца добавим гидроокись натрия образования осадка не наблюдаем следовательно в анализируемой смеси отсутствуют катионы : Cu2+,Zn2+ ,Al3+,
Mg2+,Cr3+,Ni2+,Co2+
Проба на анионы
Присутствие катиона Pb2+ исключает наличие в анализируемом веществе анионов первой и второй аналитических групп, в противном случае при растворении в воде наблюдалось бы выпадение осадка.
Несмотря на то, что в предварительных испытаниях мы не делали предположение о присутствии аниона NO2- , проверим анализируемую смесь на присутствие данного аниона. Добавим к раствору анализируемой смеси несколько капель раствора Грисса-Илосвая, красного окрашивания раствора не наблюдаем, следовательно анион NO2- действительно в данной смеси отсутствует.
Качественные реакции на анионы третьей аналитической группы
Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается темно-синяя окраска образующегося дифенилбензидина (уравнение (21)):
2(C6H5)2NH C6H5-N –C6H4-C6H4-NH-
C6H5 C6H5-N= C6H4= C6H4=N- C6H5 (21)
По условию задачи в выданной смеси могут присутствовать два аниона. По результатам предварительных испытаний присутствие анионов NO2 –, SO42-, CO32-, SO32-, PO43-,Cl-, I- - исключили, следовательно, в анализируемой смеси присутствует анион CH3COO-, наличие которого подтверждает выделение паров уксуса при действии разбавленной серной кислоты (предварительные испытания уравнение (3)).
На основе вышеперечисленных опытов можно сделать вывод о присутствии в анализируемой смеси катиона Pb2+ и анионов CH3COO-,NO3- .
Проанализировав, экспериментальные данные и предварительные наблюдения, приходим к выводу, что данная смесь состоит из двух солей Pb(NO3)2 и (CH3COO)2Pb.
Проанализируем физические свойства этих соединений .
Ацетат свинца(II) Рb(ОСОСН3)2- бесцветные кристаллы; т. пл. 280 °С; — 960,90 кДж/моль; при плавлении частично испаряется, при более высоких температурах разлагается до Рb, СО2, Н 2О и ацетона. Растворимость в воде (г в 100 г): 29,3 (10 °С), 55,2 (25 °С) и 221,0 (50 °С);
Нитрат свинца Pb(NO3)2, бесцветные кристаллы. При нагревании выше 200°С начинает разлагаться без плавления с выделением NО2 и О2 и последовательным образованием оксонитратов Pb(NO3)2 · 2РbО, Pb(NO3)2, 5РbО и оксида РbО при 500-550 °С. Растворимость в воде (г в 100 г):45,5 (10°С), 58,5 (25°С), 91,6 (60°С) и 116,4 (80°С)[8].
Действительно, выданное вещество, предположительно состоящее из солей Pb(NO3)2 и (CH3COO)2Pb представляет собой смесь бесцветных кристаллов, что согласуется с вышеприведенными справочными данными. Пламя горелки (при проведении пробы на окрашивание племени) окрашивается в бледно-голубой цвет, что свидетельствует о наличии в выданном образце свинца. При прокаливании анализируемое вещество разлагается с выделением желтых паров, соответствующих уравнению(22), это подтверждает наличие в данной смеси нитрата свинца.
Pb(NO3)2 → 2PbO + 2NO2 + O2 (22)
При действии разбавленной серной кислоты на сухой образец наблюдали выделение паров с характерным запахом уксуса, следовательно, в данной смеси присутствует ацетат свинца. Таким образом, сопоставив справочные данные [8], результаты предварительных наблюдений и экспериментальные данные приходим к выводу, что сделанное ранее предположение о составе смеси подтверждается.
2 Расчет теоретической кривой титрования
2.1 Теоретические основы титриметрического анализа
Титриметрический анализ основан на измерении количества (объема или массы) раствора титранта (реактива точно известной концентрации), затраченного на реакцию с определяемым компонентом. Раствор реактива вносят до тех пор, пока его количество не будет эквивалентным количеству определяемого вещества. Применяемый в титриметрическом анализе раствор реактива называют титрованным или стандартным . концентрацию растворов в титриметрическом анализе выражают числом грамм-эквивалентов в литре раствора.
Титриметрические методы подразделяются на две большие группы. В первую группу входят методы, основанные на ионных реакциях: нейтрализация, осаждение и комплексообразование. Во вторую группу входят окислительно-восстановительные методы, основанные на реакциях окисления-восстановления, которые связаны с переходом электронов от одной частицы к другой. Применяемые реакции должны удовлетворять ряду требований. Реакция должна проходить количественно по определенному уравнению без побочных реакций. Реакция должна протекать с достаточной скоростью, поэтому необходимо создать оптимальные условия, обеспечивающие быстрое течение реакции. Установление точки эквивалентности должно производиться достаточно надежно.
Методы нейтрализации. К ним относятся определения, основанные на взаимодействии кислот и щелочей. Методы нейтрализации обычно подразделяют на ацидиметрию (определение оснований), алкалиметрию (определение кислот) и галометрию (определение солей).
Методы осаждения подразделяют на аргентометрию, позволяющую определять путем титрования раствором нитрата серебра, хлориды, иодиды, цианиды, роданиды; на меркурометрию, основанную на титровании раствором нитрата закисной ртути.
Методы комплексообразования основаны на применении реакций, при которых образуются комплексные соединения. Они подразделяются на меркуриметрию, основанную на титровании раствором нитрата ртути(II) при этом образуется малодиссоциированный хлорид ртути (II), комплексонометрию, основанную на применении органических реактивов-комплесонов; фторометрию, основанную на применении NaF.
Методы окисления-восстановления основаны на применении различных окислителей и восстановителей для титрования.
Перманганатометрия. Метод предложен в 1846г. Ф.Маргериттом для титрования растворов солей железа (II).
Броматометрия- метод основанный на окислении раствором KBrO3 в кислой среде.
Цериметрия.1861г. Л.Ланге предложил в качестве окислителя раствор Ce(SO4)2. сульфат церия применяется для титрования многих восстановителей в сильнокислых растворах солей железа(II), мышьяковистой, щавелевой кислот и д.р.
Титанометрия. Соли титана(III) применяются как энергичные восстановители при определении главным образом органических веществ.
Нитритометрия основана на титровании стандартным раствором нитрита натрия. Наиболее часто нитритометрию применяют для определения органических веществ по реакции диазотирования или нитрозирования.
Аскорбинометрия основана на использовании аскорбиновой кислоты как восстановителя. Ее применяют для прямого титрования различных окислителей[6].
2.2 Комплексонометрическое титрование
Комплексонометрия (хелатометрия), титриметрический метод анализа, основанный на образовании прочных внутрикомплексных соединений (хелатов) между катионами металлов и комплексонами. наиболее часто применяют иминодиуксусную, нитрилотриуксусную (комплексон I) и этилендиаминтетрауксусную (комплексон II) кислоты, динатриевую соль последней (комплексон III, ЭДТА), а также 1,2-диаминоциклогексантетрауксусную кислоту (комплексон IV). Широкое использование комплексонов II и III обусловлено тем, что их реакции с катионами металлов протекают полно и в соответствии со стехиометрией, их растворы устойчивы при хранении; эти реагенты доступны и можно получить их препараты высокой чистоты. Конечную точку титрования устанавливают визуально по изменению окраски комплексонометрических индикаторов (металлоиндикаторов), а также потенциометрически, фотометрически, амперометрически или др. методами.
Комплексоны - неизбирательные реагенты. Селективность комплексонов повышают различными приемами: уменьшением рН среды, выделением (осаждением, экстракцией) определяемого иона, маскированием, изменением степени окисления катиона и т.д. [11].
Практическое применение
Высокая устойчивость координационных соединений металлов с Y4- открывает принципиальную возможность титриметрического определения большой группы катионов. Различные способы комплесонометрического титрования могут быть следующим: прямое, обратное, по методу вытеснения и д.р.
При прямом титровании к раствору исследуемого иона небольшими порциями добавляют стандартный раствор комплексона. Значение рН при титровании должно быть больше 7. Но это может вызвать выпадение гидроокисей металлов. Для предупреждения применяют аммиачный буфер (для никеля, меди, цинка и кадмия) и еще добавляют тартраты или цитраты (для марганца и свинца). Так как в точке эквивалентности концентрация определяемого иона резко уменьшается, то эту точку нужно фиксировать по изменению окраски индикатора, образующего внутрикомплексное соединение с катионом металла. Индикатор реагирует на изменение показателя концентрации катиона металла рМе аналогично тому, как рН индикатор реагирует на изменение рН. Таким образом, определяют ионы Са, Sr, Ba, Cu, Mg, Mn, Zn и др. До комплексонометрического метода не существовало достаточно надежных методов анализа соединений содержащих эти металлы.
Обратное титрование применяют тогда, когда рН, необходимое для образования комплекса, вызывает осаждение определяемого металла, а также при отсутствии надежного индикатора на ион металла. Титрованный раствор ЭДТА добавляют в небольшом избытке к раствору анализируемой соли. Устанавливают, вводя буферный раствор, нужный рН. Избыток ЭДТА оттитровывают раствором хлорида магния или хлорида цинка. Точка эквивалентности фиксируется по изменению окраски индикатора. Обратное титрование применяют также. Когда ион металла взаимодействует с ЭДТА или метало индикатором замедленно, например в случае иона никеля. Этот метод применяют в случае, когда прямое титрование невозможно вследствие образования малорастворимых осадков катионов металлов с присутствующими в растворе анионами, например PbSO4,CaC2O4·2H2O. Осадки в процессе титрования должны раствориться.
Титрование путем вытеснения одного катиона другим применяют в том случае, когда не удается подобрать соответствующего индикатора для определяемого иона или же когда катион металла при заданном рН не может быть переведен из осадка в раствор. В этом случае можно соединение с комплексоном получить обменной реакцией при титровании соли определяемого металла раствором соединения какого-либо другого металла с ЭДТА. Например, титруют раствором комплексоната магния или цинка. Для применения этого метода необходимо, чтобы образующееся соединение определяемого металла с комплексоном было прочнее, чем комплексонат магния или цинка[10]. В настоящее время комплексонометрические методики разработаны для анализа очень многих объектов.
Определение жесткости воды было первым практически важным применением ЭДТА в аналитической химии. Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния. Содержание этих элементов определяют прямым титрованием пробы воды в аммонийном буфере 0,01М раствором ЭДТА в присутствии эриохром черного Т. тяжелые металлы предварительно осаждают в виде сульфидов и маскируют цианидом. Жесткость воды обусловленную содержанием солей кальция, можно определить титрованием пробы с мурексидом в щелочной среде.
Комплексонометрическое титрование используют также для анализа различных сплавов, определения сульфатов, фосфатов и других анионов, для анализа органических соединений.
Физико-химические методы установления точки эквивалентности в комплексонометрии[3]
Различные физико-химические методы обычно используют для установления оптимальных условий титрования. Кроме того, с помощью физико-химических методов можно проводить определения элементов, для которых еще не найдены цветные индикаторы. Потенциометрическое титрование комплексоном выполняют с помощью ионоселективных электродов или используют инертные электроды из благородных металлов, реагирующие на изменения окислительно-восстановительного потенциала системы. С помощью биметаллической пары электродов платина-вольфрам можно титриметрически определить свинец, медь, цинк, никель, кадмий и другие элементы. Широко применяют амперометрическое титрование ЭДТА для определения никеля, цинка, кадмия, свинца. Используют кондуктометрическое, фотометрическое, термометрическое и другие виды титрования комплексоном с физико-химической индикацией точки эквивалентности.
2.3 Расчет кривой титрования методом комплексонометрии
Оценить возможность титриметрического определения и построить кривую титрования для следующих данных 0,05М ZnCl2 0,025M Na2H2Y, pH 9, концентрация аммиака 0,1 моль/л.
Запишем уравнение титриметрической реакции:
Zn2++ H2Y2-→ZnY2-+2H+
Расчет кривой титрования сводится к расчету показательной концентрации Zn2+ в зависимости от объема титранта. Устойчивость ZnY2- зависит от кислотности среды (чем выше кислотность, тем ниже устойчивость), в связи с этим для связывания ионов водорода, количественное определение ZnCl2 проводят в среде аммонийного буфера.
Рассчитаем объем титранта по закону эквивалентов:
![]() (1)
(1)
откуда
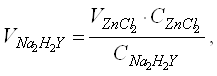 (2)
(2)
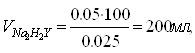
Наличие иона Н+ в среде, где присутствует трилон В, приводит к протеканию следующих конкурирующих реакций:
Y4-+H+ « HY3-, ![]() = K4;
= K4;
HY3-+H+ « H2Y2-, ![]() = K3;
= K3;
H2Y2-+H+
« H3Y-, ![]() = K2;
= K2;
H3Y-+H+
« H4Y, ![]() = K1;
= K1;
где K1, K2, K3, K4 – константы ступенчатой диссоциации H4Y (K1=1,0.10-2, K2=2,1.10-3, K3=6,9.10-7, K4=5,5.10-11)[5].
Рассчитаем условную константу устойчивости, которая выражает прочность комплексов цинка с трилоном В:
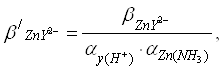 (3)
(3)
![]()
Рассчитаем коэффициенты конкурирующих реакций:
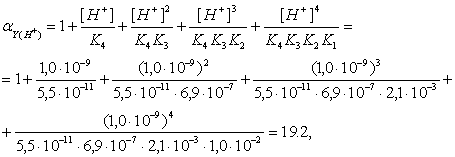 (4)
(4)
Zn2+ участвует также в конкурирующих реакциях образования комплексных соединений с аммиаком NH3 в соответствии со следующими уравнениями реакций:
n2++NH3![]() Zn(NH3)2+,
Zn(NH3)2+,
Zn2++2NH3![]() Zn(NH3)22+,
Zn(NH3)22+,
Zn2++3NH3![]() Zn(NH3)32+,
Zn(NH3)32+,
Zn2++4NH3![]() Zn(NH3)42+,
Zn(NH3)42+,
![]() (5)
(5)
По данным литературного источника[5]
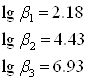
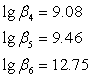
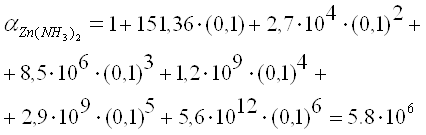
Подставив, выражения (4) и (5) в уравнение константы устойчивости (3) получим:
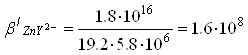
1) до начала титрования, в отсутствии конкурирующих реакций с участием цинка, концентрация ионов Zn2+ равна концентрации соли ZnCl2
ZnCl2 →Zn2++2Cl-
[Zn2+]=C![]() =0.05 моль/л
=0.05 моль/л
2)до точки эквивалентности величина pZn определяется концентрацией неоттитрованного иона цинка уравнение (а), так диссоциацией комплексоната, образующегося по уравнению(б) при избытке ионов цинка можно пренебречь.
а)Zn2++H2Y2-→ ZnY2-+2H+
б)ZnY2- ↔Zn2++Y4-.
![]() дис.
дис.
![]() (6)
(6)
Проведем расчет для точек
![]()
3) В точке эквивалентности расчет концентрации ионов Zn2+ проводится с учетом уравнения реакции диссоциации комплекса:
ZnY2-↔Zn2++Y4-
Данное равновесие количественно описывается константой:
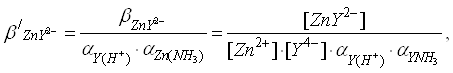 (7)
(7)
[Zn2+] = [Y4-] = x,
[ZnY2-] = [ZnCl2],
![]() ,
,
 ,
,
![]() ,
,
[Zn2+] = 1,8 ∙ 10-5
pZn = 4.7
4)после точки эквивалентности концентрация комплексоната металла остается постоянной
Концентрация ионов лиганда определяется избытком добавленного титранта:
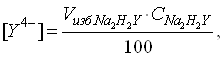 (8)
(8)
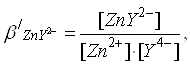 (9)
(9)
откуда :

Для найденных значений [Zn2] и [Y4-] вычисляются значения pZn2+ и pY4- и строится кривая титрования в координатах pZn2+- Vтитранта. Проводится анализ кривой титрования, рассчитывается скачок титрования, выбирается индикатор.
В таблице 3 представлены данные расчета изменений концентрации ионов определяемого вещества и титранта в зависимости от объема добавляемого титранта (при условии что объем раствора в процессе титрования не изменяется).
Таблица 3-Изменение pZn при титровании трилоном Б.
| Ŋ |
VТ,мл |
[Y4-] |
pY4- |
[Zn2] |
pZn2+ |
| 0 | 0 | - | - | 0.05 | 1.3 |
| 0.1 | 20 | - | - | 0.025 | 1.6 |
| 0.2 | 40 | - | - | 0.02 | 1.7 |
| 0,4 | 80 | - | - | 0.015 | 1,8 |
| 0.8 | 160 | - | - | 0.005 | 2.3 |
| 0.9 | 180 | - | - | 0.0025 | 2.6 |
| 0.99 | 198 | - | - | 0.00025 | 3.6 |
| 0.999 | 199.8 | - | - | 0.000025 | 4.6 |
| 1 | 200 | - | - |
1.8.·10-5 |
4.7 |
| 1.001 | 200.2 |
5·10-5 |
4.3 |
3.125·10-6 |
5.5 |
| 1.01 | 202 |
5·10-4 |
3.3 |
3.12·10-7 |
6.5 |
| 1.05 | 210 |
2.5·10-3 |
2.6 |
6.2·10-8 |
7.2 |
| 1.1 | 220 |
5·10-3 |
2.3 |
3.1·10-8 |
7.5 |
| 1.2 | 240 | 0.01 | 2 |
1.5·10-8 |
7.8 |
| 1.8 | 360 | 0.04 | 1.4 |
3·10-9 |
8.4 |
| 2 | 400 | 0.05 | 1.3 |
3.12·10-9 |
8.5 |
Проанализируем полученную кривую. Как видно, в области точки эквивалентности происходит резкое изменение концентрации ионов цинка, которое можно отметить с помощью соответствующего индикатора. Скачок титрования составляет pZn2+=6.5-3,6=2,9, то есть величину достаточную для фиксирования точки эквивалентности. На основании этого можно сделать вывод о возможности комплексонометрического определения цинка в области заданных концентраций.
Индикаторами в комплексонометрии являются металлоидикаторы , образующие с ионами металлов интенсивно окрашенные соединения, константы устойчивости которых, однако, ниже чем константы бесцветных комплексов трилона Б с ионами металлов [3].
Подбор индикатора осуществляется в соответствии с условиями титрования, описанными в справочнике Лурье [5]. Сопоставив условия титрования, представленные в задаче, с данными из справочника [5], приходим к заключению что, в данном случае индикатором является 0,1% водный раствор кислотный хром синий К, обеспечивающий переход окраски из розовой в серо-голубую.
2.4 Определение анионного состава сточных вод
В подавляющем большинстве случаев солевой состав природных вод определяется катионами Са2+, Мg2+, Nа+, К+ и анионами НСO3-, Сl- , SO42-. Эти ионы называются главными ионами воды или макрокомпонентами; они определяют химический тип воды. Остальные ионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды.
По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую.
В природных водах присутствуют также растворенные газы. В основном это газы, которые диффундируют в воды из атмосферы воздуха, такие как кислород, углекислый газ, азот. Но в то же время в подземных водах или водах нецентрализованных источников водоснабжения, в минеральных и термальных водах могут присутствовать сероводород, радиоактивный газ радон, а также инертные и другие газы.
Существует несколько методов определения анионного состава воды.
Метод комплексонометрического титрования[3]
Определение многих анионов основано на осаждении их малорастворимых соединений титрованным раствором какого-либо катиона, избыток которого затем оттитровывается ЭДТА. Сульфат по этой методике осаждают в виде BaSO4 хлоридом бария и последующим комплексонометрическим титрованием избытка ионов Ba2+ по специальной методике. Фосфат осаждают в виде MgNH4PO4 и оставшееся в растворе количество магния определяют комплексонометрически.
Хроматография[8]
Ионная хроматография – метод качественного и количественного определения ионов в растворах. Он позволяет определять неорганические и органические анионы, катионы щелочных и щелочноземельных металлов, катионы переходных металлов, амины и другие органические соединения в ионной форме. Во всем мире ионная хроматография используется чаще других методов, обеспечивая выявление множества компонентов в любой воде. Для проведения анализов используются ионные хроматографы. Основным элементом любого хроматографа является разделяющая аналитическая колонка. Анализ таких неорганических анионов, как фторид, хлорид, нитрит, нитрат, сульфат и фосфат, методом ионной хроматографии многие годы является самым распространенным во всем мире. Кроме ионохроматографических колонок для определения основных не органических анионов разработаны и успешно применяются высокоэффективные колонки, наряду со стандартными анионами они выявляют и оксианионы такие как оксихалиды: хлорит, хлорат, бромат и др.
Аргентометрия.[9]
Аргентометрия (от лат. argentum - серебро и греч. metreo - измеряю), титриметрический метод определения анионов (Hal-, CN-, PO43-, CrO42- и др.), образующих малорастворимые соединения или устойчивые комплексы с ионами Ag+ Исследуемый раствор титруют стандартным раствором AgNO3 или избыток последнего, введенный в анализируемый раствор, оттитровывают стандартным раствором NaCl (т. наз. обратное титрование).
В методе Мора индикатором служит раствор К2СrО4, образующий с Ag+ при рН 7-10 осадок Ag2CrO4 красного цвета; метод применим для определения хлоридов и бромидов. В методе Фаянса применяют адсорбционные индикаторы ( флуоресцеин, эозин), которые адсорбируются на поверхности осадка, изменяя его цвет. Для определения галогенидов часто применяют метод Фольгарда. В этом случае к исследуемому раствору добавляют избыток раствора AgNO3
Определение гидрокарбонат-ионов[4]
При одновременном присутствии в воде ионов HCO3- и CO32- определение ведут в одной пробе, нейтрализуя рабочим раствором соляной кислоты щелочность, создаваемую этими ионами. Щелочностью называют содержание в воде веществ, вступающих в реакцию с сильными кислотами, т.е. с ионами водорода. Расход кислоты выражает общую щелочность. В обычных природных водах щелочность зависит, как правило, только от гидрокарбонат-ионов щелочноземельных металлов. В этом случае значение рН воды не превышает 8,3. Общая щелочность практически тождественна карбонатной жесткости и соответствует содержанию гидрокарбонатов.
Карбонат ионы содержаться в щелочных водах. Обычно питьевая вода не содержит карбонатов. На это указывает отсутствие розовой окраски от прибавления к пробе фенолфталеина. В этом случае в воде определяют только гидрокарбонаты титрованием кислотой в присутствии метилоранжа.
Определение нитритов[6]
Присутствие в незагрязненных поверхностных водах нитритных ионов связано главным образом с процессами минерализации органических веществ и нитрификации. Аммонийные ионы под действием особого вида бактерий окисляются до нитритных ионов:
NH4+ + OH - + 2/3O2 = H + + NO2- + 2 H2O
В поверхностных водах нитритный азот находится главным образом в виде нитритных ионов. В кислых водах может присутствовать некоторое количество HNO2. Нитриты не обладают сильно выраженной способностью к комплексообразованию.
Реакция взаимодействия диазонитрованной в присутствии нитритов сульфаниловой кислоты с ароматическими аминами является одной из самых чувствительных реакций, с помощью которых могут быть обнаружены очень малые (единицы мкг/л) количества нитритных ионов. Нитритные ионы - неустойчивые вещества, определение которых должно производиться вскоре после отбора. Пробы предварительно фильтруют через мембранный фильтр 0,45 мкм. Если анализ не может быть выполнен немедленно, пробу консервируют добавление 2-4 мл хлороформа на 1 л воды и хранят при температуре 3-5о С в течение 1-3 суток.
Заключение
1.Курсовая работа включает пояснительную записку, изложенную на 38 страницах, содержащую 3 таблицы и графическую часть на формате А1, содержащую блок-схему идентификации неизвестного вещества и кривую титрования.
2.Изучены основные приемы и методы качественного и количественного анализа. В соответствии с ними произведен анализ выданного образца. Показано, что анализируемый образец представляет собой смесь двух солей Pb(NO3)2 и (CH3COO)2Pb.
3.Рассмотрены методы титриметрического анализа. Более подробно рассмотрен метод комплексонометрического титрования.
Произведен расчет и построение кривой титрования методом комплексонометрического титрования -0,05 M ZnCl2 0.025M Na2H2Y, рН 9,С(NH3)=0.1 моль/л. Аналитическая характеристика кривой титрования: показано, что кривая титрования имеет явный перегиб вблизи точки эквивалентности, что дает основание на возможность применения данного метода анализа (для заданных условий). Точка эквивалентности соответствует значению рZn = 4.7. В области точки эквивалентности происходит резкое изменение концентрации ионов Zn2+, которое можно отметить с помощью соответствующего индикатора (кислотный хром синий К).
Список использованных источников информации
1.Алексеев В.Н. Качественный химический полумикроанализ. M.: Химия. 1973.
2.Воскресенский А.Г , Солодкин И.С. практическое руководство по качественному полумкроанализу.1972-133с.
3. Васильев В.П. Аналитическая химия: В 2 кн.: Кн.1: Титриметрические и гравиметрические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец.- 4-е изд., стереотип.- М.: Дрофа, 2004. – 368с.:ил.
4. Кольтгоф И. М., Сендэл Е. Б., Количественный анализ, пер. с англ., 3 изд., М.-Л., 1948, с. 496
5.Лурье Ю.Ю. Справочник по аналитической химии.- М.: Химия, 1979. – 480с.
6. Семенов А.Д, М.М. Евстифеев, Ю.М. Гаврилко. Методические указания
к практикуму “Анализ объектов окружающей среды” Определение биогенных элементов в природных водах . г. Ростов-на-Дону -2001-17c
7. Сильченко Л.А., Пашаян А.А. Аналитическая химия и физико-химические методы анализа. Методические указания по выполнению курсовой работы для студентов II курса специальности 330200”Инженерная защита окружающей среды”(часть II) – Брянск, БГИТА, 2005.- 58с.
8. Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 95
9. Рыбакова Е.В. Ионная хроматография –современный метод анализа всех типов вод/ Е.В. Рыбакова// Экология и промышленность России.- 2000.- №13.- с.34-36
10.Шемякин Ф.М. аналитическая химия. Изд.3-е, испр. и доп. Учебник для фармацевтических вузов. М., «Высш.школа». 1973
11. Шварценбах Г, Флашка Г., Комплексонометрическое титрование, пер. с нем.