
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Исследование системы гемостаза при экстракорпоральном оплодотворении
Курсовая работа: Исследование системы гемостаза при экстракорпоральном оплодотворении
Введение
В настоящее время перед современной медициной остро стоит проблема мужского и женского бесплодия. Бесплодие в браке имеет не только клиническое, но и социальное и психологическое значение. По данным ВОЗ, во всем мире более 8 % супружеских пар бесплодны, что при экстраполяции на человечество означает от 50 до 80 миллионов мужчин и женщин, которые не имеют детей, и каждый год их число увеличивается в среднем на 2 млн. пар. Нарушения в женском организме являются причиной невозможности иметь потомство в 40 % случаев. Остальные 60% распределяются так: в 40 % имеется патология со стороны мужчин, еще 20% комбинированные причины. Для решения данной проблемы в настоящее время все шире используется метод экстракорпорального оплодотворения (ЭКО) с последующим переносом эмбрионов (ПЭ) в полость матки. Потребность в нем высока: он назначается 50-60% супружеских пар, обращающихся в специализированные клиники по поводу бесплодия.
ЭКО сопровождается мощным гормональным воздействием на организм женщины. Известно, что половые гормоны оказывают влияние на систему гемостаза. Поскольку в ответ на стимуляцию в яичниках созревает большое количество фолликулов, продуцирующих половые гормоны, главным образом, эстрадиол, концентрация которого в циклах стимуляции во много раз выше, чем в спонтанном, естественном цикле, логично ожидать, что на фоне стимуляции могут возникать выраженные изменения в системе гемостаза.
Целью данной работы является исследование системы гемостаза при ЭКО как единственном методе решения проблемы бесплодия.
Задачи:
1. Исследование сосудисто – тромбоцитарного гемостаза;
2. Исследование коагуляционного гемостаза;
3. Исследование антикоагулянтного звена гемостаза.
1. Бесплодие
Лечение бесплодия в условиях катастрофической демографической ситуации - одна из наиважнейших проблем медицины. 9% семейных пар репродуктивного возраста сталкиваются с проблемой бесплодия.
Бесплодие в браке - отсутствие беременности при регулярной половой жизни без применения противозачаточных средств в течение 1 года. Выделяют женское (60%) и мужское (40%) бесплодие.
При лечении бесплодия у женщин различают три типа:
1. Абсолютное бесплодие - возможность беременности полностью исключена (отсутствие матки, яичников, аномалии развития половых органов).
2. Первичное - ни одной беременности у женщины, живущей половой жизнью без контрацепции.
3. Вторичное - отсутствие зачатия после имевшейся в прошлом беременности.
У мужского и женского бесплодия может быть множество причин. Перед лечением необходимо определить их.
Выяснив на основе анализов причину бесплодия, можно приступать к лечению. Сначала обычно применяют медикаментозное лечение, нередко требуется оперативное (хирургическое) вмешательство. К сожалению, эти методы не всегда дают положительные результаты.
В случае неэффективности обычных способов лечения бесплодия, могут быть применены вспомогательные репродуктивные технологии: ИКСИ (интрацитоплазматическая инъекция сперматозоида) и ЭКО - экстракорпоральное оплодотворение.
1.2 Экстракорпоральное оплодотворение (ЭКО)
ЭКО — экстракорпоральное оплодотворение — метод преодоления бесплодия, предполагающий взятие яйцеклетки из организма женщины, оплодотворение вне тела, помещение оплодотворенной яйцеклетки в организм женщины.
Метод экстракорпорального оплодотворения или оплодотворения "в пробирке" на сегодняшний день является самым эффективным методом лечения бесплодия, помогающим даже в самых безнадежных ситуациях. Он применяется в случае непроходимости или отсутствия маточных труб, при мужском факторе бесплодия, при эндометриозе, патологии яичников, бесплодии неясной причины и иных заболеваниях.
Одна попытка экстракорпорального оплодотворения дает вероятность зачатия в среднем 20-45%, что даже несколько выше средней частоты наступления беременности обычным путем. Вероятность зачатия в программе ЭКО зависит от возраста супругов, состояния их здоровья, качества применяемых препаратов и материалов, числа и качества полученных эмбрионов, и некоторых других факторов. Неудача в одной попытке ЭКО еще не означает, что данный метод оказался неэффективен. Почти 95% бесплодных пар могут забеременеть при проведении им нескольких попыток ЭКО.
1.2.1 Этапы программы ЭКО
1. Определение программы и тактики лечения после проведения предварительного обследования;
2. Подготовка супругов, коррекция гормональных отклонений, лечение инфекций и нарушений сперматогенеза;
3. Стимуляция суперовуляции, ультразвуковой мониторинг (10-30 дней);
4. Введение гормонов (чХГ) для окончательного созревания яйцеклеток (1 день);
5. Пункция фолликулов, забор яйцеклеток, сдача спермы. Оплодотворение яйцеклетки спермой супруга или донора (1 день);
6. Культивирование эмбрионов, наблюдение за дроблением эмбрионов (2-5 дней);
7. Перенос эмбрионов в полость матки, замораживание оставшихся эмбрионов при необходимости (1 день);
8. Гормональная поддержка беременности ранних сроков (до 10-14 недель);
9. Тест на беременность по присутствию гормона чХГ в крови (через 2 недели после переноса эмбрионов);
10. УЗИ - диагностика беременности (через 3 недели после переноса эмбрионов);
11. Ведение беременности. Роды (в условиях родильного дома).
1.2.2 Стимуляция суперовуляции
Чтобы вероятность наступления беременности в одной попытке ЭКО была выше, необходимо получить несколько пригодных для оплодотворения яйцеклеток. С этой целью перед процедурой ЭКО проводится так называемая стимуляция суперовуляции, когда женщине назначают лекарства (например, препараты, содержащие ФСГ), вызывающие одновременное созревание нескольких фолликулов.
1.2.3 Мониторинг
Во время стимуляции суперовуляции проводится ультразвуковой мониторинг роста фолликулов в яичнике и созревания эндометрия в матке. Это нужно для корректировки дозы вводимых препаратов. С одной стороны, необходимо получить достаточное количество зрелых яйцеклеток, но с другой стороны, избыточная стимуляция может привести к осложнениям. Зрелым считается фолликул, достигший 17-20 мм в диаметре при толщине слизистой матки (эндометрия) больше 7 мм.
Мониторинг проводится на второй-третий день цикла. Тогда же назначаются стимулирующие препараты. Следующее исследование роста фолликулов повторяется приблизительно через пять дней. В дальнейшем исследования проводятся чаще и почти ежедневно до достижения фолликулами размеров, близких к овуляторным. При достижении определенных критериев, обычно на 10-14 день цикла, принимается решение об окончании стимуляции, и назначаются препараты чХГ.
1.2.4 Введение чХГ
Препараты человеческого хорионического гонадотропина (чХГ) вводятся с целью окончательного созревания яйцеклетки. Путь введения - внутримышечный.
Через 35-36 часов после инъекции чХГ проводят пункцию.
1.2.5 Пункция
Пункция фолликулов яичника проводится с целью получения яйцеклеток.
В день пункции проводят оплодотворение. Сперму мужа или донора очищают от лишней плазмы и готовят для оплодотворения, проверяя количество, качество и подвижность сперматозоидов.
Полученную после пункции яичников фолликулярную жидкость с яйцеклетками изучают под микроскопом, находят яйцеклетки, отбирают их и отмывают. Каждую яйцеклетку кладут в отдельную луночку специальной чашки с питательной средой.
Затем часть спермы добавляют в чашечки с яйцеклетками, после чего оставляют в инкубаторе приблизительно на 12 часов. На следующий день проверяют, произошло ли оплодотворение. Оплодотворенные яйцеклетки, а точнее, уже эмбрионы, продолжают культивировать в течение от 2 до 5 дней.
1.2.6 Перенос эмбрионов в полость матки
Перенос эмбрионов происходит на 2-5 день после пункции. Эмбрионы могут переносить как на стадии нескольких клеток - бластомеров, так и на более поздней стадии - бластоцисты.
В среднем переносится 2-3 эмбриона, поскольку подсадка большего числа эмбрионов нежелательна из-за опасности развития многоплодной беременности. Оставшиеся качественные эмбрионы можно подвергнуть замораживанию и использовать в случае неудачи в следующих попытках.
1.2.7 14 – день после переноса эмбрионов
Через две недели после переноса эмбрионов исследуют кровь на бета-субъединицу хорионического гонадотропина (ХГ), который является индикатором беременности.
Беременность, определенная по ХГ, называется "биохимической беременностью". Ее еще нужно подтвердить на УЗИ, которое позволяет увидеть плодное яйцо, только начиная с 3 недели после переноса эмбриона. Поэтому на 3-4 неделе после подсадки проводят УЗИ диагностику беременности.
1.3 Система гемостаза при лечении бесплодия методом ЭКО
Мощное гормональное воздействие на организм женщины, осуществляемое в ходе реализации программы ЭКО оказывает огромное влияние на систему гемостаза. Для оценки степени данного влияния исследовали систему гемостаза на основных этапах реализации программы ЭКО.
Для исследования сосудисто - тромбоцитарного гемостаза проводили следующие анализы:
1. Подсчитывают количество тромбоцитов;
2. Определяют концентрацию фактора Виллебранда (ФВ).
Для оценки прокоагулянтной активности плазмы крови определяли:
1. Протромбиновое время;
2. Активированное частичное тромбопластиновое время;
3. Тромбиновое время;
4. Концентрацию фибриногена.
Антикоагулянтное звено гемостаза исследовали, определяя:
1. Активность АТIII;
2. Активность протеина С.
1.4 Система гемостаза
Система гемостаза - это совокупность функционально-морфологических и биохимических механизмов, обеспечивающих остановку кровотечения и вместе с тем поддерживающих кровь в жидком состоянии преимущественно внутри сосудов. Система гемостаза обособлена, подобно другим жизненно важным системам организма (сердечно-сосудистой, дыхательной, эндокринной и др.), и находится с ними в тесной взаимосвязи и во взаимовлиянии. Однако она зависит главным образом от функций паренхиматозных и ретикулярных стволовых клеток костного мозга и печени.
Функционально-морфологическими и биохимическими компонентами системы гемостаза являются: сосудистая стенка, тромбоциты, система свертывания крови, включающая свертывающую и противосвертывающую системы. Компоненты гемостаза выполняют следующие функции: регулируют сосудистую резистентность и препятствуют попаданию избыточного количества плазмы и крови в стенки сосудов и за их пределы; останавливают спонтанные кровотечения и кровоизлияния в ткани и после повреждения сосудов; устраняют последствия постоянного латентного внутрисосудистого свертывания, тромбообразования и геморрагий; поддерживают кровь в жидком состоянии, обеспечивая тем самым многие процессы нормального кровообращения и тканевого метаболизма; активно участвуют в реакциях иммунологической защиты организма.
Различают два основных типа гемостаза. l-й тип - микроциркуляторный, сосудисто-тромбоцитарный, или первичный, гемостаз, так как он начинает все реакции гемостаза в капиллярах, венозных и артериальных сосудах до 100 мкм в диаметре. 2-й тип - макроциркуляторный (вторичный) гемостаз, как правило, начинается на основе первичного и следует за ним. Благодаря вторичному гемостазу образуется красный кровяной тромб, состоящий главным образом из фибрина и форменных элементов крови.
1.5 Сосудисто – тромбоцитарный (первичный) гемостаз
Стенка капилляра образована эндотелием, базальной мембраной и адвентицией.
Базальная мембрана капилляра состоит из аморфного вещества, представленного в основном гиалуроновой кислотой и коллагеновыми волокнами.
В синтезе гиалуроновой кислоты принимают активное участие катехоламины (адреналин, норадреналин), витамины С, Р, ионы Са2+, глюкокортикоиды. При достаточном количестве этих веществ создается структурно и функционально полноценная сосудистая стенка. Функциональная полноценность сосудистой стенки и эндотелия проявляется прежде всего в скорости их сокращения в ответ на травму и способности противостоять механическому воздействию. Это - первая и самая быстрая первичная реакция гемостатической системы.
В капиллярах и других сосудах микроциркуляторного русла сосудистый спазм, значительно снижающий объем кровопотери, длится 2-3 минуты, затем наступает дилатация поврежденного сосуда. Вследствие этого должно было бы возобновиться кровотечение. В норме этого не случается, так как сосудистый компонент гемостаза подкрепляется тромбоцитарным.
Уже в первые секунды после травмы происходит адгезия (прилипание) тромбоцитов к краям поврежденного эндотелия и коллагеновым волоконцам. Под влиянием АДФ, которая выделяется из поврежденного сосуда и при гемолизе эритроцитов, тромбоциты склеиваются друг с другом (наступает их агрегация) как у места поврежденного сосуда, так и в кровотоке. В результате адгезии и начальной агрегации тромбоцитов из них выделяются серотонин, адреналин и АДФ (собственная АДФ тромбоцитов). Это - реакция освобождения первого порядка. АДФ способствует агрегации пластинок, а серотонин и адреналин усиливают сокращение поврежденной сосудистой стенки.
Адреналин и АДФ, а также находящиеся в плазме Са2+, Mg2+, фибриноген и другие плазменные факторы усиливают агрегацию тромбоцитов. Однако эта реакция обратима у большинства пластинчатых агрегатов. Прилипая друг к другу и к адгезированным тромбоцитам, они все же могут отрываться и уноситься в кровоток. Таким путем идет дезагрегация, скорость которой также во многом определяет наклонность к кровоточивости или тромбообразованию.
Наряду с процессами адгезии и агрегации тромбоцитов из поврежденных тканей и эндотелия выделяется тканевый тромбопластин (IП фактор свертывания). При его взаимодействии с VП, IV, Х и V факторами, а затем и с протромбином (фактором П) образуется тромбин. Следов тромбина недостаточно для свертывания крови, но благодаря ему начинаются важные реакции первичного гемостаза: тромбин действует на агрегаты тромбоцитов, переводит обратимую агрегацию тромбоцитов в необратимую; необратимая агрегация сопровождается реакцией освобождения второго порядка, вследствие которой возникают гидролазы, АДФ в высокой концентрации и вазоактивные вещества (серотонин, адреналин, норадреналин). Благодаря воздействию этих веществ формируется белый тромбоцитарный, или первичный, тромб. Из-за недостатка VП, V, Х факторов и протромбина будет нарушаться первичный гемостаз. После образования первичного тромба полностью блокируется кровотечение из сосудов микроциркуляции.
Таким образом, гемостаз в сосудах микроциркуляции осуществляется в основном клеточными (эндотелием, тромбоцитами) и сосудистым факторами. Свертывающая система крови не успевает включиться в полном объеме, а следы тромбина, обеспечивающего необратимую агрегацию, появляются вследствие быстрой активации тканевого тромбопластина (тканевый, или внешний, путь образования протромбиназы).
Поэтому первичный гемостаз будет нарушен при: изменениях сосудистой стенки (дистрофические, иммуноаллергические, неопластические и травматические капилляропатии); тромбоцитопении; тромбоцитопатии; сочетании этих факторов.
Сформировавшийся белый тромбоцитарный тромб, который подвергся вязкому метаморфозу и ретракции, надежно стягивает края поврежденного микрососуда, противостоит его дилатации и не пропускает жидкую часть крови.
В сосудах более крупного калибра, чем капилляры (венулах и артериолах), несмотря на их более длительный спазм (до двух часов), образовавшийся тромбоцитарный тромб не в силах противостоять расхождению краев поврежденного сосуда при его дилатации - белый тромб разрывается. Если этого не происходит, то даже неразрушенный пластиночный тромб в сосудах с повышенным кровяным давлением ненадежен, так как пропускает, словно сито, плазму и форменные элементы. И кровотечение хотя и медленно, но будет продолжаться. Поэтому для окончательного надежного гемостаза в поврежденных крупных венах и артериях первичного тромба недостаточно. У здоровых людей в таких случаях на первичном (белом) тромбоцитарном тромбе образуется красный.
1.4.1 Фактор Виллебранда
ФВ - -плазменный кофактор адгезии тромбоцитов.
Уровень ФВ прогрессивно возрастал с первых дней стимуляции. Это связано с высвобождением ФВ из эндотелиальных клеток вследствие длительного воздействия на них повреждающих факторов - высоких концентраций половых гормонов. Дополнительным условием повышения ФВ является, очевидно, имплантация (наступление беременности), связанная с нарушением целостности сосудов эндометрия. По-видимому, в процессе стимуляции суперовуляции у пациенток программы ЭКО фактор Виллебранда может являться неспецифическим маркером повреждения сосудистого эндотелия вследствие резкого повышения уровня половых гормонов в крови.
В нашем городе исследование фактора Виллебранда не проводится.
1.5 Коагуляционный гемостаз
Процесс свертывания крови - многоступенчатая ферментная реакция, в которой принимает участие ряд белков, обозначаемых как факторы свертывания крови (табл. 1).
Таблица. 1. Международная номенклатура факторов свертывания крови
| Факторы | Синонимы | Содержание в плазме, г/л | Полупериод распада (в часах) |
| I | Фибриноген | 1,8-4,0 | 72-120 |
| II | Протромбин | около 0,1 | 48-96 |
| III | Тканевый тромбопластин | 0 | - |
| IV | Ионы кальция | 0,09-0,10 | - |
| V | Проакселерин | Около 0,01 | 15-18 |
| VII | Проконвертин | Около 0,005 | 4-6 |
| VIII | Антигемофильный фактор А | 0,01-0,02 | 7-8 |
| IX | Кристмас-фактор | Около 0,003 | 15-30 |
| X | Фактор Стюарт-Проуэра | Около 0,01 | 30-70 |
| XI | Антигемофильный фактор С | Около 0,005 | 30-70 |
| XII | Фактор Хагемана | Около 0,03 | 50-70 |
| XIII | Фибриназа | 0,01-0,02 | 72 |
| Дополнительные | |||
| Фактор Виллебранда | фВ | 18-30 | |
| Фактор Флетчера | Прекалликреин | - | |
| Фактор Фитцджеральда | Кининоген | - | |
Одни из этих белков являются протеазами (факторы II, VII, IX, Х, ХI, XII, XIII), другие - акцелераторами (ускорителями) ферментных реакций (факторы V и VIII), третьи - конечным субстратом процесса (фактор I, или фибриноген). Взаимодействие факторов свертывания крови, их активация, а затем и инактивация почти на всем протяжении процесса происходят на плазменных фосфолипидных мембранах, от количества которых в плазме зависит либо ускорение, либо существенное замедление процесса свертывания.
Синтез ряда наиболее важных факторов свертывания (факторов V, VII, X, IX и II), а также двух основных физиологических антикоагулянов - протеинов С и S - осуществляется паренхиматозными клетками печени - гепатоцитами, причем для того, чтобы они могли участвовать в процессе свертывания крови, все эти факторы, кроме фактора V, должны подвергнуться γ-карбоксилированию витамин-К-зависимой карбоксилазой. Поэтому при дефиците витамина К и нарушении его всасывания из кишечника (при кишечном дисбактериозе, обтурации общего желчного протока), а также под влиянием непрямых антикоагулянтов (кумаринов, фенилина), являющихся функциональными антагонистами витамина К, нарушается синтез всех витамин К-зависимых факторов свертывания, а также протеинов С и S, вследствие чего может возникнуть тяжелая кровоточивость, сочетающаяся в некоторых случаях с микротромбированием сосудов и некрозами тканей из-за недостатка антикоагулянта - протеина С.
Такое же нарушение свертываемости крови наблюдается и при тяжелых заболеваниях печени, но при этом снижается уровень в крови не только всех витамин К-зависимых факторов свертывания, но и фактора V, а также альбумина.
Различают три этапа процесса свертывания крови
Первый этап завершается активацией фактора X в так называемом протромбиназном комплексе, в состав которого входят, наряду с фактором X, фактор V, ионы кальция и фосфолипидные матрицы. Активация факторов в этом комплексе может осуществляться двумя путями: внешним и внутренним. Запуск внешнего реализуется поступлением из тканей в кровь тканевого тромбопластина (или тканевого фактора - ТФ). Свертывание по этому механизму, который в пробирке имитируется добавлением к плазме тканевого тромбопластина, обозначается как протромбиновый (тромбопластиновый) тест. Коагуляция в нем происходит очень быстро, в течение 12-15 с.
Другим механизмом запуска процесса свертывания крови является внутренний путь. Он связан с контактом крови с субэндотелием (коллагеном), а также с разрушенными эритроцитами (при внутрисосудистом гемолизе), а в пробирке - с контактом со стеклом. При этом механизме последовательно активируются в комплексах «фактор XII (фактор Хагемана) + прекалликреин + фактор XI», а затем «фактор XI + фактор IX + фактор VIII», после чего процесс, как и в предыдущем механизме, замыкается на активации фактора X с образованием протромбиназного комплекса. Внутренний механизм первого этапа свертывания протекает намного медленнее, чем внешний. Он определяется общим временем свертывания крови, временем рекальцификации цитратной плазмы и активированным парциальным тромбопластиновым временем (АПТВ).
В отличие от пробирочных опытов в организме оба указанных выше механизма свертывания крови не строго изолированы друг от друга, а взаимодействуют между собой.
Второй этап свертывания крови заключается в активации протромбиназным комплексом (т. е. фактором Ха в комплексе с фактором Va + Ca2+ + фосфолипидная матрица) протромбина, который, расщепляясь, превращается в активный тромбин (фактор IIa). Таким образом, второй этап процесса свертывания завершается образованием активного тромбина.
На третьем этапе процесса этот активный тромбин отщепляет от α- и β -цепей фибриногена два пептида А и два пептида В, в результате чего в плазме крови повышается содержание этих пептидов и одновременно - мономеров фибрина (МФ) с четырьмя свободными связями. Вслед за этим начинается процесс полимеризации МФ - образование их димеров, затем тетрамеров и, в конечном счете - волокон и сгустков фибрина.
гемостаз бесплодие экстракорпоральный оплодотворение
1.5.1 Протромбиновое время
Протромбиновое время (синоним время Квика) - показатель интенсивности процессов свертывания крови на стадии превращения протромбина в тромбин, представляющий собой продолжительность (в секундах) образования сгустка исследуемой плазмы крови в присутствии тромбопластина и солей кальция.
ПВ - скрининг-тест для определения факторов (фибриногена, протромбина, факторов V, VII и X), участвующих в свертывании крови, инициированном высокой концентрацией тканевого фактора.
1.5.2 Активированное частичное тромбопластиновое время
Скрининг-тест для определения факторов (фибриногена, протромбина, факторов V, VIII,IX, X, XI, XII, прекалликреина и высокомолекулярного кининогена), участвующих в свертывании крови при контактной активации. Скрининговый фосфолипидзависимый тест, дающий представление о нарушениях, связанных с эффектом волчаночного антикоагулянта – ВА.
1.5.3 Тромбиновое время
Тромбиновое время - показатель активности антитромбинов крови; определяется по продолжительности свертывания исследуемой плазмы (до образования сгустка) после добавления к ней стандартного раствора тромбина.
ТВ - скрининг-тест последней стадии свертывания крови – реакции между тромбином и фибриногеном – антикоагулянтной активности антитромбина III
1.5.4 Фибриноген
Фибриноген – гликопротеид с молекулярной массой около 340000 дальтон.
Молекула фибриногена представляет собой димер, каждая единица которого содержит три полипептидные цепи –α (А), β (В) и γ с молекулярной массой соответственно 67000, 58000 и 47000 дальтон. Общая формула молекулы фибриногена: (α(А), β(В) γ)2. целостность этой молекулы во многом определяется дисульфидными связями.
Фактор I в том виде, в каком он вырабатывается паренхиматозными клетками печени и поступает в кровь, получил название фибриногена А. Под действием тромбина фибриноген превращается в нерастворимый в крови фибрин, составляющий основу тромба.
1.6 Противосвертывающие механизмы и система фибринолиза
В свертывающей системе крови действуют силы как аутокатализа, или самоускорения, так и самоторможения, в силу чего многие факторы свертывания крови и их фрагменты приобретают свойства антикоагулянтов. В частности, сам фибрин и продукты расщепления фибриногена плазмином обладают противосвертывающим действием.
Однако наиболее важны для поддержания крови в жидком состоянии так называемые первичные, т. е. самостоятельно синтезируемые и постоянно находящиеся в крови, антикоагулянты (табл. 2).
Таблица 2. Основные первичные антикоагулянты
| Наименование | Механизмы действия |
|
Ингибитор внешнего пути свертывания крови (TFPI) Тромбомодулин «Контактные ингибиторы» (фосфолипидный, плацентарный) Антитромбин III (AT III) Гепарин и другие кислые мукополисахариды Протеин С Протеин S а2-макроглобулин |
Синтезируемый в эндотелии белок, инактивирующий комплекс «ТФ+фактор Vila+фактор Ха» Гликопротеин мембраны эндотелиальной клетки, связывающий и инактивирующий тромбин, в комплексе с которым тромбин сохраняет способность активировать протеин С Подавляют пусковой механизм внутреннего пути свертывания крови (комплекс факторов XIIa-XIa и калликреина) Прогрессивно действующий ингибитор тромбина, фактора Ха и в меньшей степени других протеаз, участвующих в свертывании крови В комплексе с AT III действуют как мощные антикоагулянты Синтезируемый гепатоцитами витамин К-зависимый ингибитор факторов Villa и Va, эндогенный активатор плазминогена. Активируется тромбином и комплексом «тромбин+тромбомодулин» Синтезируемый гепатоцитами витамин К-зависимый кофактор протеина С; активируется так же, как и протеин С Слабый ингибитор комплекса «ТФ+фактор Vila», тромбина, плазмина и калликреина |
Помимо перечисленных в табл. 2 важнейших физиологических антикоагулянтов, в патологических условиях в крови могут появляться в высоком титре иммунные ингибиторы факторов свертывания крови - антитела к факторам VIII, IX и другим, а также к фосфолипидным матрицам, на которых взаимодействуют и активируются факторы свертывания крови (антифофолипидный синдром).
Фибринолитическая (плазминовая) система, как и система свертывания крови, активируется как по внешнему, так и по внутреннему механизму.
Наиболее мощным внешним активатором этой системы является продуцируемый в эндотелии, а также в ряде тканей тканевый плазминогеновый активатор (ТПА), на долю которого приходится около 70% всего активаторного эффекта. Еще около 15% внешнего механизма активации приходится на фермент урокиназу, который вырабатывается в почках и в наибольшей своей части выделяется с мочой, а в кровь попадает в значительно меньшем количестве. На остальные активаторы, поступающие в кровь извне, приходится лишь небольшая часть указанной активности, но в патологических условиях она может быть резко усилена тканевыми и лейкоцитарными протеазами, бактериальными активаторами (стрептокиназой, стафилокиназой и др.) и другими экзогенными протеолитическими ферментами (протеазами змеиных ядов и др.).
Внутренний механизм активации фибринолиза осуществляется в основном комплексом «фактор XIIа+калликреин+высокомолекулярный кининоген» (так называемый XIIа - калликреин зависимый фибринолиз), активированными протеинами C+S.
Механизмы активации фибринолиза замыкаются на плазминогене, который трансформируется в активный фермент – плазмин (в прошлом он обозначался как фибринолизин).
Плазминоген и его активаторы фиксируются в основном на сгустках фибрина в тромбах, в связи с чем лизис фибрина преобладает над лизисом растворенного в плазме фибриногена. Кроме того, действию плазмина на фибриноген препятствует содержащийся в плазме мощный ингибитор этого фермента – а2-антиплазмин. Однако при чрезвычайно сильной активации плазминогена происходит истощение а2-антиплазмина, и в плазме крови обнаруживается большое количество продуктов как фибринолиза, так и фибриногенолиза. Эти продукты не идентичны друг другу. В результате расщепления фибриногена в плазме нарастает количество конечного продукта этого процесса - фрагмента D, тогда как при расщеплении фибрина увеличивается концентрация фрагментов D-D (димера) и D-E-D.
Путем раздельного определения концентрации в плазме фрагментов D и D-димеров можно получить представление, в какой степени у больного активированы фибринолиз и фибриногенолиз. Более того, при проведении таких анализов учитывается, что для нарастания в крови продуктов фибринолиза, т. е. D-димера, должно раньше произойти свертывание крови - образование фибрина, а затем его расщепление до фрагмента D-D. Поэтому увеличение концентрации в плазме D-димера служит ценным показателем как интенсивного внутрисосудистого свертывания крови, так и сопряженного с этим процессом фибринолиза. Такое нарастание содержания в крови D-димера является важным маркером массивного тромбоза кровеносных сосудов, тромбоэмболии, диссеминированного внутрисосудистого свертывания крови.
1.6.1 Антитромбин III
Антитромбин III (АТ III) является а2-глобулином с молекулярной массой около 64000. Синтезируется в печени. Выполняет роль основного плазменного кофактора гепарина, под влиянием которого трансформируется из прогрессивного антикоагулянта в ингибитор немедленного действия.
Инактивирует тромбин, факторы ХIIа, XIa, Ха, IXa, калликреин и фибринолизин.
1.6.2 Протеин С
Физиологический антикоагулянт, в активированном состоянии инактивирует активные V, VII факторы, ингибирует активатор плазминогена (активность проявляется преимущественно в микроциркуляторном русле).
Активность протеина С кратковременно увеличивалась к 5-7 дню стимуляции, что связано с действием половых гормонов.
В нашем городе активность протеина С не определяется.
1.7 Осложнения
У определенного процента женщин в ходе реализации программы ЭКО и ПЭ возникает такое осложнение, как СГЯ (синдром гиперстимуляции яичников). По выраженности симптомов и уровню половых гормонов СГЯ подразделяют на легкую, среднюю и тяжелую формы. Распространенность умеренных и тяжелых форм СГЯ составляет от 1 до 10%. Тяжелые проявления сопровождаются кровотечением, асцитом, гидротораксом, нарушением баланса электролитов, печеночно-почечной недостаточностью, тромбоэмболией и поэтому рассматриваются, как один из основных рисков при реализации программы ЭКО и ПЭ.
Была выявлена прямая зависимость между тяжестью течения СГЯ и выраженностью изменений, свидетельствующих об активации во всех звеньях системы гемостаза.
У пациенток с риском развития СГЯ рекомендуется проводить исследования системы гемостаза несколько раз в период с момента переноса эмбрионов до дня первичной диагностической беременности с целью своевременного назначения противотромботической терапии и контроля за ее проведением.
2. Материалы и методы исследования
2.1 Материалы исследования
Для исследования системы гемостаза были обследованы 10 пациенток в возрасте 26 – 33 лет на всех основных этапах реализации программы ЭКО и ПЭ (стимуляция, день введения ХГ, день ПЭ, 14-й день после ПЭ). Показатели гемостаза исследовали в плазме крови.
Сосудисто-тромбоцитарный гемостаз оценивали по количеству тромбоцитов. Для подсчета тромбоцитов использовали агрегометр АР 2110.
Для оценки изменений прокоагулянтной активности плазмы крови определяли ПВ, АПТВ, ТВ и концентрацию фибриногена на гемокоагулометре CGL 2110.
Антикоагулянтное звено гемостаза оценивали с помощью определения активности АТ III на гемокоагулометре CGL 2110.
Необходимо отметить, что на 14 день после переноса эмбрионов у пациенток проводили определение β-ХГ для выяснения вопроса о наступлении беременности (эффективности программы).
В ходе обследования десяти пациенток был получен следующий результат: у семи женщин наступила беременность (эффективный цикл); у трех женщин – отсутствие беременности (неэффективный цикл).
2.2 Методы исследования сосудисто – тромбоцитарного гемостаза
2.2.1 Определение количества тромбоцитов
Состав набора: адреналин; растворитель для адреналина, 8,5 мл – во флаконе.
Оборудование, материалы, реагенты: пипетки вместимостью 0,05 – 2,0 мл; физиологический (0,9%) раствор хлорида натрия.
Приготовление анализируемых образцов: венозную кровь центрифугируют при 1000 об/мин (240 g) в течение 7 мин. Богатую тромбоцитами плазму переносят в другую пробирку и повторно центрифугируют при 3000 об/мин (1200g) в течение 15 мин., в результате получают бедную тромбоцитами плазму.
Разведение адреналина: во флакон с адреналином внести 8,0 мл растворителя для адреналина и развести содержимое при комнатной температуре путем встряхивания в течение 10 мин. В результате получают маточный раствор адреналина (500 мкг/мл).
Для приготовления рабочего раствора адреналина из маточного пользуются следующей схемой:
| Номер раствора с адреналином |
Физиологический(0,9%) раствор хлорида натрия |
Разведение маточного раствора | Конечная концентрация при агрегометрии (0,45 мл плазмы + 0,05 мл раствора адреналина) |
| 1 | 4,9 мл + 0,1 мл маточн. раствора | 1:50 | 10 мкг/мл |
| 2 | 1,0 мл + 1,0 мл из раствора 1 | 1:100 | 5 мкг/мл |
| 3 | 1,0 мл + 1,0 мл из раствора 2 | 1:200 | 2,5 мкг/мл |
Запись агретограмм проводят в соответствии с инструкцией к агрегометру. С помощью растворов адреналина разной концентрации получают запись кривых агрегации тромбоцитов. Наряду с кривыми агрегации на экране отображается количество тромбоцитов в исследуемой плазме. В норме количество тромбоцитов составляет 140 – 400*109/л
2.3 Методы исследования коагуляционного гемостаза
2.3.1 Определение протромбинового времени (Техпластин – тест)
Принцип метода: тромбопластин (фактор III, тромбокиназа) превращает протромбин плазмы крови в присутствии ионов кальция в активный фермент тромбин, трансформирующий фибриноген плазмы крови в нерастворимый фибрин. Измеряется протромбиновое время – время образования фибрина в плазме крови в присутствии ионов кальция и тканевого тромбопластина (растворимого экстракта из мозга человека).
Состав набора: техпластин – лиофильно высушенная тромбопластин-кальциевая смесь, на 5,0 мл суспензии – 4 фл. МИЧ Техпластина в разных сериях составляет 1.1 или 1.2.; контрольная плазма – лиофильно высушенный пул плазмы крови не менее, чем от 20 здоровых людей, на 0,5 мл – 1фл.
Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1; 0,2; 0,5; 5,0 мл; вода дистиллированная.
Приготовление анализируемых образцов: венозную кровь центрифугируют при 3000 – 4000 об/мин (1200 g) в течение 15 мин. Получают бедную тромбоцитами плазму.
Подготовка реагентов к работе:
Разведение Техпластина: в один флакон с Техпластином внести 5,0 мл дистиллированной воды. Флакон встряхнуть и выдержать при +370С в течение 20 мин.
Разведение контрольной плазмы: во флакон с контрольной плазмой внести 0,5 мл дистиллированной воды и растворить содержимое при комнатной температуре и легком покачивании в течение 3 мин. Разведенную плазму перед исследованием выдержать 25-30 мин. при комнатной температуре.
Проведение анализа:
Определение контрольных (нормальных) показателей:
1. В кювету коагулометра внести 0,1 мл контрольной плазмы.
2. Инкубировать при температуре + 370С 1 мин.
3. Добавить 0,2 мл разведенного Техпластина, имеющего температуру +370С и начать отсчет времени свертывания до образования фибрина.
Аналогично определить протромбиновое время в образцах плазмы больных.
В норме протромбиновое время, измеренное на коагулометре, составляет 12-15 с.
Рассчитывают протромбиновый индекс по следующей формуле:
ПТИ = (ПВ контрольной нормальной плазмы /ПВ больного) x 100%
В норме ПТИ составляет 85 – 105%.
2.3.2 Методы определения АЧТВ ((АПТВ/АЧТВ) – тест)
Принцип метода: определяется время свертывания плазмы крови в условиях стандартизированной контактной (каолином) и фосфолипидной (кефалином) активации процесса в присутствии ионов кальция.
Состав набора: кефалин (лиофильно высушенный фосфолипидный компонент) – 2 фл.; каолин (концентрированная суспензия 200:1 в дистиллированной воде), 1 мл – 1 фл.; буфер трис НСl (концентрированный 20:1 раствор, 1 М), 10 мл – 1 фл.; кальция хлорид (концентрированный 20:1 раствор, 5 М), 10 мл – 1 фл.
Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1; 5,0 мл; вода дистиллированная; цилиндр мерный вместимостью 200 мл.
Приготовление анализируемых образцов: венозную кровь центрифугируют при 1000 об/мин (240 g) в течение 7 мин. Богатую тромбоцитами плазму переносят в другую пробирку и повторно центрифугируют при 3000 об/мин (1200g) в течение 15 мин., в результате получают бедную тромбоцитами плазму.
Подготовка реагентов к работе:
Разведение кефалина: в один флакон с кефалином внести 2,0 мл дистиллированной воды и растворить содержимое при комнатной температуре и энергичном покачивании в течение 2 мин. В результате получают раствор кефалина, который до использования должен быть выдержан при комнатной температуре в течение 60 мин.
Приготовление АПТВ – реагента: концентрированный буфер трис НСl и концентрированную суспензию каолина количественно перенести из флаконов в мерный цилиндр и общий объем довести дистиллированной водой до 200 мл. В результате получают рабочую суспензию каолина. Для приготовления AЧТВ - реагента смешать в пробирке 0,1 мл раствора кефалина с 3,0 мл рабочей суспензии каолина.
Приготовление рабочего раствора хлорида кальция: в день исследования, в соответствии с потребностью, концентрированный раствор хлорида кальция развести дистиллированной водой в 20 раз (1 объем концентрированного раствора + 19 объемов воды).
Проведение анализа:
1. В кювету коагулометра внести 0,1 мл исследуемой плазмы и прогреть ее при +370С в течение 1 мин.
2. В кювету добавить 0,1 мл AЧТВ - peaгeнтa, имеющего комнатную температуру.
3. Через 3 мин к смеси добавить 0,1 мл рабочего раствора хлорида кальция и зарегистрировать время свертывания.
AЧТВ в нормальной плазме составляет 28-38 с.
2.3.3 Определение тромбинового времени (Тромбо – тест)
Принцип метода: заключается в определении времени свертывания плазмы крови под влиянием тромбина стандартной активности.
Состав набора: тромбин (лиофильно высушенный, 6-8 ед NIH во фл.) - 4 фл.; контрольная плазма (лиофильно высушенная) - 1 фл.
Оборудование, материалы, реагенты: коагулометр; пипетки вместимостью 0,1 - 1,0, 10,0 мл; вода дистиллированная;
Приготовление анализируемых образцов: венозную кровь центрифугируют при 3000 – 4000 об/мин (1200 g) в течение 15 мин. получают бедную тромбоцитами плазму.
Подготовка реагентов к работе:
Разведение тромбина: в один из флаконов с тромбином внести необходимое количество дистиллированной воды (см. таблицу) и растворить содержимое при комнатной температуре и легком покачивании в течение 2-3 мин.
Ориентировочные значения нормы тромбинового времени свертывания
| Объем дистиллированной воды на флакон с тромбином, мл |
Время свертывания, сек., при коагулометрическом определении |
| 2,0 | 11-14 |
| 3,0 | 15-19 |
| 5,0 | 20-29 |
Разведение контрольной плазмы: во флакон с контрольной плазмой внести 0,5 мл дистиллированной воды и растворить содержимое при комнатной температуре и легком покачивании в течение 3 мин.
Проведение анализа:
1. В кювету коагулометра внести 0,1 мл контрольной плазмы и прогреть ее при +370С в течение 1 мин.
2. В ту же кювету добавить 0,1 мл раствора тромбина и зарегистрировать время свертывания.
Исследование плазмы больного выполняется аналогично.
Чтение результатов: результат выражают в секундах, сравнивают время свертывания контрольной и исследуемой плазмы. В норме ТВ составляет 14 – 17 с.
2.3.4 Определения концентрации фибриногена (Квик – Фг – тест)
Принцип метода: образовавшийся после свёртывания плазмы крови фибрин быстро высушивается и по его весу определяется содержание фибриногена в плазме.
Состав набора: тромбопластин, 1 г – 2 фл.; хлорид кальция (концентрированный 20:1 раствор, 5,54%), 10 мл – 6 фл.; буфер трис – НСl (концентрированный 20:1 раствор, 1 М), 10 мл – 2 фл.
Оборудование, материалы, реагенты: термобаня на 370; весы торсионные; центрифуга лабораторная; пробирки стеклянные; цилиндр мерный вместимостью 200 мл; ступка фарфоровая с пестиком; вода дистиллированная; бумага фильтровальная.
Приготовление анализируемых образцов: кровь центрифугируют при 3000 – 4000 об/мин (1200g) в течение 15 мин. Получают бедную тромбоцитами плазму.
Приготовление реагентов:
Приготовление суспензии тромбопластина: навеску сухого тромбопластина (50 мг) поместить в фарфоровую ступку, добавить 1,0 мл физиологического (0,9 %) раствора хлорида натрия или раствора трис – буфера (0,05 М, pH 7,4) и тщательно растирать в течение 2 мин. Затем дополнительно добавить в ступку 4,0 мл выбранного раствора, перемешать с помощью пестика и взвесь центрифугировать при 1000 об/мин (240 g) в течение 5-6 мин. Надосадочную жидкость слить в другую пробирку и использовать для анализа.
Разведение концентрированного буфера: содержимое одного флакона с концентрированным буфером трис – НСl перенести в мерный цилиндр и довести объем дистиллированной водой до 200 мл. Получаем рабочий раствор буфера.
Проведение анализа:
1. В пробирке последовательно смешать 1,0 мл исследуемой бедной тромбоцитами плазмы крови, 0,1 мл суспензии тромбопластина и 0,1 мл 5, 54 % раствора хлорида кальция.
2. Пробирку встряхнуть и поместить на водяную баню при +37оС на 10 мин.
3. Образовавшийся в результате инкубации сгусток перенести на фильтровальную бумагу и высушивают путём сжатия и перемещения сгустка по фильтру.
4. Сгусток фибрина выдержать на открытом воздухе при комнатной температуре в течение 15 – 20 мин и взвесить на торсионных весах.
В норме масса сгустка, полученного из 1 мл плазмы крови, составляет 10 – 20 мг. Содержание фибриногена в г/л находят при умножении массы сухого фибрина на коэффициент 0,2. В норме содержание фибриногена в плазме составляет 2,0 – 4,0 г/л.
2.4 Методы исследования антикоагулянтного гемостаза
2.4.1 Определение активности антитромбина III
Принцип метода: исследуемую плазму обрабатывают сорбентом гепарина, подвергают тепловой дефибрикации и смешивают со стандартным количеством тромбина. После инкубации смеси в ней определяют остаточную коагуляционную активность тромбина. По уровню снижения активности тромбина оценивают активность АТ III в исследуемой плазме.
Оборудование и материалы: коагулометр; набор реагентов для определения активности антитромбина III ООО Технология – Стандарт.
Проведение анализа: в пробирку вносят 0,4 мл раствора тромбина и прогревают на водяной бане (37оС) в течение 2 мин. Параллельно в кювету коагулометра вводят 0,15 мл разведённой плазмы (или раствора фибриногена) и инкубируют при t 37оС не менее 1 мин.
К раствору тромбина в пробирку добавляют 0,1 мл исследуемой адсорбированной и дефибринированной плазмы, включают секундомер. Через 2 минуты (точно!) инкубируют при той же температуре 0,1 мл смеси, вносят в кювету коагулометра, содержащую разведённую контрольную плазму и начинают отсчёт времени свёртывания. По калибровочной кривой, построенной с применением коагулометра, определяют активность АТ III в процентах. В норме активность АТ III составляет 80 – 120%.
3. Результаты и их обсуждение
3.1 Исследование сосудисто–тромбоцитарного гемостаза
Результаты исследования сосудисто – тромбоцитарного гемостаза представлены на рис. 1.
Общее количество тромбоцитов не менялось на протяжении всей стимуляции, достоверно увеличиваясь только к 14 дню после переноса эмбрионов.
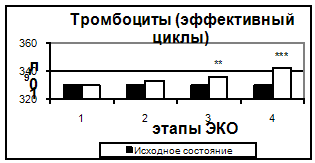

Рис. 1. Количество тромбоцитов в эффективных и неэффективных циклах. Здесь и на рис. 2-6 1- стимуляция суперовуляции, 2- день введения хорионического гонадотропина, 3- день переноса эмбриона в полость матки, 4- 14–ый день после переноса эмбриона. Достоверность отличий:
3.2 Исследование коагуляционного гемостаза
Результаты исследования коагуляционного гемостаза представлены на рис. 2-5.
Концентрация фибриногена постепенно возрастала, начиная с 5-7 дня стимуляции до дня ПЭ, и сохранялась на уровне в 1,4 раза превосходящем исходный до 14 дня после ПЭ.
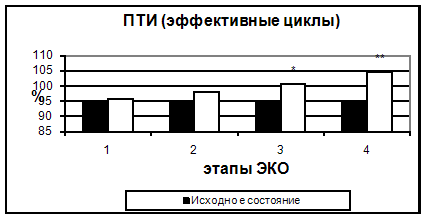
Рис. 2. Протромбиновый индекс в эффективных и неэффективных циклах.
Также, начиная с 5-7 дня стимуляции, было отмечено достоверное укорочение тромбинового времени. Увеличение протромбинового индекса и укорочение АЧТВ, свидетельствующие о повышении активности факторов внешнего и внутреннего пути свертывания, происходило только к 14 дню. Можно предположить, что полученные изменения являются результатом длительного воздействия высоких концентраций половых гормонов.
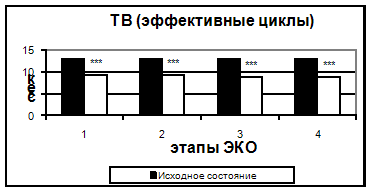
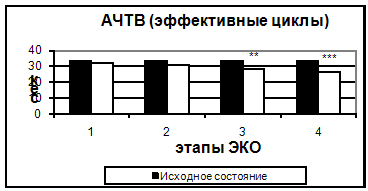
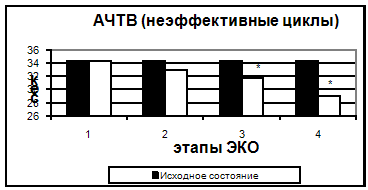
Рис. 3. АЧТВ в эффективных и неэффективных циклах.
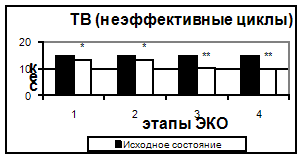
Рис 4. Тромбиновое время в эффективных и неэффективных циклах.
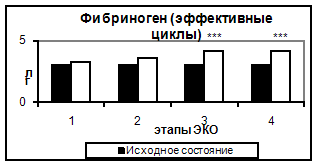
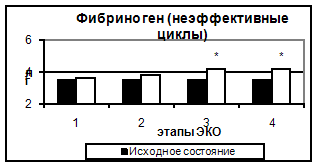
Рис. 5. Концентрация фибриногена в эффективных и неэффективных циклах.
Таким образом, в результате проведения стимуляции суперовуляции происходит усиление коагуляционного потенциала крови за счет увеличения концентрации основного субстрата свертывания крови – фибриногена и повышения суммарной активности факторов, составляющих как внешний, так и внутренний путь активации гемостаза.
3.2 Исследование антикоагулянтного звена гемостаза
Результаты исследования антикоагуляционного гемостаза представлены на рис. 6.
АТ III практически не изменялся на всем протяжении исследования. Отмечалось лишь достоверное снижение активности АТ III (на 5,1%) ко дню введения овуляторной дозы ХГ (пик стимуляции и уровня эстрадиола).
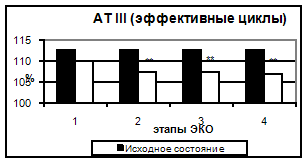
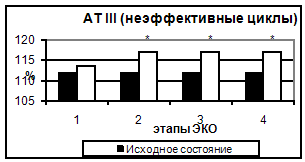
Рис. 6. АТ III в эффективных и неэффективных циклах.
На фоне наступившей беременности и высокого уровня половых гормонов поддерживаются более значимые изменения гемостазиологических показателей, что может неблагоприятно влиять на развивающуюся беременность. При увеличении коагулятивной активности крови можно наблюдать нарушение (снижение) кровотока в матке, что затрудняет нормальное развитие эмбриона. По-видимому, у пациенток с наступившей беременностью в циклах ЭКО и ПЭ на 14 день после переноса эмбрионов развивается состояние, потенциально опасное для развития тромботических осложнений и ДВС-синдрома. Тем не менее, и в случае отсутствия беременности при ЭКО и ПЭ большинство параметров значительно отличались от исходного уровня.
Выводы
В результате исследования были отмечены следующие изменения в системе гемостаза:
1. Усиление прокоагулянтных свойств сосудистого эндотелия,
2. Наиболее выраженные изменения претерпевают такие лабораторные параметры гемостаза, как:
а. повышение уровня фибриногена,
б. укорочение тромбинового времени.
3. У данных больных развитие беременности сопряжено с повышенным риском.