
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Дипломная работа: Фотометричне визначення вуглеводів в горілках
Дипломная работа: Фотометричне визначення вуглеводів в горілках
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ХІМІЧНИЙ ФАКУЛЬТЕТ
ДИПЛОМНА РОБОТА
на тему:
ФОТОМЕТРИЧНЕ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ В ГОРІЛКАХ
Студент: Фатеєва Оксана Ігорівна
Спеціальність: 8.070301 "Хімія"
/шифр, назва/
Затверджена наказом № 212/03 від 17.02.2007 року
Керівник: к.х.н., доц. Петренко О.П.
Донецьк — 2007
ЗМІСТ
Вступ
1 Огляд літературних джерел
1.1 Класифікація вуглеводів
1.1.1 Класифікація за будовою
1.1.2 Класифікація за хімічними властивостями
1.1.3 Класифікація за споживчими особливостями
1.2 Вміст вуглеводів у спиртних напоях
1.2.1 Незброджені цукри рослинної сировини
1.2.2 Використання вуглеводів у рецептурах спиртних напоїв
1.3 Вимоги до вмісту цукрів у спиртних напоях згідно нормативним документам
1.4 Методи аналізу спиртних напоїв на вміст вуглеводів
1.4.1 Титриметричний метод визначення вуглеводів
1.4.2 Спектрофотометричні методи
1.4.3 Хроматографічні та електрофоретичні методи аналізу
1.4.4 Рефрактометричне визначення цукрів та загального екстракту
1.4.5 Порівняльна характеристика методів аналізу
2 Експериментальна частина
2.1 Техніка безпеки
2.2 Прилади та реактиви
2.3 Фотометричне визначення вуглеводів з антроновим реагентом та пікриновою кислотою
2.4 Дослідження впливу етанолу на визначення цукрів
2.4.1 Дослідження впливу етанолу на визначення цукрів з антроновим реагентом
2.4.2 Дослідження впливу етанолу на визначення цукрів з пікриновою кислотою
2.5 Оптимізація умов проведення фотометричних реакцій
2.6 Чутливість реакцій до індивідуальних вуглеводів
2.7 Порівняння результатів визначення цукрів двома фотометричними методами (антроновий реагент та пікринова кислота)
2.8 Оцінка збіжності, відтворюваності та правильності результатів аналізу
2.9 Вплив вмісту вуглеводів на показники якості горілчаних виробів
Висновки
Література
Вступ
Вуглеводи використовують у лікеро-горілчаному виробництві для збільшення асортименту горілок в процесі розробки рецептур та для покращення органолептичних показників напоїв. Традиційно в виробництві горілки використовували цукор та мед. Останнім часом на лікеро-горілчаному ринку з’явились вироби, до складу яких входять інгредієнти з лікувально-профілактичними властивостями, в тому числі такі, що містять різні вуглеводи, наприклад лактозо-лактулозні суміші, фруктозу, мальтозу та інші, які сприяють обміну речовин та виконують роль біопротекторів при вживанні алкоголю. Вміст вуглеводів в горілках не нормується Державним стандартом, проте контролюється на різних етапах технологічного процесу виготовлення напоїв.
Крім того, при введенні до рецептур маловживаних до цього часу вуглеводів, важливо проконтролювати показники якості виробів протягом гарантійного терміну зберігання, тобто визначити, як добавки впливають на стійкість готової продукції.
З іншого боку, під стійкістю розуміють як сталий склад напою, так і незмінну кількість самих інгредієнтів, які також можуть зазнати хімічних перетворень під час зберігання напоїв.
В зв’язку з зазначеним, актуальним є розробляння доступних, досить чутливих методів контролю різних вуглеводів в горілках та горілках особливих, бо більшість існуючих методик для визначення вуглеводів призначені для визначення значних кількостей цукру у винах, коньяках, лікеро-горілчаних напоях.
1. Огляд літературних джерел
1.1 Класифікація вуглеводів
Вуглеводи широко розповсюджені в тваринному та рослинному світі та складають до 80 % загальної сухої маси рослин.
Підсолоджувачі досить широко використовують при розробці рецептур нових виробів. Серед них слід виділити синтетичні та природні речовини, так звані цукрозамісники, так як з хімічної точки зору вони не є сахаридами. Далі більш детально про склад вуглеводів [1].
1.1.1 Класифікація за будовою.
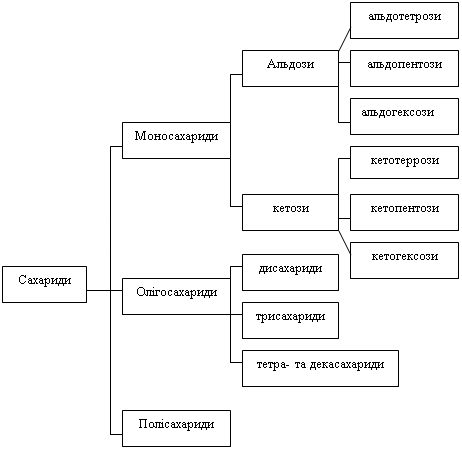 Більш повною та правильною класифікацію є розділення
сахаридів на моно-, ди- та полісахариди.
Більш повною та правильною класифікацію є розділення
сахаридів на моно-, ди- та полісахариди.
1.1.2 Класифікація за хімічними властивостями
Всі вуглеводи ділять на дві групи: прості та складні. Простими вуглеводами (моносахариди, монози) називають вуглеводи, які не спроможні гідролізуватися з утворенням більш простих сполук. Звичайно їх склад відповідає формулі СnН2nОn, тобто число атомів вуглеводу дорівнює числу атомів кисню. Складні вуглеводи (полісахариди, поліози) – вуглеводи, спроможні гідролізуватися на більш прості. В них число атомів вуглеводу не рівне числу атомів кисню. Складні вуглеводи досить різноманітні за складом, молекулярною масою, а також за властивостями. Їх ділять на дві групи: низькомолекулярні цукровоподібні та олігосахариди (від грец. Оligos – малий, небагаточисельний та високомолекулярний) – не цукровоподібні полісахариди. Останні – сполуки з великою молекулярною масою, до складу яких можуть входити залишки сотень тисяч простих вуглеводів [2].
1.1.3 Класифікація за споживчими особливостями
Моносахариди. Молекули простих вуглеводів – моноз – побудовані із нерозгалужених вуглець-вуглецевих ланцюгів, які містять різне число атомів вуглецю. До складу рослин та тварин входять головним чином монози з 5 та 6 вуглецевими атомами – пентози та гексози.
![]()



Особливе місце в перетворенні моносахаридів займають два процеси: дихання та бродіння.
Дихання – це екзотермічний процес ферментативного окислення моноз до води та вуглекислого газу:
![]() С6Н12О6
+ 6О2 6СО2 + 6Н2О
С6Н12О6
+ 6О2 6СО2 + 6Н2О
На кожний моль витраченої глюкози (180г) виділяється 2870 кДж (672 ккал) енергії. Дихання поряд із фотосинтезом є важливим джерелом енергії для живих організмів.
Спиртове бродіння, яке протікає під впливом мікроорганізмів, відіграє велику роль в виробництві спирту та вина, та виробництві хліба.
Поряд з головними продуктами – спиртом та діоксидом вуглецю – при спиртовому бродінні моноз утворюються різноманітні побічні продукти (гліцерин, янтарна кислота, оцтова кислота, ізоаміловий та ізопропіловий спирти та інші), які дуже сильно впливають на смак та аромат продуктів.
ГЕКСОЗИ. Головними представниками цієї групи моноз є глюкоза та фруктоза.
Глюкоза (виноградний цукор, декстроза) широко розповсюджена в природі: знаходиться в зелених частинах рослин, в виноградному соці, насінні та фруктах, ягодах і меді.
Вона входить до складу важливих полісахаридів: сахарози, крохмалю, клітчатки, багатьох глюкозидів. Отримують глюкозу гідролізом крохмалю та клітчатки. Зброджується дріжджами.

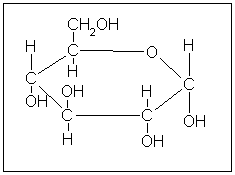
Фруктоза (фруктовий цукор) в вільному стані знаходиться в зелених частинах рослин, нектарі квітів, насінні і меді. Вона входить до складу сахарози, утворює високомолекулярний полісахаридний інсулін. Зброджується дріжджами. Отримують із сахарози, інсуліну, трансформацією інших моноз, методами біотехнології.

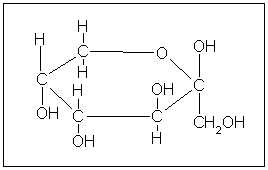
Глюкоза та фруктоза відіграють велику роль в харчовій промисловості, і є важливим компонентом продуктів харчування та вихідним матеріалом при бродінні.
Маніт

ПЕНТОЗИ. В природі широко розповсюджені L (+)-арабіноза, рібоза, ксилоза, головним чином, в якості структурних компонентів складних полісахаридів.
Рибоза – важливий структурний компонент рибонуклеїнових кислот.

D (+) Ксилоза – структурний компонент, який знаходиться в соломі, деревині полісахаридів ксилозанів.
Отриману при гідролізі ксилозу використовують в якості підсолоджуючої речовини для хворих діабетом.
Арабіноза
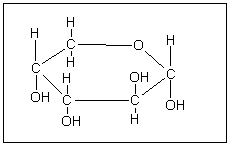
ПОЛІСАХАРИДИ утворюються при гідролізі складних вуглеводів. В залежності від цього їх ділять на низькомолекулярні та високомолекулярні полісахариди. Особливе значення мають дисахариди, молекули яких побудовані з двох однакових або різних залишків моноз. Одна молекула моноз завжди приймає участь в побудові молекули дисахаридів своїм полуацетальним гідроксидом, друга – полуацетальним або одним із спиртових гідроксидів. Якщо в утворенні молекули дисахариду монози приймають участь своїми полуацетальними гідроксидами, утворюється невідновлюючий дисахарид, в другому – відновлюючий. Це одна із головних характеристик дисахаридів. Найважливіша реакція дисахаридів – гідроліз (складні вуглеводні). Молекули полісахаридів побудовані із різноманітного числа залишків моноз, які утворюються при реакції:
|
|
Більш детально розглянемо будову та властивості мальтози, сахарози, лактози, які широко розповсюджені в природі та відіграють велику роль в харчовій промисловості.
Мальтоза (солодовий цукор). Молекула мальтози складається із двох залишків глюкози. В її утворенні приймає участь полуацетальний гідроксид однієї з молекул глюкози та спиртовий (знаходиться у четвертого вуглеводного атому) другої. Як наслідок, вона є відновлюючим дисахаридом.
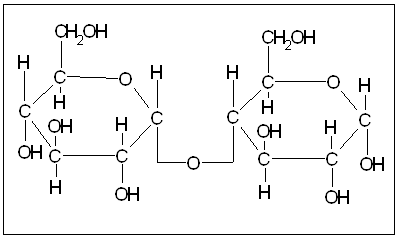
|
Мальтоза досить широко розповсюджена в природі. Вона міститься в пророслому зерні та особливо в великих кількостях в солоді та солодових екстрактах. Звідси її назва (від лат. maltum – солод). Мальтоза утворюється при неповному гідролізі крохмалю розведеними кислотами або амілолітичними ферментами, і є одним з основних компонентів крохмальної патоки, яка широко використовується в харчовій промисловості. При гідролізі мальтози утворюються дві молекули глюкози:
|
|
Сахароза (тросниковий цукор, буряковий цукор). При її гідролізі утворюється глюкоза та фруктоза:
|
|
|
Молекула сахарози складається із залишків глюкози та фруктози. В побудові молекули сахарози глюкоза та фруктоза приймають участь своїми полуацетальними гідроксидами. Сахароза – не відновлюючий цукор:
|
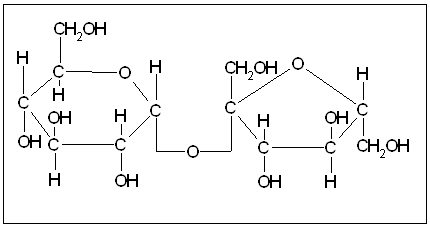
Сахароза – найбільш відомий цукор, який широко використовується в споживанні та харчовій промисловості. Міститься в листях, стовбурах, насінні, плодах, коренях. В цукровому буряці від 15 до 22 % сахарози, цукровому тросниці 12 – 15 %. Це основні джерела її отримання, звідси вона і отримала свої назви – тросниковий або буряковий цукор. Сахароза кристалізується без води в виді великих моноклінічних кристалів. Гідроліз сахарози отримав назву інверсії, а суміш утворюваних різних кількостей глюкози та фруктози – інвертним цукром. Сахароза зброджується дріжджами (після гідролізу), а при нагріванні вище температури плавлення (160-186 ºС) карамелізується, тобто перетворюється в суміш складних продуктів (карамельна С24Н36О18, карамелена С36Н50О25 та інших), втрачаючи при цьому воду. Ці продукти під назвою “колер” використовують при виготовленні напоїв та коньячному виробництві для забарвлення готової продукції. Лактоза (молочний цукор). Молекула лактози складається із залишків галактози та глюкози та має відновлюючі властивості:
|

Лактозу отримують із молочної сироватки (відходи при виробництві масла та сиру). В коров’ячім молоці знаходиться 4 – 6% лактози. Звідси й виникла її назва (від лат. lactium – молоко). Лактоза не гігроскопічна. Не бере участі в спиртовому бродінні, під впливом молочнокислих дріжджів гідролізується з наступним збродженням утворюваних продуктів в молочну кислоту (молочнокисле бродіння).
Високомолекулярні не цукровоподібні полісахариди утворюються з великого числа (до 6-10 тис.) залишків моноз. Вони діляться на гомополісахариди, побудовані із молекул моносахаридів тільки одного виду (крохмаль, глікоген, клітчатка), гетерополісахариди, які складаються із залишків різноманітних моносахаридів [3].
1.2 Вміст вуглеводів у спиртних напоях
1.2.1 Незброджені цукри рослинної сировини [4,5,6]
У процесі спиртового бродіння з глюкози утворюються два головних продукти – етиловий спирт, діоксид вуглецю – а також проміжні вторинні продукти.
Склад та вміст домішок залежить від виду та якості сировини, від прийнятих технологічних режимів її переробки.
Найбільша кількість домішок (0,35-0,45% до кількості етилового спирту) припадає на долю спиртів – метилового, ізопропілового, ізобутилового, пропілового, ізоамілового. Ці спирти, крім метилового, складають основну сивушну фракцію.
Інша частина (0,05-0,1 об %) складається із альдегідів, ефірів, диацетилів, ацетонів. Взагалі визначено 12 альдегідів, які містять від 2 до 12 атомів вуглеводів. Всі ці сполуки впливають на смак та аромат готової продукції. Домішки етилового спирту утворюються, в основному, на стадії бродіння, при перегонці та ректифікації спирту. Кількісний склад домішок залежить від вмісту вуглеводної сировини. Різні цукри зброджуються з різною швидкістю. Найбільш легко бродять глюкоза і фруктоза, повільніше – маноза і галактоза; пентози дріжджами не зброжуються. Сахароза є гарним субстратом спиртового бродіння, але лише після гідролізу на складові моноцукри за допомогою 3-фруктофуранозидази (інвертази), яка завжди присутня у дріжджах.
Дріжджі мають здатність зброджувати дуже високі концентрації цукру – до 60 %. Вони витримують також високі концентрації спирту – до 14-16 % об. При цьому токсична дія спирту збільшується з підвищенням температури. У присутності кисню спиртове бродіння припиняється і дріжджі одержують енергію шляхом кисневого дихання (утворюється 686 ккал тепла). Так як цей процес енергетично більш вигідний, ніж процес бродіння (56 ккал тепла), то дріжджі при бродінні витрачають цукор значно ощадливіше.
![]() С6Н12О6 2С2Н5ОН
+ 2СО2
С6Н12О6 2С2Н5ОН
+ 2СО2
При спиртовому бродінні одержана піровиноградна кислота піддається розщепленню під дією ферменту піруватдекарбоксилази на вуглекислий газ і оцтовий альдегід, який під дією ферменту алкогольдегідрогенази (коферментом його є НАД) відновлюється в етиловий спирт за рівнянням
![]()
![]() СН3-СО-СООН СО2
+СН3СНО СН3-СН2ОН
СН3-СО-СООН СО2
+СН3СНО СН3-СН2ОН
Механізм утворення вторинних продуктів спиртового бродіння розкритий ще не повністю. Утворення гліцерину може бути пояснене за ІІ формою бродіння Нейберга, що називається гліцеропіровиноградним:
глюкоза → гліцерин → оцтовий альдегід → вуглекислий газ
1.2.2 Використання вуглеводів у рецептурах спиртних напоїв
Підсолоджувачі досить широко використовують при розробці рецептур нових виробів. Серед них слід виділити синтетичні та природні речовини, так звані цукрозамісники, так як з хімічної точки зору вони не є сахаридами. Традиційно в виробництві горілки використовувався дисахарид сахароза, але розвиток асортименту цих напоїв йде за шляхом використання інших цукрів, наприклад фруктози, яка справляє більш сприйнятну дію на обмін речовин людини, ніж сахароза більш високої солодкості. Також використовуються глюкоза („5 капель”, „Цитрон”, „Олімп” та ПЧ „На джерельній воді”), мальтоза („Чарка”), фруктоза (ПЧ „На талій воді”), мед (ПК „Буковинська”, „Київська”, „Вдала”, „Українська з медом”).
Одним з цікавих та важливих напрямків розвитку асортименту горілок є розробка на підприємствах виробів з лактулозою (дисахарид із залишків галактози та фруктози). Лактулоза в 1,5 рази солодша за молочний цукор (лактоза), із одержують шляхом лужної трансформації. Також використовують алкософт.
1.3 Вимоги до вмісту цукрів у спиртних напоях згідно нормативним документам
Вміст спирту та цукру у спирних напоях повинен відповідати затвердженим для кожного найменування вина та горілки кондиціям [5,7]. Відхилення, якщо вони не обговорені спеціально, не повинні перевищувати за вмістом спирту ±0,5 % об., за вмістом цукрів ±0,5 г/100см3. Розбіжність в аналізах зразків вин та горілки виробника і споживача не повинна перевищувати 0,2% за цукром та спиртом. Нижче приведені вимоги до вмісту цукру та спирту для вин та коньяків
Таблиця 1.3.1 Вимоги до коньяків
| Типи коньяку | Витримка, не менше років | Обьємна частка етилового спирту, % об. | Масова коцентрація цукрів, масова частка % |
| 1. Коньяки ординарні | |||
| Три зірочки | 3 | 40-42 | 0,7-1,5 |
| Чотири зірочки | 4 | 40-42 | 0,7-1,5 |
| П’ять зірочок | 5 | 40-42 | 0,7-1,5 |
| 2. Марочні коньяки | |||
| Коньяк витриманий (КВ) | 6 | 40-42 | 0,7-1,2 |
| Коньяк витриманий вищої якості (КВВК) | 8 | 40-45 | 0,7-2,5 |
| Коньяк старий | 10 | 42-57 | 0,7-2,5 |
Таблиця 1.3.2 Вимоги до вин
| Типи вин | Обьємна частка етилового спирту, % об. |
Масова коцентрація цукрів, г/100 дм3 |
| І. Тихі вина | ||
| 1. Столові вина | ||
| сухі | 9-14 | До 0,3 |
| напівсухі | 9-14 | 1-3,0 |
| напівсолодкі | 9-12 | 3-8 |
| 2. Кріплені вина | ||
| міцні | 17-20 | 1-14 |
| напівдесертні | 14-16 | 5-12 |
| десертні | 15-17 | 14-20 |
| лікерні | 12-17 | 21-35 |
| 3. Ароматизовані | 16-18 | 6-16 |
| ІІ. Вина, що містять діоксид вуглецю | ||
| 1. Шампанське | ||
| брют | 10,5-12,5 | до 0,3 |
| сухе | 10,5-12,5 | 3,0 |
| напівсухе | 10,5-12,5 | 5,0 |
| напівсолодке | 10,5-12,5 | 6,0 |
| солодке | 10,5-12,5 | 8,0 |
| 2. Ігристі вина | ||
| червоні | 11-13,5 | 7-8 |
| рожеві | 10,5-12,5 | 6-7 |
| мускатні | 10,5-12,5 | 9-12 |
| 3. Шипучі, або газовані | 9-12 | 3-8 |
Згідно ДСТУ кількість цукру в горілці не нормується, а визначається лише рецептурами (Таблиця 1.3.3)
Таблиця 1.3.3 Вимоги до горілок
| Назва горілки | Джерела | Назва вуглеводу | діапазон концентрацій, кг/1000дал |
| Гусарська | СР1994 | мед | 5.0 |
| Джерельна | СР1994 | цукор | 25.0 |
| Дніпрянська | СР1994 | цукор | 20.0 |
| Злата Русь | СР1994 | цукор | 10.0 |
| золоті ворота | СР1994 | цукор | 10.0 |
| Косарська | СР1994 | цукор | 10.0 |
| Сіверська | СР1994 | цукор | 10.0 |
| Суханівська | СР1994 | цукор | 5.0 |
| українська оксамитова | СР1994 | цукор | 10.0 |
| українська оригінальна | СР1994 | мед | 30.0 |
| мягкая | RU2197520С2 | цукор | 17-19 |
| Самсон золотой | RU2111243С12 | мед | 4.7-5.3 |
| Смоленская | RU2034019С1 | цукровий сироп | 9.0-9.4 |
| Київська ювілейна | СР1994 | Мед | 20.0 |
| Пік чистоти. На джерельній воді. ТМ “Олімп” | РЦ32744-2415 | Глюкоза | 1.5 |
| Пік чистоти. На талій воді. ТМ “Олімп” | РЦ32744-2413-04 | Фруктоза | 1.5 |
|
5 капель. ТМ “5 капель” |
РЦ32744164-02 | Глюкоза | 1.5 |
Як видно з таблиці, методи аналізу цукру в горілках повинні мати чутливість від 0,1 мг/см3, для вин від 3 мг/см3.
1.4 Методи аналізу спиртних напоїв на вміст вуглеводів
Вміст цукру та його кількість характеризують шляхом аналізу двома умовними способами: вмістом редуцюючих речовин та вмістом загального цукру. Редуцюючими речовинами, або цукром до інверсії , називають суму усіх цукрів (інвертний цукор, глюкоза, фруктоза, мальтоза, лактоза), відновлюючих лужний розчин міді та інших полівалентних металів. Реакція відновлення лужного розчину міді обумовлюється наявністю в цих цукрах альдегідних та кетонних груп. Сахароза не містить вільних карбонільних груп, тобто не є редуцюючою речовиною.
Вміст редуцюючих речовин прийнято виражати умовно в інвертному цукрі. Умовне поняття означає, що якщо в даному об’єкті визначено, що вміст редуцюючих речовин дорівнює 15%, то маса інвертного цукру, яка складає 15% маси аналізуємого об’єкту, реагує з лужним розчином міді. Фактична маса редуцюючих речовин завжди більша. Ця різниця залежить від складу редуцюючих речовин та збільшується при збільшенні молекулярної маси мальтози та лактози.
Загальним цукром або цукром після інверсії називається сума усіх цукрів, відновлюючих лужний розчин міді та отриманих після обробки в спеціальних умовах соляною кислотою розчинів, які містять редуцюючі цукри та сахарозу.
Кількість загального цукру виражають двома різними способами: в умовному перерахунку на інвертний цукор або в умовному перерахунку на сахарозу.
Майже всі реакції, які використовують для визначення цукрів, не підпорядковуються стехіометричним показникам. Хід реакції в більшому ступені залежить від концентрації реактивів, тривалості та температури нагрівання, від співвідношення різних цукрів в аналізуємому об’єкті. В зв’язку з цим при виконанні аналізу велике значення має точне дотримування умов проведення реакцій, вказаних в методиці. Результат аналізу звичайно визначають за допомогою складених таблиць, градуювального графіка або іншим способом.
Вміст редуцюючих речовин, загального цукру та сахарози визначають різноманітними методами. Вони характеризуються точністю отриманих результатів, тривалістю аналізу, використаним обладнанням та приладами, використаними реактивами та ін. [8].
1.4.1 Титриметричний метод визначення вуглеводів [9]
Метод засновано на відновленні інвертним цукром оксиду міді (ІІ) до оксиду міді (І). Кінець реакції визначають за допомогою індикатора метиленового блакитного.
Метод застосовується для вин, виноматеріалів та коньяків з вмістом цукру не більше 1г в 100 см3.
В вині, виноматеріалах, які містять сахарозу, та коньяці перед визначенням цукру проводять інверсію.
Масову концентрацію інвертного цукру в грамах в 100 см3 аналізованого розчину визначають за формулою:
![]()
де ![]() – маса інвертного цукру в 100 см3 аналізованого розчину, знайдена з таблиці 1.4.1.1, мг;
– маса інвертного цукру в 100 см3 аналізованого розчину, знайдена з таблиці 1.4.1.1, мг;
![]() – кратність розбавлення аналізованої речовини;
– кратність розбавлення аналізованої речовини;
1000 – коефіцієнт для перерахунку мг інвертного цукру в г.
За остаточний результат беруть середнє арифметичне результатів двох паралельних визначень, допустиме розходження між якими не повинне перевищувати 0,6 %.
Таблиця 1.4.1.1 Маса інвертного цукру в 100 см3 аналізуємого розчину
|
Об’єм аналїзуючого розчину, мг |
Маса інвертного цукру, мг | |||||||||
|
Десяті долі,см3 |
||||||||||
| 0,0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | |
| 10,0 | 501,5 | 496,6 | 491,9 | 487,2 | 482,6 | 478,1 | 473,7 | 469,3 | 465,1 | 460,9 |
| 11,0 | 456,8 | 452,7 | 448,8 | 444,9 | 441,1 | 437,2 | 443,6 | 430,0 | 426,4 | 422,9 |
| 12,0 | 419,4 | 416,0 | 412,7 | 409,4 | 406,2 | 399,9 | 399,9 | 396,8 | 393,7 | 390,8 |
| 13,0 | 387,8 | 384,9 | 382,1 | 379,3 | 376,5 | 371,1 | 371,1 | 368,4 | 366,8 | 363,2 |
| 14,0 | 360,7 | 358,1 | 355,7 | 353,3 | 350,8 | 346,1 | 346,1 | 343,9 | 341,6 | 339,3 |
| 15,0 | 337,1 | 335,0 | 322,8 | 330,6 | 328,6 | 324,4 | 324,4 | 322,4 | 320,4 | 318,4 |
| 16,0 | 316,5 | 314,6 | 312,7 | 310,8 | 309,0 | 305,3 | 305,3 | 303,5 | 301,7 | 300,2 |
| 17,0 | 298,3 | 296,6 | 294,9 | 293,2 | 291,6 | 288,3 | 288,3 | 286,8 | 285,2 | 283,6 |
| 18,0 | 282,1 | 280,6 | 279,1 | 277,5 | 276,1 | 273,2 | 273,2 | 271,8 | 270,3 | 268,9 |
| 19,0 | 267,6 | 266,2 | 264,8 | 263,5 | 262,2 | 259,6 | 259,6 | 258,3 | 257,0 | 255,7 |
| 20,0 | 254,5 | 253,3 | 252,0 | 250,8 | 249,6 | 247,3 | 247,3 | 246,1 | 245,0 | 243,8 |
| 21,0 | 242,7 | 241,5 | 240,5 | 239,5 | 238,3 | 236,1 | 236,1 | 235,0 | 234,0 | 232,9 |
| 22,0 | 231,9 | 230,9 | 229,9 | 228,9 | 227,9 | 225,9 | 225,9 | 224,9 | 224,0 | 223,1 |
| 23,0 | 222,1 | 221,2 | 220,2 | 219,3 | 218,4 | 216,6 | 216,6 | 215,7 | 214,9 | 214,0 |
| 24,0 | 213,1 | 212,2 | 211,4 | 210,5 | 209,7 | 208,0 | 208,0 | 207,2 | 206,4 | 205,6 |
| 25,0 | 204,8 | 204,1 | 203,3 | 202,6 | 201,8 | 200,4 | 200,4 | 199,6 | 198,9 | 198,1 |
| 26,0 | 197,4 | 196,7 | 196,0 | 195,3 | 194,6 | 193,2 | 193,2 | 192,5 | 191,8 | 191,1 |
| 27,0 | 190,4 | 189,7 | 189,1 | 188,4 | 187,7 | 186,4 | 186,4 | 185,7 | 185,0 | 184,4 |
| 28,0 | 183,9 | 183,1 | 182,5 | 181,9 | 181,3 | 180,0 | 180,0 | 179,4 | 178,8 | 178,2 |
| 29,0 | 177,6 | 177,0 | 176,4 | 175,8 | 175,2 | 174,1 | 174,1 | 173,6 | 172,9 | 172,3 |
| 30,0 | 171,7 | 171,2 | 170,6 | 170,1 | 169,5 | 168,5 | 168,5 | 167,9 | 166,8 | 166,3 |
1.4.2 Спектрофотометричні методи
Фотоєлектроколориметричний метод визначення цукрі за допомогою антронового реагента [10]
В основі метода покладено розщеплення складних вуглеводнів до моносахаридів в сильнокислому середовищі з наступною їх гідратацією та утворенням осиметилфурфурола, який утворює при реакції з антроном комплекс синьо-зеленого кольору. Інтенсивність отриманого забарвлення пропорційна вмісту цукру в реакційній суміші.
Діапазон вимірювання масової концентрації цукру від 0,002 до 0,01 г/100 см3. Межа відносної похибки виміру d = ± 5,3% від вимірюваної величини при довірчій ймовірності Р = 0,95.
Масову концентрацію цукру с, г/100 см3 розраховують за формулою
![]()
де ![]() - коефіцієнт
пропорційності, який встановлено експериментально для використаного фотоелектроколориметра;
- коефіцієнт
пропорційності, який встановлено експериментально для використаного фотоелектроколориметра;
![]() – оптична густина;
– оптична густина;
![]() – коефіцієнт розведення;
– коефіцієнт розведення;
1000 – перерахунок мг в г.
Розрахунки проводять з точністю до другого десятинного знаку.
Фотоелектроколориметричний метод визначення цукрів за допомогою пікринової кислоти [11] Метод засновано на колориметричній реакції моносахаридів з пікриновою кислотою з утворенням амінопікринової кислоти, отриманої при відновленні цукром однієї групи NO2 до NH2. Інтенсивність утвореного забарвлення реакційної суміші пропорціональна кількості цукру, який визначаємо. Межа визначення масової концентрації цукру від 0,001 до 0,008 г в 100 см3.
Масову концентрацію моносахаридів в лікеро-горілчаних виробах визначають після інверсії сахарози, яка міститься в них.
Масову концентрацію цукру ![]() ,
г/100 см3 розраховують за формулою:
,
г/100 см3 розраховують за формулою:
![]()
де ![]() – оптична
густина;
– оптична
густина;
![]() – коефіцієнт пропорційності, який
визначено експериментально для фотоелектроколориметру, який використовується;
– коефіцієнт пропорційності, який
визначено експериментально для фотоелектроколориметру, який використовується;
![]() – коефіцієнт розведення;
– коефіцієнт розведення;
0,95 – коефіцієнт переводу інвертного цукру в сахарозу;
1000 – перерахунок мг в г.
1.4.3 Хроматографічні та електрофоретичні методи аналізу [12, 13]
В наш час розроблена досить велика кількість методик з аналізу вуглеводів за допомогою високоефективної рідинної хроматографії, яка має найпотужнішу роздільну ефективність. Іноді, в цілях контролю якості продукції, може аналізуватися вміст лактози та вуглеводів.
Прилад: Рідинний хроматограф високого тиску, обладнаний інжектором, детектором, розділювальною колонкою довжиною 250 мм із внутрішнім діаметром 4 мм, стаціонарна фаза – аміномодифікований (NH2) сілікагель. Швидкість протікання рухливого середовища – 1 мл/хв.
Цей метод підходить для визначення сахарози.
Прилад: Високоефективний рідинний хроматограф, який оснащено ізократичним насосом, приладом для введення зразка, термостатом для колонки, електрохімічним детектором.
Параметри: Колонка з катінообмінною смолою НРХ-87А; розмір частинок 10 мікрон; 300•7,8 мм.
Речовини які можуть бути визначені за допомогою цього методу – це глюкоза, фруктоза, сахароза, арабіноза, гліцерин, мальтоза.
Вимоги до підготовки зразка залежать від складності матриці. В більшості випадків досить лише екстрагувати зразок водою. Нерозчинні домішки можна видалити за допомогою фільтрації.
1.4.4 Рефрактометричне визначення цукрів та загального екстракту [14]
Метод ґрунтується на визначенні масової концентрації екстрактивних речовин та сахарози за шкалою рефрактометра за температури 20 °С.
Діапазон вимірювання масової концентрації загального екстракту від 0 до 60,0 г/100 см3.
Методика виконання аналізу забезпечує виконання вимірювань з абсолютною похибкою ±0,5 г/100 см3 при довірчій ймовірності Р=0,95.
Якщо показання рефрактометра знімають за температури, відмінної від 20 °С, то необхідно ввести поправку за спеціальними таблицями з поправками.
Сам результат знаходять за таблицею, яка вказана в методиці.
1.4.5 Порівняльна характеристика методів аналізу
Всі методи зараз використовуються, однак більш точними є все ж таки хроматографічні методи. Хроматографічні методи спроможні також одночасно знаходити кількісно до 5 цукрів. Однак негативною стороною є дороговизна самих приладів.
Досить високу точність має також фотоєлектроколориметричний метод, але негативною стороною є робота з канцерогенними речовинами (антрон та пікринова кислота). Однак ці методи досить широко використовуються на практиці.
2 Експериментальна частина
2.1 Техніка безпеки
При роботі з легкозаймистими рідинами (ЛЗР) слід дотримуватися трьох основних принципів [15]:
1) не допускати попадання горючих парів в атмосферу (попереджувати утворення вибухонебезпечних сумішей);
2) виключити можливість спалахування при випадковому утворенні вибухонебезпечної концентрації парів (виключити виникнення джерел запалювання);
3) вчасно приймати усі можливі міри, щоб наслідки аварії, якщо вона все ж таки відбудеться, були мінімальними.
Попадання парів ЛЗР в атмосферу та утворення вибухонебезпечних концентрацій може відбуватися при невірному проведенні лабораторних операцій або в аварійних ситуаціях.
Заборонено проводити будь-які роботи з ЛЗР без витяжної шафи.
Проведення процесів, які пов’язані з нагріванням ЛЗР (перегонка, перекристалізація, реакції в киплячих органічних рідинах). При проведенні цих процесів слід користуватися ефективними водяними холодильниками.
Забороняється виливати відходи ЛЗР в каналізацію.
Забороняється злив у каналізацію концентрованих розчинів кислот і лугів.
Посудини, ємкості, звільнені від кислот або лугів, нейтралізуйте і старанно вимийте.
Для приготування розчинів кислот (лугів) обережно, невеликими порціями, додавайте кислоту або луг у воду з круговим обертанням колби, яку занурюють у воду для охолодження. Треба розводити кислоту або луг у конічній колбі.
В приміщенні, де працює газовий хроматограф, повинна бути загальна обмінна вентиляція.
Балони зі скрапленими газами (аргон, водень, азот и т.п.) повинні бути ізольованими від місця проведення аналізу та мати захист від прямих сонячних променів.
Слід не допускати витоку газів із балонів та мережі. При падінні тиску за манометром потрібно "обмилити" можливі місця втечі та терміново ліквідувати негерметичність.
В приміщеннях, де проводяться роботи на газовому хроматографі з водневим полум'ям, паління забороняється. Не можна підпалювати сірниками водневе полум'я. Балони повинні мати відповідні написи.
Вимоги безпеки під час роботи з пікриновою кислотою [11].
Розкриття тари з пікриновою кислотою (тринітрофенолом) повинне проводитися в окремому приміщенні. Забороняється відкривати тару в тамбурах, проходах.
Пікринову кислоту необхідно зберігати в зволоженому стані (30-40 % дистильованої води по масі) в темному місці при температурі 5-20°С.
Для приготування робочого розчину пікринову кислоту сушать порціями не більш, ніж по 5 г безпосередньо перед приготуванням розчину. Рекомендовано висушування проводити в ексикаторі над хлористим кальцієм. Температура при сушінні не повинна перевищувати 50 °С.
Роботу з пікриновою кислотою та її розчинами слід проводити тільки в витяжних шафах. Не допускається контакт пікринової кислоти і її розчинів з металевими поверхнями через можливе утворення легкозаймистих солей та підвищену небезпеку вибуху. Усі матеріали, які контактують з пікриновою кислотою, повинні бути інертними до неї. Весь персонал, який працює з пікриновою кислотою повинен пройти навчання відповідним заходам безпеки. При роботі з пікриновою кислотою в приміщенні повинно знаходитися не менше двох працівників. При роботі необхідно застосовувати подвійні гумові рукавички, фільтруючі промислові протигасники або промислові распіратори.
2.2 Прилади та реактиви
Ваги лабораторні загального призначення не нижче 3-го класу точності за ГОСТ 24104 з найбільшою межею зважування 200 г.
Колориметр фотоелектричний лабораторний типу КФК-3 або інших типів з аналогічними технічними характеристиками.
Шпатель.
Секундомір за НД.
Термометри рідинні скляні з ціною поділки 0,1 або 0,5 °С за ГОСТ 28498.
Баня водяна.
Воронки лабораторні за ГОСТ 25336.
Колби 1-50-2, 1-100-2, 1-200-2, 1-250-2 та 1-1000-2 за ГОСТ 1770.
Пробірки місткістю 25 см3 з пришліфованими пробками за НД.
Піпетки 1-2-2-5, 1-2-2-10, 1-2-2-20 та 1-1-2-2 за ГОСТ 29227.
Бюретки 1-1-2-25-0,1 та 1-1-2-50-0,1 за ГОСТ 29251.
Циліндр 1-250 за ГОСТ 1770.
Стаканчики для зважування за ГОСТ 25336.
Стакани ВН-100 за ГОСТ 25336.
Кислота сірчана за ГОСТ 4204.
Кислота соляна за ГОСТ 3118, х.ч., густиною 1,190 г/см3.
Бумага фільтрувальна за ГОСТ 12026.
Сахароза, ч.д.а., за ГОСТ 5833.
Вода дистильована за ГОСТ 6709.
Антрон, ч.д.а., 0,2% розчин в концентрованій сірчаній кислоті густиною 1,835 г/см3.
Пікринова кислота, ч.
2.3 Фотометричне визначення вуглеводів з антроновим реагентом та пікриновою кислотою
Приготування реактивів
Приготування антронового реагенту:
Наважку антрону масою (0,367 ± 0,001) г кількісно переносять в мірну колбу місткістю 100 см3, приливають 50 см3 концентрованої сірчаної кислоти густиною 1,835 г/100 см3 та розчиняють антрон при перемішуванні.
Вміст колби доводять сірчаною кислотою до мітки, перемішують та поміщають в темне місце на 4 години до повного розчинення антрону.
Отриманий розчин слід зберігати в темному місці при температурі 6-8 °С не більше 15 діб.
Для отримання антронового реагенту допускається використання концентрованої кислоти, х.ч., але при цьому термін придатності не повинен перевищувати 2 доби.
Приготування розчинів гідроксиду натрію масовою долею 0,5% та 35%:
Наважку масою (0,500 ± 0,01) та (35,00 ± 0,01) г розчиняють в 50 см3 дистильованої води відповідно в двох мірних колбах ємкістю 100 см3 кожна. Розчини охолоджують до температури 20°С, доводять об’єм колби дистильованою водою до мітки та перемішують.
Приготування розчину пікринової кислоти масовою долею 0,5:
Наважку масою (0,500 ± 0,01) г кількісно переносять в мірну ковбу ємкістю 100 см3, приливають 50 см3 дистильованої води та розчиняють при перемішуванні на киплячій водяній бані.
Отриманий розчин охолоджують до 20°С, доводять його об’єм дистильованою водою до позначки та перемішують.
Розчин слід зберігати в темному місці при кімнатній температурі не більш 30 діб
2.4 Дослідження впливу етанолу на визначення цукрів
2.4.1 Дослідження впливу етанолу на визначення цукрів з антроновим реагентом.
Готували розчин сахарози з водою. Для цього взяли наважку сахарози 0,1000 г, розчинили та перенесли в колбу на 200 см3, термостатувати 20 хв. при 20 °С, доводили до позначки термостатованим дистильованою водою розчином. Концентрація отриманого розчину 0,5000 г/дм3. Брали колби на 25 см3, відбирали в кожну з них по 4,0; 7,5; 11,0; 15; 18,5; 22,5 см3 спирту відповідно. Термостатувати 20 хв при 20°С, доводили до позначки термостатованим дистильованою водою розчином. Проводили вимір оптичної густини з антроновим реагентом в порівнянні з холостим розчином (замість 2,5 см3 додаємо дистильовану воду).
Таблиця 2.4.1 Результати вимірювання впливу етанолу на оптичну густину
| Номер колби |
Концент- рація, мг/см3 |
Аліквота, см3 |
Розбав лення |
Добавка етанолу, см3 |
Вміст етанолу в колбі, % | Вміст етанолу в реакційній суміші, % | Оптична густина | Середнє значення оптичної густини | |
| 1 | 0,5 | 2,5 | 25 | 0 | 0 | 0 | 0,147 | 0,146 | |
| 0,145 | |||||||||
| 2 | 0,5 | 2,5 | 25 | 4,0 | 15 | 5 | 0,156 | 0,158 | |
| 0,160 | |||||||||
| 3 | 0,5 | 2,5 | 25 | 7,5 | 30 | 10 | 0,171 | 0,170 | |
| 0,168 | |||||||||
| 4 | 0,5 | 2,5 | 25 | 11,0 | 45 | 15 | 0,180 | 0,179 | |
| 0,178 | |||||||||
| 5 | 0,5 | 2,5 | 25 | 15 | 60 | 20 | 0,203 | 0,202 | |
| 0,200 | |||||||||
| 6 | 0,5 | 2,5 | 25 | 18,5 | 75 | 25 | 0,208 | 0,207 | |
| 0,205 | |||||||||
| 7 | 0,5 | 2,5 | 25 | 22,5 | 90 | 30 | 0,211 | 0,213 | |
| 0,215 |
Залежність чутливості реакції з антроновим реагентом наведена на рис.2.4.1.
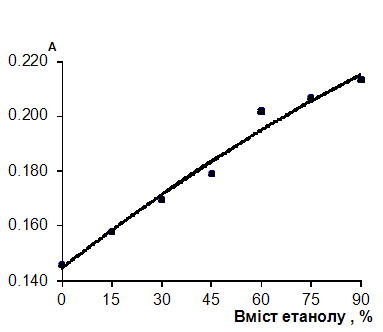
Рис. 2.4.1 Вплив етанолу на чутливість визначення глюкози з антроновим реагентом
2.4.2 Дослідження впливу етанолу на визначення цукрів з пікриновою кислотою.
Готували розчин глюкози з водою. Для цього брали наважку сахарози 5,0 г, розчиняли та переносили в колбу на 200 см3, термостатували 20 хв при 20°С, доводили до позначки термостатованою дистильованою водою. Концентрація отриманого розчину 25,0 г/дм3.
Потім відбирали 25 см3 розчину глюкози (С=25,00 г/дм3) в колбу на 50 см3. Довели дистильованою водою до мітки. Концентрація отриманого розчину 12,5 г/л
Брали колби на 25 см3, відбирали в кожну з них по 1,0 см3 вихідного розчину. Концентрація глюкози при цьому склала 0,500 г/дм3. Потім додавали 5; 10; 15; 20 см3 спирту відповідно. Термостатували 20 хв. при 20°С, доводили до позначки термостатованою дистильованою водою.
Розчин порівняння: 2,5 мл дистильованої води в реакційну суміш.
Таблиця 2.4.2.1 Вплив етанолу на оптичну густину
| Номер колби |
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Добавка етанолу, мл | Вміст етанолу в колбі, % | Оптична густина | |
| 1 | 0.5 | 2.5 | 2 | 0 | 0 | 0.501 | |
| 2 | 0.5 | 2.5 | 2 | 5 | 20 | 0.513 | |
| 3 | 0.5 | 2.5 | 2 | 10 | 40 | 0.531 | |
| 4 | 0.5 | 2.5 | 2 | 15 | 60 | 0.535 | |
| 5 | 0.5 | 2.5 | 2 | 20 | 80 | 0.538 |
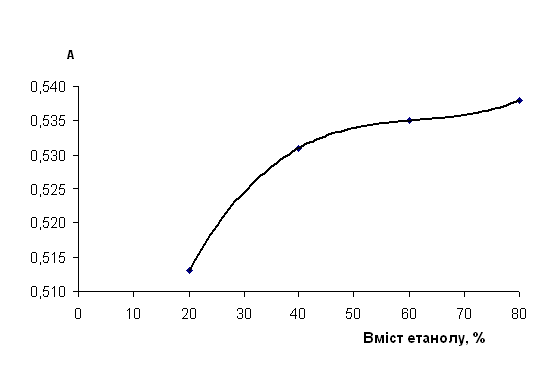
Рис. 2.4.2.1 Вплив вмісту етанолу на чутливість визначення глюкози з пікриновою кислотою
2.5 Оптимізація умов проведення фотометричних реакцій
Як видно з пункту 2.4 вміст етанолу впливає на аналітичний сигнал, тобто на чутливість. Щоб не вносити похибку ми надалі усі розчини цукрів будемо робити на 40 % сортировці для обох реагентів
Оптимізація умов проведення фотометричних реакцій з антроновим реагентом:
Приливаючи повільно сортировку до розчину антрону не відбувалося розшарування розчинів, але реакція миттєво проходила, тому було прийнято рішення приливати сортировку швидко та ставити в киплячу баню за секундоміром з інтервалом 2 хв.
В три термостійкі пробірки на 50 см3 приливаемо по 5,0 см3 антрону. Піпеткою на 5 мл відбираємо сортировку без цукру, та приливаємо 2,5 см3 в 1 пробірку з антроном (нехай стікає вільно, тобто не потрібно вповільнювати швидкість приливання сортировки). В момент початку приливання починаємо відлік часу. Коли пройде 25 секунд зачиняємо пробкою та перемішуємо вміст пробірки, та за 30 секунд ставимо в киплячу баню. Це буде розчин порівняння.
Повторюємо ті ж самі операції з досліджуваним розчином, чітко витримуючи 2 хвилини. Робимо мінімум 2 паралельних розчини.
Витримуємо рівно 6 хвилин на киплячій водяній бані кожну пробірку (тобто в 6 хв 30 сек дістаємо першу пробірку), поміщяємо її в льодяну баню та інтенсивно перемішуємо 30 сек (на таймері буде 7 хв). Швидко переливаємо в кювету, та проводимо виміри оптичної густини. Тіж самі операції проводимо з наступними пробірками.
Оптимізація умов проведення фотометричних реакцій з пікриновою кислотою:
В пробірку на 25 см3 з пришліфованою пробкою вносили 6 см3 0,5 %-го розчину гідроксиду натрію. Приливали 2,5 см3 аналізуємого розчину та 1 см3 0,5 %-ного розчину пікринової кислоти.
Аналогічно готуємо холосту пробу.
Пробірки закривали пришліфованими пробками, їх вміст перемішували та поміщали в киплячу водяну баню на 5 хв. Потім вміст пробірок охолоджували до кімнатної температури на льодяній бані 30 секунд, та вимірювали оптичну густину на фотоелектроколориметрі при довжині хвилі 470 нм в кюветі робочою товщиною 5 мм; розчин порівняння – холоста проба в кюветі з тією ж довжиною хвилі.
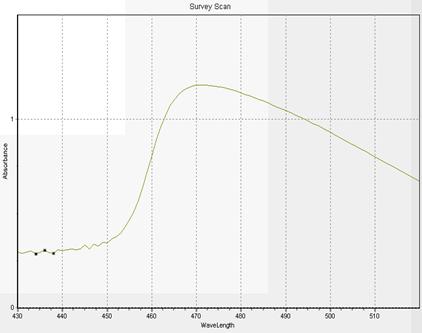
Рис. 2.5.1 Спектр розчину порівняння
Зробивши аналіз холостого розчину на спектрофотометрі, ми вибрали довжину хвилі саме 470 нм, адже видно, що при цій довжині хвилі знаходиться максимум.
2.6 Чутливість реакцій до індивідуальних вуглеводів.
Усі градуювальні розчини готувалися однаково. Наважки кристалогідратів вуглеводів перераховувалися на безводний цукор. Розведення розчинів робили виходячи з того, щоб оптичні густини були в інтервалі від 0,025 до 1,5.
Спочатку будували стандартний розчин 5,000 г/дм3 цукру в 40% водно-спиртовому розчині: 1,0000 г цукру розчиняли у водно-спиртовому розчині, переносили в колбу 200 см3, термостатували 20 хв. при 20 °С, довесли до позначки термостатованим водно-спиртовим розчином.
В якості р-на порівняння використовували 40% водно-спиртовий розчин.
В мірні колби на 50 см3 відбирали 0; 2,0; 5,0; 7,5; 10,0; 15,0; 20,0; 25,0; 50,0 см3 стандартного розчину, термостатувати 20 хв. при 20 °С, доводили до позначки термостатованим водно-спиртовим розчином. Концентрація в отриманих розчинах : 0; 0,2; 0,5; 0,75; 1,0; 1,5; 2,0; 2,5; 5,0 мг/см3 вуглеводу.
Спочатку розчини з концентрацією 0,0 та 0,2 мг/мл цукру розводимо в 50 разів. Для цього 2 мл розчину переносили у колбу на 50,0 см3, та термостатували 20 хв. при 20 °С, доводили до позначки термостатованим водно-спиртовим розчином. Проводили вимір оптичної густини з антроновим реагентом, як показано вище, і підбирали розведення так, щоб оптична густина була в межах 0,025-0,080. Після того, як визначили оптимальне розведення, теж саме проводили з іншими розчинами, і будували градуювальний графік.
Для побудови індивідуальних градуювальних графіків з пікриновою кислотою спочатку будували стандартний розчин 0,2000 г/дм3 вуглеводу в 40% водно-спиртовому розчині: 0,2000 г цукру розчинили у водно-спиртовому розчині, перенесли в колбу 200 см3, термостатували 20 хв. при 20 °С, доводили до позначки термостатованим водно-спиртовим розчином.
В мірні колби 50 см3 відбирали 0; 5,0; 10,0; 20,0; 25,0 стандартного розчину, термостатували 20 хв. при 20 °С, доводили до позначки термостатованим водно-спиртовим розчином. Концентрація в отриманих розчинах : 0; 0,1; 0,2; 0,4; 0,5 мг/см3 цукру.
Результати досліджень наведено в наступних таблицях та графіках:
Таблиця 2.6.1 Дані визначення сахарози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,2 | 2,5 | 50 | 0,048 | 0,048 | 0,01 |
| 0,2 | 0,048 | ||||
| 0,5 | 2,5 | 50 | 0,108 | 0,108 | 0,025 |
| 0,5 | 0,107 | ||||
| 0,75 | 2,5 | 50 | 0,148 | 0,148 | 0,0375 |
| 0,75 | 0,148 | ||||
| 1,0 | 2,5 | 50 | 0,193 | 0,193 | 0,05 |
| 1,0 | 0,193 | ||||
| 1,5 | 2,5 | 50 | 0,278 | 0,277 | 0,075 |
| 1,5 | 0,276 | ||||
| 2,0 | 2,5 | 50 | 0,383 | 0,381 | 0,1 |
| 2,0 | 0,378 | ||||
| 2,5 | 2,5 | 50 | 0,488 | 0,483 | 0,125 |
| 2,5 | 0,478 | ||||
| 5,0 | 2,5 | 50 | 0,900 | 0,898 | 0,25 |
| 5,0 | 0,895 |
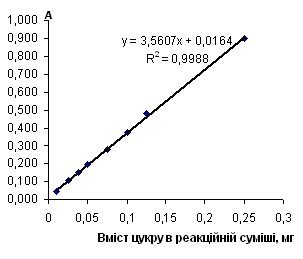
Рис. 2.6.1 Градуювальний графік вмісту сахарози з антроном
Таблиця 2.6.2 Дані визначення сахарози з пікриновою кислотою (інверсія)
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.100 | 2.5 | 0.25 | 0.002 | 0.003 | |
| 0.004 | |||||||
| 10 | 0.2 | 0.200 | 2.5 | 0.5 | 0.128 | 0.132 | |
| 0.135 | |||||||
| 20 | 0.4 | 0.400 | 2.5 | 1 | 0.420 | 0.419 | |
| 0.417 | |||||||
| 25 | 0.5 | 0.500 | 2.5 | 1.25 | 0.565 | 0.567 | |
| 0.568 | |||||||
| 50 | 1.0 | 1.000 | 2.5 | 2.5 | 1.292 | 1.291 | |
| 1.290 |
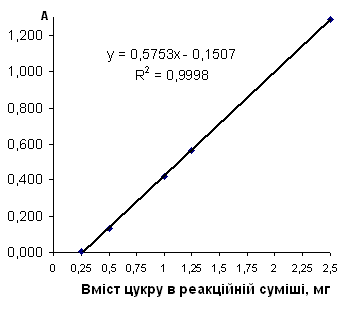
Рис. 2.6.2 Градуювальний графік вмісту сахарози з пікриновою кислотою
Таблиця 2.6.3 Дані визначення глюкози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 50 | 0,000 | 0 | 0 |
| 0,2 | 2,5 | 50 | 0,033 | 0,034 | 0,01 |
| 0,2 | 0,034 | ||||
| 0,5 | 2,5 | 50 | 0,080 | 0,077 | 0,025 |
| 0,5 | 0,073 | ||||
| 0,75 | 2,5 | 50 | 0,120 | 0,117 | 0,0375 |
| 0,75 | 0,113 | ||||
| 1,0 | 2,5 | 50 | 0,153 | 0,154 | 0,05 |
| 1,0 | 0,154 | ||||
| 1,5 | 2,5 | 50 | 0,230 | 0,231 | 0,075 |
| 1,5 | 0,231 | ||||
| 2,0 | 2,5 | 50 | 0,310 | 0,309 | 0,1 |
| 2,0 | 0,308 | ||||
| 2,5 | 2,5 | 50 | 0,375 | 0,378 | 0,125 |
| 2,5 | 0,380 | ||||
| 5,0 | 2,5 | 50 | 0,731 | 0,732 | 0,25 |
| 5,0 | 0,733 |
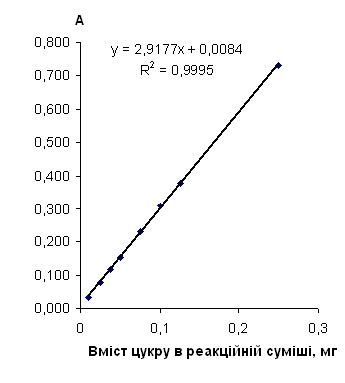
Рис. 2.6.3 Градуювальний графік вмісту глюкози з антроновим реагентом
Таблиця 2.6.4 Дані визначення глюкози з пікриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.100 | 2.5 | 0.25 | 0.004 | 0.004 | |
| 0.003 | |||||||
| 10 | 0.2 | 0.200 | 2.5 | 0.5 | 0.125 | 0.125 | |
| 0.124 | |||||||
| 20 | 0.4 | 0.400 | 2.5 | 1 | 0.373 | 0.372 | |
| 0.371 | |||||||
| 25 | 0.5 | 0.500 | 2.5 | 1.25 | 0.534 | 0.534 | |
| 0.534 |
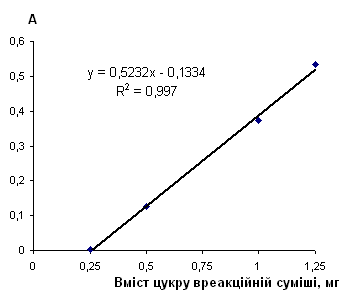
Рис. 2.6.4 Градуювальний графік вмісту глюкози з пікриновою кислотою
Таблиця 2.6.5 Дані визначення фруктози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 20 | 0,000 | 0 | 0 |
| 0,2 | 2,5 | 20 | 0,096 | 0,100 | 0,025 |
| 0,2 | 0,104 | ||||
| 0,50 | 2,5 | 20 | 0,231 | 0,229 | 0,0625 |
| 0,50 | 0,227 | ||||
| 0,75 | 2,5 | 20 | 0,360 | 0,357 | 0,09375 |
| 0,75 | 0,354 | ||||
| 1,00 | 2,5 | 20 | 0,479 | 0,481 | 0,125 |
| 1,00 | 0,483 | ||||
| 1,50 | 2,5 | 20 | 0,748 | 0,752 | 0,1875 |
| 1,50 | 0,755 | ||||
| 2,00 | 2,5 | 20 | 1,010 | 1,006 | 0,25 |
| 2,00 | 1,002 | ||||
| 2,50 | 2,5 | 20 | 1,400 | 1,394 | 0,3125 |
| 2,50 | 1,388 | ||||
| 5,00 | 2,5 | 20 | 2,450 | 2,430 | 0,625 |
| 5,00 | 2,410 |
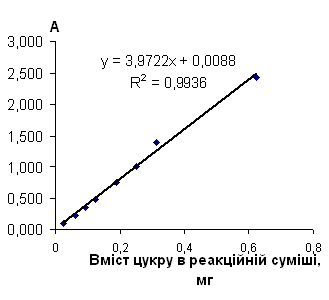
Рис. 2.6.5 Градуювальний графік вмісту фруктози з антроновим реагентом
Таблиця 2.6.6 Дані визначення фруктози з пікриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.0 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.1 | 2.5 | 0.25 | 0.008 | 0.009 | |
| 0.010 | |||||||
| 10 | 0.2 | 0.2 | 2.5 | 0.5 | 0.090 | 0.091 | |
| 0.092 | |||||||
| 20 | 0.4 | 0.4 | 2.5 | 1 | 0.337 | 0.336 | |
| 0.335 | |||||||
| 25 | 0.5 | 0.5 | 2.5 | 1.25 | 0.440 | 0.440 | |
| 0.440 | |||||||
| 50 | 1.0 | 1.0 | 2.5 | 2.5 | 1.010 | 1.008 | |
| 1.006 |
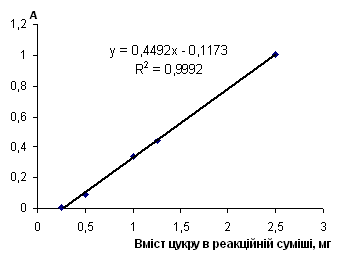
Рис. 2.6.6 Градуювальний графік вмісту фруктози з пікриновою кислотою
Таблиця 2.6.7 Дані визначення мальтози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 25 | 0,000 | 0 | 0 |
| 0,190 | 2,5 | 25 | 0,070 | 0,072 | 0,019 |
| 0,190 | 0,074 | ||||
| 0,475 | 2,5 | 25 | 0,163 | 0,164 | 0,048 |
| 0,475 | 0,164 | ||||
| 0,713 | 2,5 | 25 | 0,250 | 0,250 | 0,071 |
| 0,713 | 0,249 | ||||
| 0,950 | 2,5 | 25 | 0,346 | 0,342 | 0,095 |
| 0,950 | 0,338 | ||||
| 1,425 | 2,5 | 25 | 0,500 | 0,506 | 0,143 |
| 1,425 | 0,511 | ||||
| 1,900 | 2,5 | 25 | 0,645 | 0,643 | 0,190 |
| 1,900 | 0,640 | ||||
| 2,375 | 2,5 | 25 | 0,838 | 0,834 | 0,238 |
| 2,375 | 0,829 | ||||
| 4,750 | 2,5 | 25 | 1,600 | 1,599 | 0,475 |
| 4,750 | 1,598 |
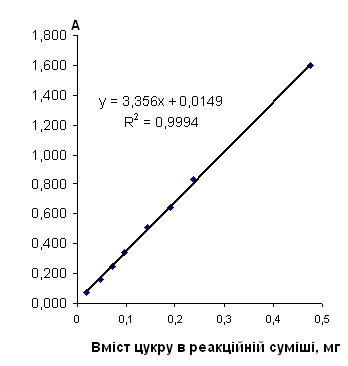
Рис. 2.6.7 Градуювальний графік вмісту мальтози з антроновим реагентом
Таблиця 2.6.8 Дані визначення мальтози з пікриновою кислотою (інверсия)
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.100 | 2.5 | 0.25 | 0.000 | 0.000 | |
| 0.000 | |||||||
| 10 | 0.2 | 0.200 | 2.5 | 0.5 | 0.031 | 0.029 | |
| 0.027 | |||||||
| 20 | 0.4 | 0.400 | 2.5 | 1 | 0.301 | 0.300 | |
| 0.298 | |||||||
| 25 | 0.5 | 0.500 | 2.5 | 1.25 | 0.436 | 0.434 | |
| 0.431 | |||||||
| 50 | 1.0 | 1.000 | 2.5 | 2.5 | 1.111 | 1.110 | |
| 1.108 |
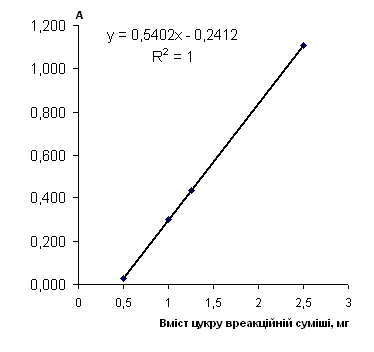
Рис. 2.6.8 Градуювальний графік вмісту мальтози з пікриновою кислотою
Таблиця 2.6.9 Дані визначення арабінози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 1 | 0,000 | 0 | 0 |
| 0,2 | 2,5 | 1 | 0,210 | 0,213 | 0,5 |
| 0,2 | 0,216 | ||||
| 0,5 | 2,5 | 1 | 0,582 | 0,586 | 1,25 |
| 0,5 | 0,590 | ||||
| 0,75 | 2,5 | 1 | 0,900 | 0,900 | 1,875 |
| 0,75 | 0,900 | ||||
| 0,2 | 2,5 | 5 | 0,028 | 0,029 | 0,1 |
| 0,2 | 0,030 | ||||
| 0,5 | 2,5 | 5 | 0,088 | 0,090 | 0,25 |
| 0,5 | 0,092 | ||||
| 0,75 | 2,5 | 5 | 0,170 | 0,167 | 0,375 |
| 0,75 | 0,163 | ||||
| 1,00 | 2,5 | 5 | 0,200 | 0,203 | 0,5 |
| 1,00 | 0,205 | ||||
| 1,50 | 2,5 | 5 | 0,338 | 0,332 | 0,75 |
| 1,50 | 0,325 | ||||
| 2,00 | 2,5 | 5 | 0,467 | 0,461 | 1 |
| 2,00 | 0,455 | ||||
| 2,50 | 2,5 | 5 | 0,600 | 0,598 | 1,25 |
| 2,50 | 0,595 | ||||
| 5,00 | 2,5 | 5 | 1,195 | 1,197 | 2,5 |
| 5,00 | 1,198 |
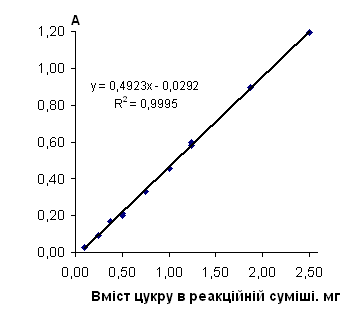
Рис. 2.6.9 Градуювальний графік вмісту арабінози. З антроновим реагентом
Таблиця 2.6.10 Дані визначення арабіноза з пікриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.050 | 2.5 | 0.125 | 0.022 | 0.022 | |
| 0.022 | |||||||
| 10 | 0.2 | 0.100 | 2.5 | 0.25 | 0.081 | 0.081 | |
| 0.081 | |||||||
| 20 | 0.4 | 0.200 | 2.5 | 0.5 | 0.261 | 0.261 | |
| 0.261 | |||||||
| 25 | 0.5 | 0.250 | 2.5 | 0.625 | 0.332 | 0.332 | |
| 0.332 | |||||||
| 50 | 1.0 | 0.500 | 2.5 | 1.25 | 0.791 | 0.790 | |
| 0.788 |
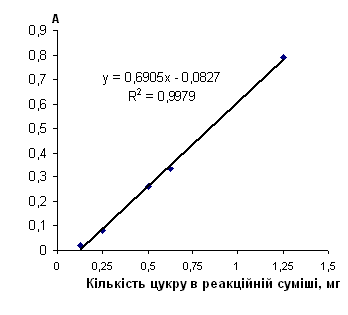
Рисю 2.6.10 градуювальний графік вмісту арабінози з пікриновою кислотою
Таблиця 2.6.11 Дані визначення лактози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 25 | 0,000 | 0 | 0 |
| 0,2000 | 2,5 | 25 | 0,060 | 0,060 | 0,02 |
| 0,2000 | 0,059 | ||||
| 0,5000 | 2,5 | 25 | 0,155 | 0,158 | 0,05 |
| 0,5000 | 0,160 | ||||
| 0,7500 | 2,5 | 25 | 0,225 | 0,223 | 0,075 |
| 0,7500 | 0,220 | ||||
| 1,0000 | 2,5 | 25 | 0,292 | 0,294 | 0,1 |
| 1,0000 | 0,295 | ||||
| 1,5000 | 2,5 | 25 | 0,442 | 0,440 | 0,15 |
| 1,5000 | 0,438 | ||||
| 2,0000 | 2,5 | 25 | 0,580 | 0,582 | 0,2 |
| 2,0000 | 0,583 | ||||
| 2,5000 | 2,5 | 25 | 0,706 | 0,711 | 0,25 |
| 2,5000 | 0,715 | ||||
| 5,0000 | 2,5 | 25 | 1,401 | 1,392 | 0,5 |
| 5,0000 | 1,382 |
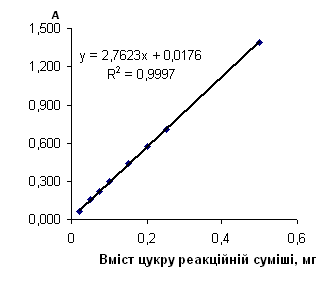
Рис. 2.6.11 Градуювальний графік вмісту лактози з антроновим реагентом
Таблиця 2.6.12 Дані визначення лактози з пикриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.050 | 2.5 | 0.125 | 0.022 | 0.022 | |
| 0.022 | |||||||
| 10 | 0.2 | 0.100 | 2.5 | 0.25 | 0.081 | 0.081 | |
| 0.081 | |||||||
| 20 | 0.4 | 0.200 | 2.5 | 0.5 | 0.261 | 0.261 | |
| 0.261 | |||||||
| 25 | 0.5 | 0.250 | 2.5 | 0.625 | 0.332 | 0.332 | |
| 0.332 | |||||||
| 50 | 1.0 | 0.500 | 2.5 | 1.25 | 0.791 | 0.790 | |
| 0.788 |
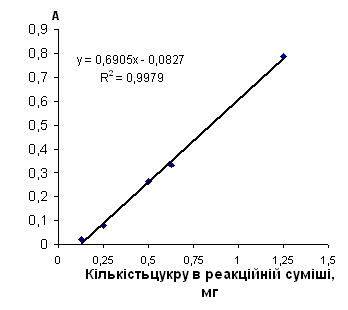
Рис. 2.6.11 Градуювальний графік вмісту лактози з пікриновою кислотою
Таблиця 2.6.12 Дані визначення галактози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0.0 | 2.5 | 50 | 0.000 | 0 | 0 |
| 0.2000 | 2.5 | 50 | 0.021 | 0.020 | 0.01 |
| 0.2000 | 0.018 | ||||
| 0.5000 | 2.5 | 50 | 0.046 | 0.047 | 0.025 |
| 0.5000 | 0.047 | ||||
| 0.7500 | 2.5 | 50 | 0.074 | 0.074 | 0.0375 |
| 0.7500 | 0.073 | ||||
| 1.0000 | 2.5 | 50 | 0.100 | 0.101 | 0.05 |
| 1.0000 | 0.102 | ||||
| 1.5000 | 2.5 | 50 | 0.158 | 0.159 | 0.075 |
| 1.5000 | 0.160 | ||||
| 2.0000 | 2.5 | 50 | 0.210 | 0.212 | 0.1 |
| 2.0000 | 0.213 | ||||
| 2.5000 | 2.5 | 50 | 0.268 | 0.269 | 0.125 |
| 2.5000 | 0.270 | ||||
| 5.0000 | 2.5 | 50 | 0.529 | 0.531 | 0.25 |
| 5.0000 | 0.533 |
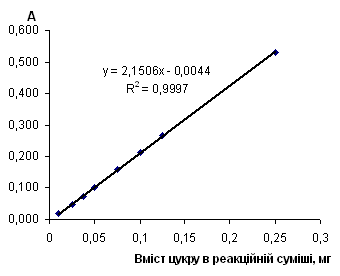
Рис. 2.6.12 Градуювальний графік вмісту галактози з антроновим реагентом
Таблиця 2.6.13 Дані визначення галаткози з пікриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.0 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.1 | 2.5 | 0.25 | 0.005 | 0.004 | |
| 0.003 | |||||||
| 10 | 0.2 | 0.2 | 2.5 | 0.5 | 0.080 | 0.081 | |
| 0.082 | |||||||
| 20 | 0.4 | 0.4 | 2.5 | 1 | 0.324 | 0.322 | |
| 0.320 | |||||||
| 25 | 0.5 | 0.5 | 2.5 | 1.25 | 0.440 | 0.440 | |
| 0.440 | |||||||
| 50 | 1.0 | 1.0 | 2.5 | 2.5 | 1.021 | 1.020 | |
| 1.018 |
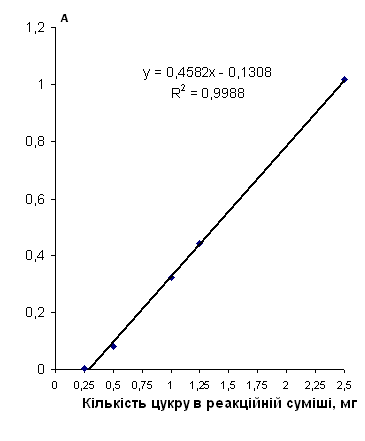
Рис. 2.6.13 Градуювальний графік вмісту галактози з пікриновою кислотою
Таблиця 2.6.14 Дані визначення рафінози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,0 | 2,5 | 50 | 0,000 | 0 | 0 |
| 0,2000 | 2,5 | 50 | 0,028 | 0,027 | 0,01 |
| 0,2000 | 0,026 | ||||
| 0,5000 | 2,5 | 50 | 0,075 | 0,075 | 0,025 |
| 0,5000 | 0,074 | ||||
| 0,7500 | 2,5 | 50 | 0,100 | 0,100 | 0,0375 |
| 0,7500 | 0,100 | ||||
| 1,0000 | 2,5 | 50 | 0,132 | 0,130 | 0,05 |
| 1,0000 | 0,128 | ||||
| 1,5000 | 2,5 | 50 | 0,212 | 0,216 | 0,075 |
| 1,5000 | 0,219 | ||||
| 2,0000 | 2,5 | 50 | 0,288 | 0,284 | 0,1 |
| 2,0000 | 0,280 | ||||
| 2,5000 | 2,5 | 50 | 0,399 | 0,402 | 0,125 |
| 2,5000 | 0,405 | ||||
| 5,0000 | 2,5 | 50 | 0,778 | 0,774 | 0,25 |
| 5,0000 | 0,770 |
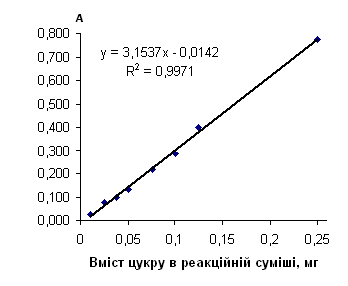
Рис. 2.6.14 Градуювальний графік з рафінози з антроновим реагентом
Таблиця 2.6.15 Дані визначення рафінози з пікриновою кислотою (інверсія)
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.100 | 2.5 | 0.25 | 0.001 | 0.001 | |
| 0.000 | |||||||
| 10 | 0.2 | 0.200 | 2.5 | 0.5 | 0.025 | 0.027 | |
| 0.029 | |||||||
| 20 | 0.4 | 0.400 | 2.5 | 1 | 0.286 | 0.284 | |
| 0.281 | |||||||
| 25 | 0.5 | 0.500 | 2.5 | 1.25 | 0.417 | 0.414 | |
| 0.411 | |||||||
| 50 | 1.0 | 1.000 | 2.5 | 2.5 | 1.076 | 1.074 | |
| 1.071 |
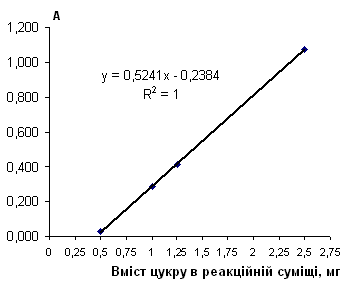
Рис. 2.6.15 Градуювальний графік вмісту рафінози з пікриновою кислотою
Таблиця 2.6.16 Дані визначення алкософту з антроновим реагентом.
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0.0 | 2.5 | 50 | 0.000 | 0 | 0 |
| 0.2000 | 2.5 | 50 | 0.015 | 0.013 | 0.01 |
| 0.2000 | 0.011 | ||||
| 0.5000 | 2.5 | 50 | 0.028 | 0.031 | 0.025 |
| 0.5000 | 0.033 | ||||
| 0.7500 | 2.5 | 50 | 0.050 | 0.052 | 0.0375 |
| 0.7500 | 0.053 | ||||
| 1.0000 | 2.5 | 50 | 0.077 | 0.079 | 0.05 |
| 1.0000 | 0.080 | ||||
| 1.5000 | 2.5 | 50 | 0.130 | 0.126 | 0.075 |
| 1.5000 | 0.121 | ||||
| 2.0000 | 2.5 | 50 | 0.160 | 0.159 | 0.1 |
| 2.0000 | 0.158 | ||||
| 2.5000 | 2.5 | 50 | 0.196 | 0.198 | 0.125 |
| 2.5000 | 0.200 | ||||
| 5.0000 | 2.5 | 50 | 0.419 | 0.420 | 0.25 |
| 5.0000 | 0.421 |
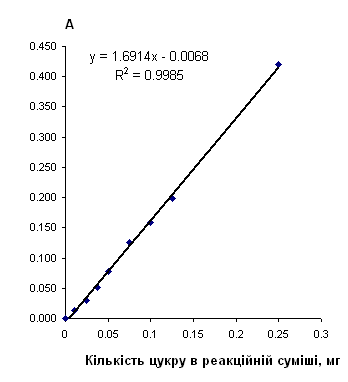
Рис. 2.6.16 Градуювальний графік вмісту алкософту з антроновим реагентом
Таблиця 2.6.17 Дані визначення алкософту з пікриновою кислотою (інверсія)
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
Концентрація робочого р-ну, мг/см3 |
Конентрація градуювального р-ну, мг/см3 |
Аліквота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0,0 | 0,000 | 2,5 | 0 | 0,000 | 0 | |
| 5 | 0,1 | 0,100 | 2,5 | 0,25 | 0,000 | 0,000 | |
| 0,000 | |||||||
| 10 | 0,2 | 0,200 | 2,5 | 0,5 | 0,001 | 0,001 | |
| 0,000 | |||||||
| 20 | 0,4 | 0,400 | 2,5 | 1 | 0,142 | 0,140 | |
| 0,137 | |||||||
| 25 | 0,5 | 0,500 | 2,5 | 1,25 | 0,213 | 0,210 | |
| 0,207 | |||||||
| 50 | 1,0 | 1,000 | 2,5 | 2,5 | 0,563 | 0,561 | |
| 0,558 |
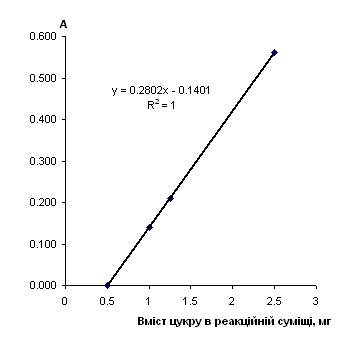
Рис. 2.6.17 Градуювальний графік вмісту алкософту з пікриновою кислотою
З наведених даних видно, що чутливість визначення вуглеводів з антроновим реагентом в 30-50 разів вища, ніж чутливість визначення відповідних вуглеводів з пікриновою кислотою.
Усі результати пунтку 2.6 звели в таблицю 2.7.1.
2.7 Порівняння результатів визначення цукрів двома фотометричними методами
З таблиці 2.7.1 видно, що межа визначення вуглеводів при використанні антронового реагенту приблизно в 30 разів нижча ніж при використанні пікринової кислоти.
Фотометричний метод заснований на реакції з антроновим реагентом є більш чутливий для усіх індивідуальних вуглеводів, цей метод більш безпечний в порівнянні з пікриновою кислотою, адже як відомо пікринова кислота (тринітрофенол) вибухонебезпечна та більш канцерогенна, хоча ці два методи займають однакову кількість часу.
Таблиця 2.7.1 Порівняння антронового реагенту та пікринової кислоти
| Цукри | Метод | |||||||
| Рівняння градуювальних графіків |
Графік лінійний за концентрацією градуювального розчину, мг/см3 |
|||||||
| Антрон | Пікринова к-та | |||||||
| Розве-дення | Графіки | Розве-дення | Графіки | Антрон | Пікринова к-та | |||
| Глюкоза | 50 | y=2.9307x+0.0065 | 1 | Без інверсії | y=0.5232x-0.1334 | 0.004 - 0.1 | 0.1 - 1 | |
| Арабіноза | 5 | y=0.4882x-0.0233 | 2 | y=0.6905x-0.0827 | 0.04 - 1 | 0.05 - 1 | ||
| Фруктоза | 50 | y=3,9766x+0,0068 | 1 | y=0.4492-0.1173 | 0.004 - 0.25 | 0.1 - 1 | ||
| Галактозa | 50 | y=2.1438x-0,0034 | 1 | y=0.4582x-0.1308 | 0.004 - 0.1 | 0.11 - 1 | ||
| Сахароза | 50 | y=3.5852x+0.0137 | 1 | З інверсією | y=3,5852x-0.0137 | 0.004 - 0.1 | 0.1 - 1 | |
| Рафіноза | 50 | y=3.1316x-0.0110 | 1 | y=0.5241x-0.2384 | 0.004 - 0.1 | 0.18 - 1 | ||
| Мальтоза | 25 | y=3.3682x+0.0115 | 1 | y=0.5402x-0.2412 | 0.008 - 0.19 | 0.18 - 1 | ||
| Алкософт | 50 | y=1.6914x-0.0068 | 1 | y=0.2802x-0.1401 | 0.004 - 0.1 | 0.2 - 1 | ||
| Лактоза | 25 | y=2.776x+0.0136 | 1 | y=0.5299x-0.2038 | 0.008 - 0.2 | 0.15 - 1 | ||
2.8 Оцінка збіжності, відтворюваності та правильності результатів
Правильність розроблених методик перевірили методом введено-знайдено для двох вуглеводів (глюкоза та сахароза). Знаходили вміст цукру за градуювальними графіками, які будували в день аналізу для обох фотометричних методів.
Таблиця 2.8.1 Дані визначення вмісту сахарози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0,2 | 2,5 | 50 | 0.050 | 0.051 | 0.01 |
| 0,2 | 0.052 | ||||
| 0,5 | 2,5 | 50 | 0.107 | 0.107 | 0.025 |
| 0,5 | 0.107 | ||||
| 0,75 | 2,5 | 50 | 0.151 | 0.152 | 0.0375 |
| 0,75 | 0.152 | ||||
| 1,0 | 2,5 | 50 | 0.190 | 0.191 | 0.05 |
| 1,0 | 0.191 | ||||
| 1,5 | 2,5 | 50 | 0.280 | 0.279 | 0.075 |
| 1,5 | 0.278 | ||||
| 2,0 | 2,5 | 50 | 0.383 | 0.381 | 0.1 |
| 2,0 | 0.379 | ||||
| 2,5 | 2,5 | 50 | 0.491 | 0.492 | 0.125 |
| 2,5 | 0.493 | ||||
| 5,0 | 2,5 | 50 | 0.960 | 0.961 | 0.25 |
| 5,0 | 0.961 |
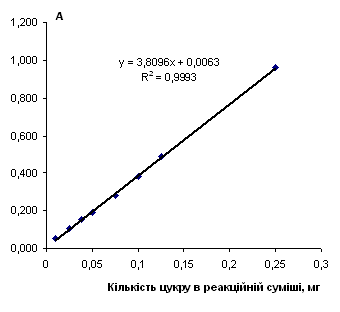
Рис. 2.8.1 Градуювальний графік вмісту сахарози з антроном
Градуювальні графіки будували, як вказано в пункті 2.6.
Далі надені результати вимірів для метрологічної характеристики методу.
Таблиця 2.8.2 Метод „введено–знайдено”для сахарози з антроновим реагентом.
| № опиту |
Введено концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина |
Знайдено за градуювальним графіком концентрація, мг/см3 |
|
| 1 | 2.0 | 2.5 | 50 | 0.387 | 2.00 | |
| 2 | 2.0 | 2.5 | 50 | 0.386 | 1.99 | |
| 3 | 2.0 | 2.5 | 50 | 0.389 | 2.01 | |
| 4 | 2.0 | 2.5 | 50 | 0.388 | 2.00 | |
| 5 | 2.0 | 2.5 | 50 | 0.390 | 2.01 | |
| Середнє | 2.0 | 2.00±0,01 | ||||
Потім будували градуювальний графік для глюкози з антроновим реагентом.
Таблиця 2.8.3 Дані визначення вмісту глюкози з антроновим реагентом
|
Концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина | Середня оптична густина | Кількість цукру в реакційній суміші, мг |
| 0.2 | 2.5 | 50 | 0.030 | 0.031 | 0.01 |
| 0.2 | 0.031 | ||||
| 0.5 | 2.5 | 50 | 0.078 | 0.077 | 0.025 |
| 0.5 | 0.076 | ||||
| 0.75 | 2.5 | 50 | 0.122 | 0.124 | 0.0375 |
| 0.75 | 0.125 | ||||
| 1.0 | 2.5 | 50 | 0.155 | 0.155 | 0.05 |
| 1.0 | 0.154 | ||||
| 1.5 | 2.5 | 50 | 0.233 | 0.232 | 0.075 |
| 1.5 | 0.231 | ||||
| 2.0 | 2.5 | 50 | 0.313 | 0.311 | 0.1 |
| 2.0 | 0.309 | ||||
| 2.5 | 2.5 | 50 | 0.381 | 0.381 | 0.125 |
| 2.5 | 0.380 | ||||
| 5.0 | 2.5 | 50 | 0.760 | 0.761 | 0.25 |
| 5.0 | 0.762 |
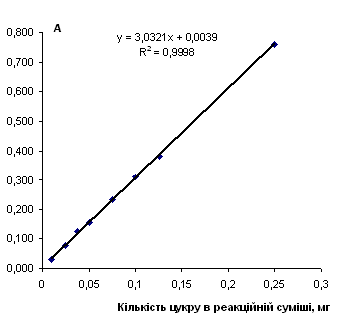
Рис. 2.8.2 Градуювальний графік вмісту грюкози з антроновим реагентом
Таблиця 2.8.4 Метод „введено–знайдено” для глюкози з антроновим реагентом.
| № опиту |
Введено концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина |
Знайдено за градуювальним графіком концентрація, мг/см3 |
|
| 1 | 2.0 | 2.5 | 50 | 0.308 | 2.01 | |
| 2 | 2.0 | 2.5 | 50 | 0.309 | 2.01 | |
| 3 | 2.0 | 2.5 | 50 | 0.307 | 2.00 | |
| 4 | 2.0 | 2.5 | 50 | 0.307 | 2.00 | |
| 5 | 2.0 | 2.5 | 50 | 0.308 | 2.01 | |
| Середнє | 2.0 | 2.00±0,01 | ||||
З пікриновою кислотою будували лише графік з сахарозою. Спочатку проводили інверсію, а вже потім готували градуювальні розчини.
Таблиця 2.8.5 Дані визначення вмісту сахарози з пікриновою кислотою
| Аліквота стандартного р-ну в колбу на 50 мл, мл |
концентрация робочого р-ну, мг/см3 |
Конентрация градуювального р-ну, мг/см3 |
Аликвота Градуювального р-ну, см3 |
Кількість цукру в реакційній суміші, мг | Оптична густина | Середня оптична густина | |
| 0 | 0.0 | 0.000 | 2.5 | 0 | 0.000 | 0 | |
| 5 | 0.1 | 0.100 | 2.5 | 0.25 | 0.020 | 0.012 | |
| 0.004 | |||||||
| 10 | 0.2 | 0.200 | 2.5 | 0.5 | 0.130 | 0.133 | |
| 0.135 | |||||||
| 20 | 0.4 | 0.400 | 2.5 | 1 | 0.420 | 0.423 | |
| 0.425 | |||||||
| 25 | 0.5 | 0.500 | 2.5 | 1.25 | 0.573 | 0.571 | |
| 0.568 | |||||||
| 50 | 1.0 | 1.000 | 2.5 | 2.5 | 1.296 | 1.293 | |
| 1.290 |
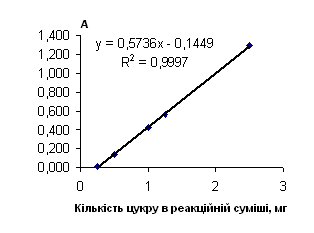
Рис. 2.8.3 Градуювальний графік вмісту сахарози з пікриновою кислотою
Таблиця 2.8.6 Метод „введено–знайдено” для сахарози з пікриновою кислотою.
| № опиту |
Введено концентрація, мг/см3 |
Аліквота, см3 |
Розведення | Оптична густина |
Знайдено за градуювальним графіком концентрація, мг/см3 |
|
| 1 | 2.0 | 2.5 | 5 | 0.420 | 1.97 | |
| 2 | 2.0 | 2.5 | 5 | 0.416 | 1.96 | |
| 3 | 2.0 | 2.5 | 5 | 0.423 | 2.00 | |
| 4 | 2.0 | 2.5 | 5 | 0.418 | 1.98 | |
| 5 | 2.0 | 2.5 | 5 | 0.417 | 2.01 | |
| Середнє | 2.0 | 1.98±0,03 | ||||
Метрологічна обробка даних свідчить про відсутність систематичної похибки.
Також перевірили данні методики на реальних зразках, взяли горілку “Біленька на березових бруньках” торгівельної марки “Біленька”. В рецептурі вказано, що використовується вуглевод – сахароза, отже будували градувальні графіки сахарози (показані вище). Реальний зразок аналізували трьома методами: за допомогою антронового реагенту та пікринової кислоти (градуювальні графіки) та методом добавок.
Таблиця 2.8.5 Метод добавок для горілки
| Добавка, мг | оптична густина | |
| 0 | 0.199 | |
| 0.02 | 0.381 | |
| 0.04 | 0.563 |
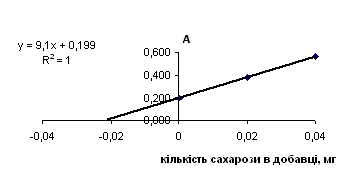
Рис. 2.8.3 Метод добавок
Таблиця 2.8.6 Розрахунок концентрації цукру методом добавок
|
проба № |
a |
в |
у |
кількість цукру в аліквоті, мг |
Концентрація цукру в горілці, г/л |
|
| горілка | 9.1 | 0.1990 | 0.000 | 0.022 | 0.55 |
Таблиця 2.8.7 Порівняльна таблиця
| Метод | Оптична густина горілки | Знайдено цукру |
| Антроновий реагент | 0.199 | 0.55 |
| Пікринова кислота | 0.583 | 0.51 |
| Метод добавок | 0.199 | 0.55 |
З порівняння результів видно, що результат визначення занижено, це може буди через інверсію. Однак для визначення з антроновим реагентом чутливість добра.
2.9 Вплив вмісту вуглеводів на показники якості горілчаних виробів
В данній дипломній роботі ми розпочали довготривалий екперимент, щоб вивчити поведінку вуглеводів в сортировці. Для цього ми зробили 20л сортировки (40% водно-спиртовий розчин). Та зробили добавки індивідуальних вуглеводів до неї. Метою цього експерименту було виявити, на які хімічні показники, крім органоліптичних якостей, вплиють вуглеводи.
Аналіз горілки проводили за ДСТУ [16]. Згідно з цим державним стандартом визначають альдегіди, метанол, ацетон, сивушні масла, рН, окислюваність та етери.
Концентрації вуглеводів вибрані такі, як наведені в рецептурах.
Нижче приведена таблиця з результатами вимірювання.
Таблиця 2.9.1 Результати аналізу горілок з добавками згідно ДСТУ 4165:2003
|
Дата аналізу |
Час витримки, міс |
Альдегіди, мг/л |
Метанол |
Ацетон |
Сив масла г/х |
Сив масла СА у відгоні |
Сив масла ПДМАБА у відгоні |
рН |
Лужність |
Окислю ваність (без відгону) |
Етери, мг/л (хім) |
|
||||||||||||||||||||||||||||||||||||||||
|
ф/х без відгону |
ф/х відгону |
г/х |
г/х |
г/х |
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
1. Вихідна сортировка (без додавання цукру) |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.43 | 3.55 | 1.17 | 0.0028 | нет | 2.43 | 0.4 | 8.25 | 0.86 | 9.0 |
|
||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 1.62 | 1.53 | 2,88 | 8.69 | 0.93 | 4.5 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.12 | 1.22 | 0.0025 | - | 2.20 | 1.68 | 8.58 | 8.0 | 1.37 |
|
|||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2. З сахарозою 3.00 г/л |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.43 | 3.67 | 0.8 | 0.0031; 0.0026 | нет | 2.71; 2.12 | 2.40 | 8.26 | 0.87 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 3.12 | 1.53 | 4,08 | 8.63 | 0.89 | 12.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.85 | 0.75 | 0.0023 | - | 1.70 | 1.74 | 8.74 | 16.0 | 1.96 |
|
|||||||||||||||||||||||||||||||||||||||||
|
3. З глюкозою 1.00 г/л |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.43 | 5.16 | 1.21 | 0.0028 | 0.89 | 2.10 | 6.74 | 8.22 | 0.89 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 2.82 | 1.58 | 2,89 | 8.69 | 0.94 | 10.5 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.28 | 1.33 | 0.0027 | 0.27 | 2.20 | 1.22 | 8.80 | 16.0 | 49.76 |
|
|||||||||||||||||||||||||||||||||||||||||
|
4. З арабінозою 0.50 г/л |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.54 | 7.98 | 1.60 | 0.0026 | 1.71 | 2.50 | 0.00 | 8.24 | 0.89 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 3.74 | 1.23 | 1,55 | 8.68 | 0.89 | 0.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 3.42 | 0.61 | 0.0022 | 0.46 | 2.00 | 1.05 | 8.62 | 0.5 | 30.52 |
|
|||||||||||||||||||||||||||||||||||||||||
|
5. З фруктозою 0.50 г/л |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.43 | 6.37 | 1.52 | 0.0028 | 1.72 | 2.50 | 8.40 | 8.22 | 0.90 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 2.03 | 1.29 | 4,72 | 8.75 | 0.85 | 13.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.53 | 0.88 | 0.0026 | 0.29 | 2.20 | 8.76 | 15.0 | 1.18 |
|
||||||||||||||||||||||||||||||||||||||||||
6. З лактозой 0.30 г/л (1-водн) |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.59 | 3.83 | 1.12 | 0.0028 | нет | 2.40 | 2.91 | 8.25 | 0.91 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 2.57 | 1.47 | 0,42 | 8.73 | 0.81 | 12.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.37 | 1.01 | 0.0027 | - | 2.40 | 1.19 | 8.71 | 17.0 | 11.78 |
|
|||||||||||||||||||||||||||||||||||||||||
|
7. З раффінозою 0.30 г/л (5-водн) |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.49 | 3.43 | 0.62 | 0.0026 | 0.15 | 2.08 | 8.54 | 8.22 | 0.88 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 3.86 | 1.37 | 1,20 | 8.71 | 0.92 | 14.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.53 | 1.00 | 0.0032 | 0.15 | 2.90 | 1.64 | 8.71 | 18.0 | 2.45 |
|
|||||||||||||||||||||||||||||||||||||||||
|
8. З алкософтом 1.00 г/л |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.86 | 4.47 | 1.25 | 0.0029 | 1.46 | 2.29 | 6.10 | 8.26 | 0.87 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 3.49 | 1.71 | 4,92 | 8.72 | 0.93 | 10.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 3.01 | 1.51 | 0.0027 | 0.33 | 2.10 | 1.49 | 8.55 | 11.0 | 11.19 |
|
|||||||||||||||||||||||||||||||||||||||||
|
9. З мальтозою 0.50 г/л |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.32 | 3.95 | 1.06 | 0.0029 | нет | 2.21 | 3.3 | 8.26 | 0.87 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 4.17 | 1.26 | 4,71 | 8.70 | 0.89 | 11.0 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.85 | 0.92 | 0.0027 | 1.81 | 2.00 | 1.38 | 8.56 | 14.0 | 12.27 |
|
|||||||||||||||||||||||||||||||||||||||||
|
10. З галактозою 0.50 г/л |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.03 | 0 | 3.65 | 5.97 | 1.30 | 0.0029 | 0.92 | 2.68 | 5.77 | 8.25 | 0.91 |
|
|||||||||||||||||||||||||||||||||||||||||
| 04.04 | 1 | 4.72 | 1.34 | 2,89 | 8.63 | 0.88 | 15.8 |
|
||||||||||||||||||||||||||||||||||||||||||||
| 16.05 | 2 | 2.93 | 1.10 | 0.0027 | - | 2.30 | 0.90 | 8.76 | 17.0 | 46.62 |
|
|||||||||||||||||||||||||||||||||||||||||
ф/х – фізикохімічні методи аналізу
г/х – газово хроматографічні методи аналізу
СА – саліциловий альдегід
З таблиці видно, що вуглеводи суттєво впливають на якість горілки, майже усі показники змінюються, збільшується окислюваність (майже у всіх, крім арабінози), збільшується вміст альдегідів та етерів, змінюється вміст сивушних масел.
Отже, вуглеводи досить сильно впливають на хімічні та органолептичні показники горілки. Вуглеводи покращують їх органолептичні показники. Але вони досить помітно зменшують термін придатності горілки.
Надалі буде проводитись робота у цьому напрямку, та більш детально буде проаналізовано вплив вуглеводів на якість горілки. Однак, не слід забувати що у нас модельні розчини горілок, а до справжніх горілок додають інші компоненти, які можуть стабілізувати ці показники (наприклад –гліцерин).
Висновки
Проаналізовані та узагальнені літературні дані з методів визначення вуглеводів у спиртних напоях.
Розроблені методики фотометричного визначення вуглеводів (сахарози, глюкози, фруктози, лактози, галактози, арабінози, мальтози, рафінози та алкософту) з антроном та пікриновою кислотою.
Досліджено вплив етанолу на визначення цукрів. Знайдено оптимальний вміст етанолу в аналізуємих розчинах – 40 об.%.
Оптимізовано умови проведення фотометричних реакцій з антроновим реагентом та пікриновою кислотою: швидкість приливання спиртового розчину, час витримки на водяній бані, довжина хвилі та ін.
Визначено, що чутливість реакції вуглеводів з антроновим рагентом в 30-50 разів вища, ніж чутливість визначення відповідних вуглеводів з пікриновою кислотою.
Порівняні результати визначення цукрів двома фотометричними методами. Зроблена оцінка збіжності, відтворюваності та правильності результатів методом „введено-знайдено”, Sr=0,01.
Визначено вміст сахарози у горілці “Біленька на березових бруньках” торгівельної марки “Біленька” трьома методами: за допомогою антронового реагенту, пікринової кислоти та методом добавок.
За ДСТУ 4165:2003 визначено вплив вмісту індивідуальних вуглеводів у водно-спиртовому розчині на показники якості горілчаних виробів.
Література
1. А.К. Дорош, В.С. Лисенко. Виробництво спиртних напоїв: сировина, апарати, технології одержання спирту та водки з рекомендаціями для індивідуальних виробників. – К: Либідь, 1995 –272с.
2. А. Крутошикова. Природные и синтетические сладкие вещества. – М.: Пер. со словацк. –М: Мир, 1988. – 120с.
3. В.В. Петрушевский., Е.Г. Бондар., Е.В. Винокурова. Производство сахаристых веществ. – К.: Урожай, 1989. –168с.
4. С.В. Востриков, Е.В. Федорова, О.Ю. Мальцева. Образование примесей при сбраживании различного углеводородного сырья // Прогресивные технологии и современное оборудование для спиртовой и ликероводочной продукции. –М.: Пищевая промышленность, 2003. –280с.
5. Г.Г. Валуйко, В.А. Домарецький, В.О. Загоруйко. Технологія вина. –К.:Центр навчальної літератури, 2003. –592с.
6. Р. Досон, Д. Эллиот. Справочник биохимика. Перевод с английского. –М.: Мир, 1991. –544с
7. Сборник рецептур "Рецептури лікеро-горілчаних напоїв і горілок. – К.: 1994
8. И.С Лурье. Руководство по технохимическому контролю в кондитерской промышлености. –М.: Пищевая промышленность, 1978. –344с.
9. ГОСТ 13192-73. Вина. Виноматериалы и коньяки. Метод определения сахаров.
10. ГОСТ Р 51135-98. Изделия ликероводочные. Правила приемки и методы анализа.
11. ГОСТ Р 51875-2002. Вина, виноматериалы и коньяки. Фотоэлектроколориметрический метод определения массовой концентрации сахара с применением пикриновой кислоты (тринитрофенола).
12. М. Ротаунт. Анализ пищевых продуктов. –М.: Пищевая промышленность, 1998. –256 с.
13. ДСТУ 4112.6-2002. Вина і виноматеріали. Метод визначення сахарози
14. ДСТУ 4164:2003. Напої лікеро-горілчані. Правила приймання і методи випробування.
15. Л. Н Захаров. Техника безопасности в химических лабораториях: Справ. изд. – 2-е изд., перераб. и доп. – Л.; Химия , 1991. – 336 с.
16. ДСТУ 4165:2003. Горілки та горілки особливі. Правило прийманя та методи випробування.
Аннотация
Работа посвящена определению углеводов в водке. Определение сахарозы, глюкозы, фруктозы, мальтозы, арабинозы, лактозы, галактозы, раффинозы, алкософта проводилось фотометрически двумя методами: с антроном и с пикриновой кислотой. Проведено сравнение методик по правильности и воспроизводимости. Определено содержание сахарозы в водке. Изучено влияние углеводов на показатели качества водочных изделий.
Abstract
Detection of carbo-hydrate in alcohols beverages is the main idea of the work. Sucrose, glucose, maltose, lactose, gelatos, rafinose, alkosofte, are detected with antrone and picric acid. The photometric methods are used. Both methods were compare to each other and gave us the correct and reproductable results. The sucrose allowance was detect in vodka. The contribution of carbo-hydrates in alcohol beverages was study in work.