
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Особенности каталитического влияния меди на фазовый переход от BNк к BNг
Реферат: Особенности каталитического влияния меди на фазовый переход от BNк к BNг
ОСОБЕННОСТИ КАТАЛИТИЧЕСКОГО ВЛИЯНИЯ МЕДИ НА ФАЗОВЫЙ ПЕРЕХОД BNK→BNГ
Введение
Кубический нитрид бора (BNк), второй по твёрдости материал после алмаза, в последнее время получает всё большее распространение в инструментальной промышленности и микроэлектронике. Для более широкого и эффективного применения необходимо обладать информацией о его поведении при взаимодействии с другими веществами, в частности, с металлами.
В данной работе представлены результаты исследований дифференциально-термического, рентгенофазового и химического анализов образцов, полученных нагреванием в вакууме до температуры 12000С при концентрациях BNк от 10 до 90масс.%.
Данная система является интересной как с теоретической, так и с практической точки зрения. Так, до настоящего времени отсутствуют сведения о механизме обратного фазового перехода кубического нитрида бора в гексагональную структуру при взаимодействии с металлами. Медь, в частности, может быть использована в качестве контактного материала при применении BNк в электронике, а также в качестве компонента смеси при изготовлении композиционных материалов на его основе.
В литературных данных [1-3] указывалось, что кубический нитрид бора не взаимодействует с медью при температуре 13730К. Однако в данных работах исследовались лишь поверхностные взаимодействия, что не может объективно дать однозначный ответ о наличии либо отсутствии взаимодействия. Кроме того, следует отметить работу [4], где отмечено, что оксиды меди, которые неизменно присутствуют в самой меди, при взаимодействии с кубическим нитридом бора восстанавливаются до металлов. Из приведенного обзора следует, что имеющиеся источники информации по данной теме немногочисленны и проблема требует дополнительного изучения.
Методика эксперимента
Для исследования приготавливались смеси из порошков кубического нитрида бора и меди, с содержанием BNк 10, 20, 30, 40, 50, 60, 70, 80, 90% механическим смешением в спирте в течение двух часов. Порошок кубического нитрида бора фракции 5/2мкм, соответствующий ТУ РБ 03535138.002-98, проходил дополнительную очистку от примесей и гексагонального нитрида бора с целью избегания искажения результатов. Отношение самых интенсивных рефлексов гексагонального нитрида бора (I002) к кубическому (I111) равно 0,012. Данное соотношение соответствует содержанию кубического нитрида бора 99,8%. Порошок меди соответствовал марке ПМС-2У ГОСТ 4960-75. Полученные смеси загружали в сосудики из кварцевого стекла специальной формы (так называемые сосудики Степанова), из которых откачивали воздух до остаточного давления ~1×10-3 Па. Масса навески составляла ~1-1,5г. Далее проводили дифференциально-термический анализ полученных смесей на термографической установке повышенной чувствительности с записью зависимости ΔЕ=f (Е,mV) на двухкоординатном самописце. Для градуировки установки были произведены записи термограмм таких хорошо исследованных веществ, как NaCl ЧДА ГОСТ 4233-77 (Тпл=1074 К, ΔH=28,2кДж/моль), Cu ПМС-2У ГОСТ 4960-75 (Тпл=1356 К, ΔH=13кДж/моль) Na2SO4 ЧДА ГОСТ 4166-76 (Тпл=1157 K, ΔH=36,8кДж/моль), Mg марки МПФ-1 ГОСТ 6001-79 (Тпл=923К ΔH=8,5кДж/моль), NaNO3 Ч ГОСТ 4168-79 (Тпл=580К ΔH= 15кДж/моль).
Экспериментально определенные температуры фазовых переходов хорошо совпадали с известными из литературы значениями, точность определения температур фазовых переходов составляла ±20К, а величин тепловых эффектов составляла ±3-4%. Эталоном при записи служил прокаленный оксид алюминия ХЧ ТУ6-09-973-76, который загружали в аналогичный сосудик Степанова. Образец и эталон устанавливали в гнезда держателя из жаропрочной стали, которые размещали в силитовой печи или печи сопротивления. Измерение температуры производили с помощью комбинированной Pt-Pt/Rh термопары, подсоединенной к цифровому вольтметру В7-34. Измерения проводили в диапазоне температур от 2980К до 14930К. После охлаждения образцы смесей извлекались, и проводился рентгенофазовый анализ. Съемка профилей рентгеновских дифракционных рефлексов для уточнения структур проводилось на дифрактометре ДРОН-4 в CuKa монохроматическом излучении в автоматизированном режиме с шагом 0.01 (0.02) 0 в диапазоне углов 20 - 1400. Время экспозиции в одной точке составляло 10с. Отдельно, проводилось сканирование пика <331> в диапазоне 135-138˚. Управление автоматизированным комплексом производилось с помощью ПЭВМ.
Все расчеты проводились с помощью программы QUANTO. По модели рассчитывалась теоретическая дифрактограмма, которая сравнивалась с экспериментальной. Процедура, при которой уточнялось 36 параметров, проводилась путем постепенного добавления уточняемых параметров при постоянном графическом моделировании фона и профилей дифракционных линий до стабилизации значений Rp - фактора, который на заключительной стадии уточнения находился в пределах 8,2-8,5%.
Уточнение структуры проводилось по методу Ритвельда. Для расчетов в качестве функции профиля дифракционной линии была выбрана функция Пирсона VII. Фон дифрактограмм уточнялся в полиномиальном приближении (степень полинома равна 6). Полученные рефлексы сопоставлялись с идентификационными данными исходных компонентов и вероятных продуктов реакций.
Далее образцы подвергались травлению в азотной кислоте, с целью селективного удаления меди [5], после чего промывались, высушивались и взвешивались. В результате полученных операций были получены данные о массе меди и нитридов бора.
В дальнейшем, целью устранения гексагонального нитрида бора, образцы подвергались обработке по методике, приведенной в работе [6]. Из разницы массы образца до и после травления определялась масса гексагонального нитрида бора.
При сопоставлении результатов рентгенофазового и химического анализов был определён фазовый и количественный состав смесей.
Результаты и их обсуждение
Полученные термограммы показали,
что в смесях системы Cu-BNк
в диапазоне температур от 2980К до 14930К наблюдается
один тепловой эффект с температурой его начала, не зависящей от состава смеси. Данная
температура соответствует началу плавления меди. Ввиду того, что температура
начала теплового эффекта постоянна, коэффициент пропорциональности ![]() равен 16,99481дж/см2
и данная величина постоянна для данных условий эксперимента. Однако, площадь
пика, соответствующая тепловому эффекту, связанному с плавлением меди для
различных соотношений медь-кубический нитрид бора, различна. Причём величина
теплового эффекта не совпадает с величиной теплового эффекта, соответствующей
количеству меди в смеси. Таким образом, при плавлении меди происходит
дополнительный процесс, сопровождаемый тепловым эффектом, величина которого
зависит от состава смеси.
равен 16,99481дж/см2
и данная величина постоянна для данных условий эксперимента. Однако, площадь
пика, соответствующая тепловому эффекту, связанному с плавлением меди для
различных соотношений медь-кубический нитрид бора, различна. Причём величина
теплового эффекта не совпадает с величиной теплового эффекта, соответствующей
количеству меди в смеси. Таким образом, при плавлении меди происходит
дополнительный процесс, сопровождаемый тепловым эффектом, величина которого
зависит от состава смеси.
Проведенный рентгенофазовый анализ смесей, выдержанных при температурах ниже точки плавления меди, показал отсутствие дополнительных рефлексов, что позволяет сделать вывод об отсутствии твёрдофазного взаимодействия между медью и кубическим нитридом бора. При рентгенофазовом исследовании смесей, выдержанных при температурах выше плавления меди, при концентрациях BNк до 70мас.%, наблюдался дополнительный к существующему рефлекс, соответствующий рефлексу гексагонального нитрида бора (I002), причём интенсивность уменьшалась при концентрациях BNк от 20 до 70 мас.%. Следов боридов и нитридов меди обнаружено не было.
Использование кремнезема в качестве наполнителя в матричном синтезе мембранных сорбентов обусловлено прежде всего его механической прочностью, а также возможностью варьировать, помимо текстуры и адсорбционных свойств материала, гидролитическую и термическую устойчивость, каталитическую активность и т.д. Улучшения трех последних из перечисленных свойств достигают среди прочих методов взаимодействием кремнезема с галогенидами различных элементов, включая галогениды Ge, V, Zr, Ti, Sn и т.д. С целью установления различий в формировании объемного геля кремнезема и гелевидного покрытия нами изучены текстурные и адсорбционные свойства монолитных аналогов кремнезема, модифицированных оксидом германия (IV).
В качестве источника кремния использовали стабильный разбавленный гидрозоль кремнезема (2,0 мас.% SiO2, рН 6,0), полученный нейтрализацией водного раствора щелочного силиката на катионите КУ-2, источника германия - хлорид германия (IV). Модифицирование кремнезема оксидом германия (IV) проводили при значении рН 5,0, добавляя при перемешивании концентрированный гидрат аммиака к смеси концентрированной серной кислоты, хлорида германия (IV) и силиказоля. Коагуляты отделяли, отмывали, высушивали и прокаливали в течение 4 ч на воздухе при 923 К.
Низкотемпературную физическую сорбцию азота изучали волюмометрическим методом на сорбционном анализаторе ASAP 2020 MP (Micromeritics, USA). Рентгенофазовый анализ образцов проводили на приборе ДРОН-7.
Согласно данным рентгенофазового анализа, несмотря на сходство кристаллических структур GeO2 и SiO2, оксиды не образуют непрерывных рядов твердых растворов, и их смеси после прокаливании при 923 К остаются рентгеноаморфными.
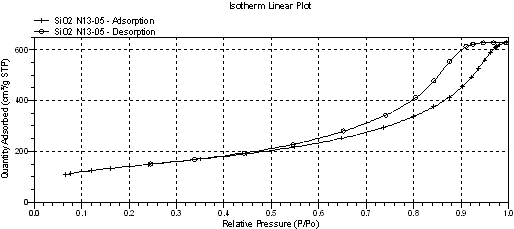
Рисунок 1 - Изотерма адсорбции-десорбции азота при 77К немодифицированным кремнеземом
Изотермы адсорбции азота для всех образцов относятся к типу IV изотерм физической сорбции и соответствуют мезопористым адсорбентам. Петля капиллярно-конденсационного гистерезиса на изотерме немодифицированного кремнезема имеет гибридную форму Н1+Н2 (рисунок 1), а на изотермах образцов SiO2 с инкорпорированным GeO2 форму Н2 (рисунок 3), по классификации ИЮПАК. Для исходного кремнезема не только форма петли существенно отличается, но и величина удельной поверхности, рассчитанная по БЭТ и по Ленгмюру и составляющая 516,6366 и 718,2123 м2/г соответственно, меньше аналогичных величин у модифицированных образцов на » 100-150 м2/г (таблица). Изотермы образцов с GeO2 характерны для высокопористых агрегатов с развитой сетью взаимно пересекающихся пор (рисунок 3). В отсутствие GeO2 кремнезем имеет более рыхлую текстуру по сравнению с образцами с инкорпорированным GeO2, что выражается в большей ширине пор и большем их объеме, отнесенным к единице массы адсорбента (таблица), а также в размытом распределении объема мезопор по их диаметрам (ср. рисунки 2,4).
Анализ кривых распределения на рисунках 2, 4 показал, что введение GeO2 в кремнезем способствует формированию более регулярной текстуры мезопор с четко определяемым преобладающим диаметром по сравнению с исходным кремнеземом. Его величина составляет 4,03, 4,23 и 4,14 нм для образцов 14, 17 и 18 соответственно. У исходного кремнезема на очень широком распределении мезопор по диаметрам определялись две моды: первая с координатами 4,57 нм и 0,078 см3/г×нм, вторая - 11,7 нм и 0,056 см3/г×нм (рисунок 2), - в соответствии с гистерезисом формы Н1 в области относительных давлений 0,42 < р/р0 < 0,90 и гистерезисом Н2 при р/р0 > 0,9.
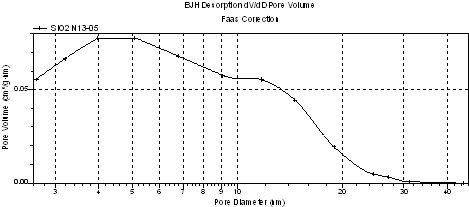
Рисунок 2 - Кривая распределения объема пор кремнезема по диаметрам в отсутствие GeO2
Таблица - Текстурные и адсорбционные свойства образцов кремнезема с инкорпорированным оксидом германия (IV)
| Номер образца | Отношение Si: Ge, моль/моль |
Форма гистерезиса |
Удельная поверхность Аs (БЭТ), м2/г |
Удельная поверхность Аs (Ленгмюр), м2/г |
Объем пор Vp (BJH), см3/г |
Средний диаметр пор dp (BJH), нм |
| 13 | - | Н1+Н2 | 516,6366 | 718,2123 | 0,946786 | 8,6892 |
| 14 | 1: 0,006 | Н2 | 607,5512 | 843.7197 | 0,610430 | 4,7071 |
| 17 | 1: 0,057 | Н2 | 624,3038 | 867.4074 | 0,515716 | 4,1419 |
| 18 | 1: 0,151 | Н2 | 605,8753 | 838.3517 | 0,544978 | 4,0409 |
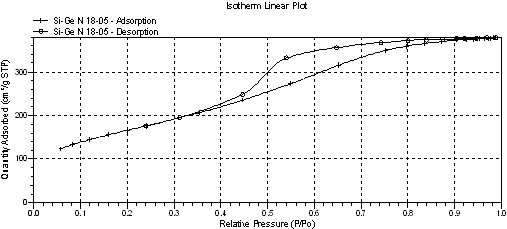
Рисунок 3 - Изотерма адсорбции-десорбции азота при 77К кремнеземом с инкорпорированием 0,151 моль GeO2
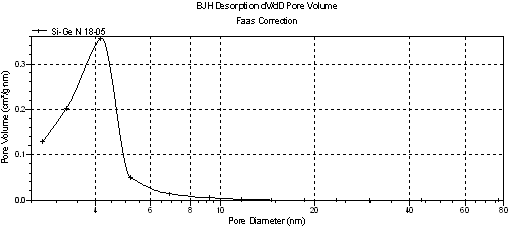
Рисунок 4 - Кривая распределения объема пор кремнезема с инкорпорированием 0,151 моль GeO2
Итак, методом низкотемпературной адсорбции-десорбции азота установлено формирование регулярной текстуры мезопор монолитного аналога кремнеземного наполнителя в матричном золь - гель синтезе мембран с преобладающим диаметром мезопор около 4 нм путем инкорпорирования оксида германия (IV) в кремнезем в количестве 0,006-0,151 моль/моль. Получаемые результаты могут дать принципиальную информацию, необходимую для разработки новых и модернизации существующих материалов. Безусловным преимуществом нейтронных методов является: высокая проникающая способность, сопоставимая рассеивающая способность лёгких и тяжёлых элементов, возможности изотопного контрастирования материалов, содержащих водород и различные металлы.
Методы, основанные на рассеянии нейтронов, были применены для исследования и аттестации катализаторов (в состав входит углерод, микроструктуру которого необходимо знать). Были исследованы токопроводящие мембраны, которые, из-за наличия в них водорода, являются классическими объектами для малоуглового нейтронного эксперимента (МУРН). Топливные водородные элементы - это системы, производящие энергию. Как и любая энергетическая установка, в особенности мобильная, она требует размещения вблизи бака с горючим. В качестве такового часто используются материалы со способностью накапливать, сохранять водород и при определенных условиях отдавать его. Для технических устройств требуется многократное циклирование процесса (400-1000 раз) без потери качества. Разработка и исследование таких материалов традиционно является областью интенсивного применения нейтронных методов (брэговская дифракция, МУРН и неупругое рассеяние).
Рассмотрим результаты, полученные по каждому из вышеуказанных материалов. Углерод давно используется в качестве матрицы для получения катализаторов, в том числе и с платиной, поскольку такая матрица имеет достаточную химическую стабильность и может быть получена в форме, обладающей огромной удельной поверхностью (до 2500 м2/г).
По крайней мере, два вида углерода, морфологически связанного с фуллеренами, могут рассматриваться в качестве перспективных матриц для получения высокоэффективных катализаторов:
1. Специальная углеродная сажа, так называемая фуллереновая сажа.
2. Сырая смесь фуллеренов (пустых фуллеренов). Обычный состав: 75-85% С60, 15-27% С70, 2-4% высших фуллеренов.
Для предварительной аттестации технологии приготовления катализаторов был приготовлен материал на основе углеродной сажи с использованием сплава Pt - (5%) Rh. Сажа была приготовлена испарением в электрической дуге металлоуглеродного композита в атмосфере гелия при пониженном давлении.
Для понимания дисперсности системы и размеров частиц, входящих в её состав, были проведены исследования малоуглового рассеяния нейтронов. Кривая, рассчитанная в трёхмодовом приближении для кластеров в форме сфер, достаточно хорошо описывает экспериментально измеренные точки. Из результатов была рассчитана объёмная доля частиц в зависимости от их радиуса. Было установлено, что состав композита включает три подсистемы, каждая со своим распределением по размерам и характеристическим размером (радиусом Rch). Распределение вблизи Rch~ 8 нм относится к кластерам платины, а два других с Rch~ 32 нм и Rch~ 45 нм относятся к матрице из фуллереновой сажи, причём размер Rch~32 нм относится к так называемой графеновой оболочке, окружающей металлическую частичку.
Эти две подсистемы "графитового" носителя при высокотемпературном окислении ведут себя по-разному. При приготовлении эффективного катализатора необходимо не только обращать внимание на степень дисперсности компонент катализатора, но и снимать графеновую оболочку с металлических кластеров, т.е. тщательно контролировать качество графитового носителя (в этом случае наиболее эффективно применение нейтронов). В настоящее время в ПИЯФ проводятся работы по оптимизации технологии получения эффективных катализаторов.
С помощью МУРН исследовались два образца, один из которых (Nafion) произведен фирмой Dupont, другой (МФ-4СK) - в Ленинграде (СССР).
Мембраны были исследованы в трех состояниях: 1 - исходное; 2 - после высушивания при 100оС; 3 - после насыщения высушенных образцов D2O.
В области импульсов q>0.2 нм-1 интенсивности рассеяния в обеих мембранах близкие, но при малых q<0.1 нм-1 было обнаружено заметное нарастание рассеяния в образце МФ-4СK, тогда как в мембране Nafion увеличение интенсивности при малых импульсах небольшое. Это указывает на явное различие структуры образцов: в Nafion преобладают рассеиватели (поры) c "небольшими" размерами, а в МФ-4СK наряду с объектами небольших размеров заметен вклад в рассеяние от неоднородностей среды c существенно большими размерами.
В первом приближении анализ данных проводили по двухмодовой модели Гинье. Радиус малых объектов (пор), видимых в Nafion, составляет приблизительно rG1=2.6±0.4 нм и не зависит от состояния мембраны. Мембрана МФ-4СK имеет радиус пор ~ rG1~3.5±0.5 нм, который больше, чем в мембране Nafion. Интенсивности рассеяния от "малой" фракции в сухой МФ-4СK примерно в два раза выше, чем в Nafion. Размер "крупных" пор в обоих типах мембран одинаков, но количество крупных пор существенно выше в МФ-4СK.
Из отношения радиусов было получено, что число "малых" пор в Nafion в ~ 7 раз больше, чем в МФ-4СK. Различие для крупной фракции тоже существенно. Если ее размер в обеих мембранах сопоставим RG~20 нм, то интенсивность рассеяния в МФ-4СK относительно Nafion выше в разы, т.е. МФ-4СK имеет существенно более высокую концентрацию "крупных" неоднородностей (пор), но при насыщении D2O ее полимерная матрица насыщается существенно медленнее, большие поры соединены каналами хуже. При погружении мембран в D2O установлено, что Nafion берет за 2.5 часа по массе 17.2% тяжёлой воды, а МФ-4СK лишь 12.3% (часть пор не заполняется, они будут исключены из процессов проводимости). При токовой нагрузке каналы в "российской" мембране имеют более высокую токовую нагрузку и теряют "проводящее" качество быстрее, т.е. старение мембраны происходит интенсивнее.
Одним из основных препятствий, встающих на пути водородной энергетики, является трудность хранения водорода в высококонцентрированной форме, необходимой для производства и повседневного применения. Обычные требования к хранилищам водорода ( (1) высокая емкость, (2) высокая скорость обмена и (3) более 1000 циклов поглощения-выхода) очень жестки и трудно осуществимы. Одними из перспективных материалов в этой области могут быть смешанные оксиды 3-d-металлов. Кроме того, поскольку предлагаемые материалы играют ключевую роль в процессе диссоциации водорода, они могут оказаться исключительно полезными в качестве катализаторов для ускорения десорбции водорода с более легких и более емких накопителей водорода, для которых процесс десорбции затруднен (боргидриды, гидриды металлов).
Были проведены комплексные нейтронные исследования (брэгговская и малоугловая дифракция). Для этих исследований были использованы дважды изотоп-замещённые образцы (Cu63-Cu65, H-D). Установлено, что распределения кластеров меди и водорода существенно отличаются по размерам и локализации в носителе. Распределение водорода характеризуется двухмодовым распределением с малым характерным радиусом Rch~32 нм и Rch~18 нм, по-видимому, локализованном (адсорбированном) на поверхности медных кластеров (Rch~ 7 нм). Наличие медных кластеров подтверждают и рентгеновские и электронографические исследования.
Эти исследования позволили предложить модель "медный кластер - дефект", которые обеспечивают обмен водород - медь между объёмным дефектом и поверхностным кластером меди в зависимости от условий термообработки.
Предварительные исследования и оценки показали, что распределение водорода в матрице накопителя сильно зависит от температуры. Это было дополнительно исследовано. Определялось изменение количества водорода вблизи медного кластера и объёмного дефекта в зависимости от температуры при сравнении с комнатной температурой. Отрицательные значения этой величины показали, что средняя плотность ZnO выше плотности в объёмном дефекте.
Подвижность водорода при разных температурах была проверена с помощью исследований неупругого рассеяния нейтронов на резонансном спин-эхо спектрометре. По результатам измерений была оценена зависящая от времени автокорреляционная функция водорода, которая описывает вероятность нахождения частицы в определённом объёме импульсного пространства. Область заметного изменения корреляционной функции связана с характерным временем релаксации водородной подсистемы (в нашем случае ~ 1 пикосекунда). Это позволяет оценить коэффициент диффузии. Коэффициент диффузии D~10-4 см2/с сохраняется до низких температур. Возрастание количества водорода вблизи дефектов означает, что становятся активными в удержании водорода дефекты с низкой энергией активации. Таким образом, увеличение емкости накопителя водорода, в принципе, можно добиться увеличением концентрации дефектов с высоким значением энергии десорбции. Результаты, полученные для Cu0.08Zn0.92O, указывают, что эта система способна эффективно абсорбировать и десорбировать 0.6 вес.% водорода. При этом порядка 70% абсорбированного водорода может быть извлечено при комнатной температуре и атмосферном давлении. По предварительным оценкам при оптимизации состава и искусственном увеличении дефектности структуры емкость по водороду таких соединений может достигать 3-6 вес.%.
В результате химического травления было установлено, что содержание меди несущественно отличалось от исходного. Тенденция зависимости содержания гексагонального нитрида бора, определённого путём химического травления и по данным рентгенофазового анализа была аналогична. Поэтому было взято среднее значение содержания гексагонального нитрида бора по результатам определения с помощью этих двух методик.
Из представленных данных можно сделать вывод, что расплав меди катализирует фазовый переход кубического нитрида бора в гексагональную структуру, причём данный процесс происходит с выделением энергии.
При концентрациях BNк свыше 70мас.% каталитическое взаимодействие между медью и кубическим нитридом бора по изменению теплового эффекта уже началось, однако образование гексагонального нитрида бора не происходит. Данный факт можно объяснить, незначительной областью образования расплава и релаксацией структуры кубического нитрида бора относительно воздействия. В диапазоне концентраций от 40 до 70мас.% уменьшение гексагонального нитрида бора происходит почти линейно, что по характеру зависимости совпадает с изменением теплового эффекта. Площадь пиков вступающих во взаимодействие меди и КНБ сопоставимы. И, наконец, при концентрациях BNк до 40мас.% наблюдаемое изменение концентрации гексагонального нитрида бора менее значительно. Данное изменение обусловлено, вероятнее всего, областью контакта, которая уменьшается, а образовавшийся на поверхности КНБ гексагональный нитрид бора ослабляет каталитическое воздействие меди. Таким образом, механизм каталитического взаимодействия диффузионный.
Литература
[1] М.С. Друй, А.А. Лавринович, Т.П. Никитина, Ю.Г. Саксонов. Тр. ВНИИАШ, 15, 21 (1974)
[2] Д.М. Карпинос, Н.А. Богомаз, С.П. Листовничая. Исследование нитридов. Киев: ИПМ АН УССР (1975). с.78.
[3] Г.А. Ясинская, Огнеупоры, 1965, 30, №2, с. 20-23.
[4] O. Glemser, H. Haeseler, Z. anorg, und allg. Chem.279, №3/4, S.141-145 (1955).
[5] В.А. Рабинович, З.Я. Хавин. Краткий химический справочник. С-Пт.: Химия. (1994).429с.
[6] М.В. Харитонова, И.Я. Ривлин. Абразивы и алмазы. №5, с.3. (1967).