
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Методические особенности изучения темы "Атомы. Молекулы" в школьном курсе химии
Курсовая работа: Методические особенности изучения темы "Атомы. Молекулы" в школьном курсе химии
Глава 1. Теоретическая поддержка тема Атомы и молекулы. Чистые вещества и смеси. Простые и сложные вещества
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы - молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.
По сравнению с многообразием веществ число атомов весьма ограничено. Атомы могут различным образом соединяться друг с другом. Как из букв алфавита можно составить сотни тысяч слов, так из одних и тех же атомов образуются молекулы или кристаллы огромного количества различных веществ, из которых состоит окружающий мир.
Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов.
Вещество (например, сахар) можно размолоть на самой тонкой мельнице и все равно каждая крупинка будет состоять из огромного количества одинаковых молекул сахара и сохранит все известные нам свойства этого вещества. Даже если раздробить вещество на отдельные молекулы, как это происходит при растворении сахара в воде, то вещество продолжает существовать и проявлять свои свойства (в этом легко убедиться, попробовав раствор на вкус). Значит, самостоятельно существующая молекула сахара - это еще вещество под названием "сахар" (пусть даже очень маленькое количество этого вещества). Но если продолжить дробление дальше, то придется разрушить молекулы. А разрушив молекулы или даже отняв у них по паре атомов (из трех десятков, составляющих молекулу сахара!), мы уже разрушаем само вещество. Конечно, атомы никуда не исчезают - они начинают входить в состав каких-то других молекул. Но сахар как вещество при этом перестает существовать - он превращается в какие-то другие вещества.
Вещества не вечны, потому что не вечны их молекулы. Зато атомы практически вечны. В каждом из нас, возможно, найдется какое-то количество атомов, существовавших еще во времена динозавров. Или участвовавших в походах Александра Македонского, или в плавании Колумба, или побывавших при дворе Ивана Грозного.
Несмотря на то, что молекулы очень малы, их устройство можно выяснить различными физическими и химическими методами. Чистое вещество состоит из молекул одного вида. Если физическое тело содержит молекулы нескольких видов, то мы имеем дело со смесью веществ. Понятия "чистый" в химии и в быту неодинаковы. Например, когда мы говорим: -"Какой чистый воздух!" - то на самом деле вдыхаем сложную смесь нескольких газообразных веществ. Химик скажет о лесном воздухе: "Нужно серьезно поработать, чтобы выделить из этой смеси чистые вещества". Интересно, что в атмосфере любого из них по отдельности человек существовать бы не смог. В таблице 1-1 приведено соотношение этих газообразных веществ в свежем лесном воздухе.
Таблица 1-1. Состав атмосферного воздуха в сосновом лесу.
| Вещество | % по объему | Вещество | % по объему |
| азот | 77% | вода (пар) | 0 - 2% |
| кислород | 21% | озон |
7·10-6 % |
| аргон | 0,93% | терпинеол | следы |
| углекислый газ | 0,03% |
В таблице 1-1 азот, кислород, аргон и т.д. - это отдельные вещества. Вещество азот состоит из молекул азота, всем известное вещество вода - из молекул воды, терпинеол состоит из молекул терпинеола. Молекулы этих веществ могут быть очень разными - от простейших, состоящих из двух-трех атомов (азот, кислород, озон, углекислый газ) - до молекул, состоящих из многих атомов (такие молекулы встречаются в живых организмах). Например, терпинеол, который образуется в хвойных деревьях и придает воздуху запах свежести.
Это означает, что веществ, как и видов молекул, может быть бесконечное множество. Никто не может назвать точное число веществ, известных людям сегодня. Можно лишь ориентировочно сказать, что таких веществ - более семи миллионов. Это означает, что человечеству известно устройство примерно семи миллионов молекул.
Устройство и состав молекул можно описывать разными способами, например так, как это сделано на рис. 1-1, где атомы имеют вид шариков.
Атомы в молекулах разных веществ связаны друг с другом в строго определенном порядке, установление которого - одно из самых интересных занятий в работе химика. Размеры шариков имеют физический смысл и примерно соответствуют относительным размерам атомов. Те же самые вещества могут быть изображены иначе - с помощью химических символов. Издавна за каждым видом атомов в химии закреплен символ из латинских букв. В таблице 1-2 приведены символические записи веществ, изображенных на рис. 1-1. Такие символические записи называются химическими формулами.
Таблица 1-2. Химические формулы веществ из рис. 1-1. Цифра ниже символа показывает, сколько атомов данного вида содержится в молекуле. Эта цифра называется индексом. По традиции индекс "1" никогда не пишут. Например, вместо С1О2 пишут просто: СО2.
| Вещество | Формула | Вещество | Формула |
| азот |
N2 |
вода |
H2O |
| кислород |
O2 |
озон |
O3 |
| аргон | Ar | терпинеол |
C10H18O |
| углекислый газ |
CO2 |
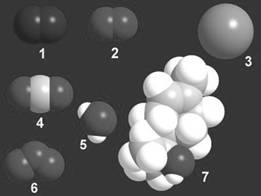
Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон (образуется из кислорода при грозовых разрядах), 7 - терпинеол (выделяется хвойными деревьями)
Существует условное деление веществ на простые и сложные. Молекулы простых веществ состоят из атомов одного вида. Примеры: азот, кислород, аргон, озон. Молекулы сложных веществ составлены из атомов двух и более видов: углекислый газ, вода, терпинеол.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух - смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекл только одного вида, смесью не является.
Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида.
Сложное вещество состоит из молекул, построенных из атомов разных видов.
Смесью называется вещество, состоящее из молекул (или атомов) двух или нескольких веществ. Вещества, составляющие смесь, могут быть простыми и сложными.
На Земле пока никто не смог написать такой книги, в которой были бы описаны абсолютно все известные человечеству вещества - от "а" до "я". Впрочем, в этом нет особой необходимости. Чтобы знать химию, не нужно заучивать названия или сведения об огромном количестве веществ - достаточно знать законы, по которым они образуются и взаимодействуют с другими веществами.
Глава 2. Методические особенности изучения темы Атомы. Простые и сложные вещества
Методика этих уроков изменилась потому, что заменен опыт, лежащий в основе объяснения. Поскольку оксид ртути исключен из числа школьных реактивов, то доказательство разложения молекул на атомы й образования новых молекул из получившихся атомов можно дать на опыте электролиза воды. Помогут уяснить сущность процесса рисунки, модели, схематическая запись реакции разложения воды. На этом уроке нужно обратить внимание учащихся на то, что молекулы веществ могут состоять как из атомов одного вида (водород, кислороде, так и из атомов разных видов (вода). Понятия простого и сложного вещества формируются пока еще без употребления термина "химический элемент". Так, учащиеся, как -показал опыт, лучше понимают особенность состава простых и сложных веществ и готовятся к восприятию следующего урока на тему: "Химические элементы".
В целях развития у учащихся умений обобщать важно предлагать им задания, позволяющие понять сущность выполненного химического эксперимента.
Задание 1. (Выполнение задания под руководством учителя.)
Сделайте выводы о новом веществе, полученном в опыте, в соответствии с планом:
1. Сульфид железа (II) имеет некоторое сходство с серой (Какое?), но существенно отличается от нее (Чем?).
2. Сульфид железа (II) имеет некоторое сходство с железом (Какое?), однако существенно отличается от него (Чем?).
3. Почему сульфид железа (II) нельзя назвать смесью серы и железа?
3адание 2. (Рассчитано на более высокий уровень знаний и Самостоятельность действий учащихся.)
Дайте названия каждому опыту, которые демонстрировал учитель: разделение смеси железа и серы магнитом; разделение серы и железа водой; получение сульфида железа (II); проверка свойств сульфида железа (II) магнитом; проверка свойств гидроксида железа (II) водой.
2. Сколько и какие вещества участвовали
При объяснении нового материала нужно обратить внимание учащихся на то, что одной из причин многообразия веществ является способность атомов одного вида образовывать простые вещества, а также входить в состав сложных, что вещества находятся во взаимосвязи при химических превращениях, что они имеют сходство: простые и сложные вещества состоят из атомов и молекул, относятся к одному виду материи. Анализ результатов опыта по разложению воды позволяет утверждать, что атомы при химических реакциях сохраняются. Сущность —это главное, основное а явлении, часто не наблюдаемое непосредственно, то, о чем мы судим по внешним проявлениям, анализируя- и сопоставляя их. Важно при этом сформулировать вывод, имеющий мировоззренческое значение: сущность любой химической реакции заключается в перегруппировке атомов исходных веществ, в результате чего образуются новые вещества. Или по-другому: сущность химической реакции состоит в образовании новых веществ из атомов, входивших ранее в состав исходных веществ. Исходные вещества и продукты реакции взаимосвязаны, потому что они включают одни и те же виды атомов.

Сравнение существенных признаков смесей и сложных веществ можно наглядно оформить в виде таблицы 2.
Задачи.
1.7. Представьте, что у вас в руках волшебная палочка и вы превращаете: а) камень в песок; б) кислород в озон; в) лед в пар. В каком случае вы проводите химические превращения?
1.8. Найдите простые вещества среди перечисленных веществ: воздух, вода, озон, мед, морская вода, кислород, азот.
1.9. Из перечисленных веществ два являются смесями. Найдите их:
а) кислород,
б) озон
в) вода в реке,
г) вода в облаке,
д) поваренная соль,
е) воздух,
ж) сахар.
Как вы уже знаете, атомы бывают одинаковые и разные. Чем разные атомы отличаются друг от друга по строению, вы скоро узнаете, а пока скажем только, что разные атомы отличаются химическим поведением, то есть своей способностью соединяться друг с другом, образуя молекулы (или немолекулярные вещества).
Иными словами, химические элементы – это те самые виды атомов, которые упоминались в предыдущем параграфе.
Каждый химический элемент имеет свое название, например: водород, углерод, железо и так далее. Кроме того, каждому элементу присвоен еще и свой символ. Эти символы вы видите, например, в " Таблице химических элементов" в школьном кабинете химии.
Химический элемент – абстрактная совокупность. Так называют любое число атомов данного вида, причем атомы эти могут находиться где угодно, например: один – на Земле, а другой – на Венере. Химический элемент нельзя ни увидеть, ни пощупать руками. Атомы, образующие химический элемент, могут быть как связаны, так и не связаны друг с другом. Следовательно, химический элемент не является ни веществом, ни материальной системой.
Глава 3. Методические разработки по теме: "Простые и сложные вещества"
Цель урока:
· Знать определение атома, молекулы, простого и сложного вещества.
· Уметь различать простые и сложные вещества; смеси и сложные вещества.
· Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция). демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
3) Приведите примеры смесей (не менее двух), которые можно разделить:
1 вариант:
А) фильтрованием-------------------------------------------------------------------
Б) отстаиванием----------------------------------------------------------------------
2 вариант:
А) выпариванием---------------------------------------------------------------------
Б) дистилляцией----------------------------------------------------------------------
2. Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
Какое вещество называется чистым? Что такое "вещество"? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям "молекула" и "атом". (Приложение №2).
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.
1. Прослушайте инструктаж по охране труда.
2. Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
3. Опишите их физические свойства.
4. Оформите результаты в таблицу. (Приложение №3).
|
Физические свойства |
железо |
вода |
сера |
Карбонат кальция |
| Агрегатное состояние (твердое, жидкое, газообразное) | ||||
| Цвет | ||||
| Блеск | ||||
| Растворимость в воде | ||||
| Хрупкость (пластичность) | ||||
| Теплоэлектропроводность | ||||
| Температура кипения, температура плавления. | ||||
| Простое (сложное) вещество |
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера - простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла. Нагреваем железо с опилками. Образовалось новое вещество, которое невозможно разделить, не действует на него магнит. Сульфид железа – это чистое сложное вещество.
Таблица №1. Сравнение смесей и сложных веществ.
|
Смесь |
Сложное вещество |
| 1. Вещества сохраняют свои свойства. | 1. Свойства исходных веществ не сохраняются. |
| 2. Вещества можно разделить физическими методами. | 2. Сложное вещество нельзя разделить физическими методами. |
| 3. Количественный состав может быть произвольным. | 3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента. Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
|
Вопросы и задания |
Вещества |
|
|
вода |
Водород и кислород (смесь) |
|
| Можно ли разделить эти вещества на более простые компоненты. Не разрушая молекул? Почему? | ||
| Сохраняется ли способность молекул кислорода поддерживать горение? Почему? | ||
Рефлексия и подведение итогов.
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. "Химия 8 класс".
Глава 4. Дидактические карточки по теме: Вещества. Простые и сложные вещества. Физические свойства веществ
Часть А
1. Запишите определения.
Химия – ……………………………………………………………...
Вещество – …………………………………………………………..
Химический элемент – …………………………………………......
Свойства веществ – …………………………………………..........
2. Заполните схему (схема 1).
схема 1
Часть Б
3. Заполните таблицу (табл. 1).
Таблица 1 Физические свойства веществ
| Вещество | Агрегатное состояние | Цвет | Запах | Твердость | Растворимость в воде |
| Поваренная соль | |||||
| Питьевая сода | |||||
| Вода | |||||
| Кислород | |||||
| Железо |
4. Из приведенного ниже перечня названий веществ и тел выпишите в два столбика:
в первый – названия веществ,
во второй – физических тел.
Медная монета, стекло, железо, поваренная соль, кусочек сахара, ножницы, ваза, вода, капля росы, железная ложка, булавка, снежинка, железный гвоздь, мел.
| Вещество | Физическое тело |
5. Заполните таблицу (табл. 2).
Для этого в правой части таблицы напишите названия веществ, из которых могут быть изготовлены приведенные физические тела.
Таблица 2
| Физические тела | Вещества | ||
| Линейка | |||
| Ложка | |||
| Стакан | |||
6. Заполните таблицу (табл. 3).
Для этого в правой части таблицы напишите названия физических тел, которые могут состоять из указанных в левой части веществ.
Таблица 3
| Вещества | Физические тела | ||
| Графит | |||
| Алюминий | |||
| Серебро | |||
7. Найдите выигрышный путь (по типу "крестики-нолики") в предложенных ниже квадратах, если он составляет:
а) вещество;
б) физическое тело.
| а) | б) | ||||
| Фарфоровая ваза | Медный колокол | Ложка | Глюкоза | Медная проволока | Древесная стружка |
| Железный гвоздь | Золото | Кусочек сахара | Сахар | Кусочек мела | Медный колокол |
| Уксусная кислота | Поваренная соль | Сера | Химическая колба | Водород | Кремний |
8. Путь к вершине пирамиды (схема 2) – вещество.
Схема 2
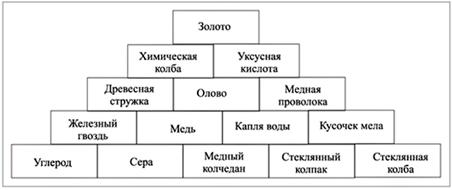
9. Определите, физическим телом или веществом являются перечисленные в правой части таблицы (табл. 4) объекты.
Из букв, соответствующих правильным ответам, вы получите название одного из классов простых веществ.
Таблица 4
| Название объекта | Физическое тело | Вещество |
| Капля воды | Н | Щ |
| Сахар | Ф | Е |
| Медный колокол | М | Г |
| Химическая колба | Е | Д |
| Золото | Ц | Т |
| Древесная стружка | А | Ж |
| Уксусная кислота | Х | Л |
| Вода | Ъ | Л |
| Кусочек мела | Ы | Б |
10. Из перечисленных ниже веществ выпишите отдельно простые и сложные вещества.
Ацетилен (C2H2), глюкоза (С6Н12О6), магний (Mg), озон (О3), бор (В), негашеная известь (СаО), питьевая сода (NaHCO3), водород (Н2), соляная кислота (HCl), сера (S).
| Простые вещества | ………………………………………………………………… |
| Сложные вещества | ………………………………………………………………… |
Часть В. Задания для самоконтроля
Обведите кружком правильные ответы (их может быть больше одного).
1. Химия – это наука:
а) о явлениях, происходящих в природе;
б) о телах и их свойствах;
в) о веществах, их свойствах и взаимных превращениях этих веществ друг в друга;
г) о явлениях, происходящих в мире физических тел.
2. Выберите из приведенных ниже названий вариант I – вещества; вариант II – физические тела:
а) стакан; б) стекло;
в) линейка; г) вода.
3. К физическим свойствам из перечисленных ниже понятий
вариант I – не относится; вариант II – относится:
а) запах; б) цвет;
в) растворимость в воде; г) выпуклость.
4. О железе говорится как вариант I – о химическом элементе; вариант II – о простом веществе:
а) твердый;
б) входит в состав некоторых солей;
в) притягивается магнитом;
г) входит в состав гемоглобина крови человека.
Литература
1. Фельдман Ф.Г., Рудзитис Г.Е. Химия. 8 класс. М.: Просвещение, 1997;
2. Иванова Р.Г., Иодко А.Г. Система самостоятельных работ учащихся при изучении неорганической химии. М.: Просвещение, 1988;
3. Тыльдсепп А.А., Корк В.А. Мы изучаем химию. М.: Просвещение, 1988;
4. Химия в школе, 1991, № 1, с. 30–31;
5. Радецкий А.М., Горшкова В.П. Дидактический материал по химии. 8–9 класс. М.: Просвещение, 1999.