
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Влияние добавок на устойчивость пероксида водорода в водных растворах
Реферат: Влияние добавок на устойчивость пероксида водорода в водных растворах
Государственное учреждение образования
«ДОВСКАЯ ГИМНАЗИЯ»
Учебно-исследовательская работа
«Влияние добавок на устойчивость пероксида водорода в водных растворах»
Довск
![]()
СОДЕРЖАНИЕ
Введение
Основная часть
Пероксид водорода
Экспериментальная часть
Заключение и выводы
Список источников и литературы
ВВЕДЕНИЕ
В настоящее время пероксид водорода H2O2 находит широкое применение, особенно в медицине, где его используют в качестве:
- антисептика в концентрации 3%;
- стерилизующего агента в концентрации 6%;
- дезинфицирующего средства;
- кровоостанавливающего средства.
Растворы пероксида водорода (ПВ) незаменимы в процессах лечения и ухода за новорожденными детьми, так как являются безвредными и при воздействии на поврежденные ткани из ПВ образуются нетоксические вещества – вода и кислород. Очень важным является отсутствие раздражающего действия у препарата.
Водные растворы пероксида водорода (с добавками моющих средств) используются в качестве моюще-дезинфицирующих средств в аптечных, клинических, детских дошкольных и других учреждениях. Однако широкое их применение сдерживается низкой стабильностью: при добавлении моющих средств к раствору ПВ, последний разрушается и быстро теряет «активный» кислород. По этой причине рабочие растворы моюще-дезинфицирующих средств на основе H2O2 на данный момент готовят непосредственно перед применением, а срок их хранения составляет всего несколько часов, что приводит к необходимости их стабилизации. Поэтому является актуальным поиск веществ, которые бы не катализировали разложение H2O2, способствовали усилению терапевтического действия и были бы безвредными для человека.
Представляет интерес изучение влияния некоторых поверхностно-активных веществ (ПАВ), в частности твина-80, на процесс разложения пероксида водорода.
Цель работы: организовать исследовательскую деятельность по изучению влияния веществ на процесс разложения пероксида водорода.
Задачи:
1. Изучить имеющуюся литературу о строении молекулы, физических и химических свойствах, применении пероксида водорода.
2. Экспериментально определить влияние различных катализаторов на процесс разложения пероксида водорода.
3. Исследовать влияние поверхностно-активных веществ (твина – 80) на устойчивость пероксида водорода в водных растворах.
ОСНОВНАЯ ЧАСТЬ
1. Пероксид водорода
1.1 Строение молекулы. Физические и химические свойства
Пероксид водорода – соединение водорода и кислорода H2O2, содержащее 94% кислорода по массе. В молекулах H2O2 содержатся пероксидные группы -О-О-, которые во многом определяют свойства этого соединения. Впервые пероксид водорода получил в 1818 г. французский химик Луи Жак Тенар (1777-1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
![]() BaO2 + 2HCl BaCl2 + H2O2
BaO2 + 2HCl BaCl2 + H2O2
Структурная формула соединения Н-О-О-Н показывает, что два атома кислорода непосредственно соединены друг с другом. Связь это непрочна и обусловливает неустойчивость молекулы. Действительно, чистая H2O2 способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее.
Чистый пероксид водорода – бесцветная сиропообразная жидкость, которая под достаточно уменьшенным давлением перегоняется без разложения. Замерзание H2O2 сопровождается сжатием (в отличие от воды). Белые кристаллы пероксида водорода плавятся при t = -0.5°C, т.е. почти при той же температуре, что и лёд. Растворы H2O2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30°С, а 60%-ный – при минус 53°С. [1]
Степень окисления кислорода в пероксиде водорода равна -1, т.е. имеет промежуточное значение между степенью окисления кислорода в воде (-2) и в молекулярном кислороде (0). Поэтому H2O2 обладает свойствами как окислителя, так и восстановителя. В качестве примеров, в которых H2O2 служит окислителем, можно привести окисление нитрита калия:
![]() KNO2 + H2O2 KNO3
+ H2O
KNO2 + H2O2 KNO3
+ H2O
и выделение йода из иодида калия:
![]() 2KJ + H2O2 J2
+ 2KOH
2KJ + H2O2 J2
+ 2KOH
Концентрированные растворы H2O2 обладают сильным окислительным действием. Так, при действии 65%-ного раствора H2O2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Примером восстановительной способности пероксида водорода служит реакция взаимодействия его с оксидом серебра(I) [2]:
![]() Ag2O + H2O2 2Ag + H2O + O2
Ag2O + H2O2 2Ag + H2O + O2
1.2 Применение
Применение пероксида водорода связано с его окислительной способностью и с безвредностью продукта его восстановления (Н2О).
Его используют для отбелки тканей и мехов, в пищевой промышленности (при консервировании пищевых продуктов), в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике. [3]
В медицине растворы H2O2 используют в качестве средств, обладающих антисептическими, дезинфицирующими свойствами. Они применяются для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. [4]
3% и 6% водные растворы пероксида водорода (с добавками моющих средств) используются в качестве моюще-дезинфицирующих средств в аптечных, клинических, детских дошкольных и других учреждениях. Однако широкое их применение сдерживается низкой стабильностью: при добавлении моющих средств к раствору пероксида водорода, последний разрушается и быстро теряет «активный» кислород. По этой причине рабочие растворы моюще-дезинфицирующих средств на основе H2O2 готовят непосредственно перед применением, а срок их хранения составляет всего несколько часов. [5]
В литературе имеются сведения о большом количестве стабилизаторов H2O2. Наибольшее распространение получили органические и неорганические кислоты. Однако они оказывают раздражающее действие на кожу и слизистые оболочки, поэтому их применение ограничено. Именно поэтому в настоящее время является актуальным изучение влияния поверхностно-активных веществ (ПАВ) на разложение водных растворов ПВ различной концентрации. Одним из таких ПАВ является твин-80.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Влияние различных катализаторов на скорость разложения пероксида водорода
Уравнение реакции разложения:
![]()
![]() 2Н2О2 2Н2О + О2
2Н2О2 2Н2О + О2
Исследовалось влияние на скорость разложения Н2О2 следующих катализаторов: оксида марганца (IV) MnO2; оксида железа (III) Fe2O3; активированного угля С; перманганата калия KMnO4; хлорида железа (III) FeCl3; дихромата калия K2Cr2O7. [6]
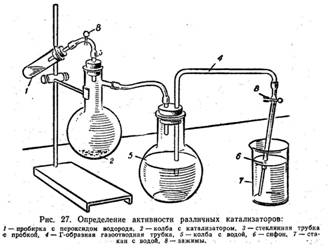
Рис. 1. Прибор для определения активности различных катализаторов
Опыты проводились в следующей последовательности:
1. Проверялась герметичность прибора (см. рисунок и фотографию выше), для чего закрываются пробки и открываются зажимы 8: вода не должна вытекать в стакан.
2. В пробирку 1 наливаем 5 смі пероксида водорода (6%-ного) и перекрываем резиновую трубку зажимом 8.
3. В колбу 2 вносим катализатор и вставляем в неё трубку 3, соединенную с пробиркой1.
4. Выравниваем давление внутри прибора с атмосферным давлением. С этой целью открываем зажим 8 сифона 6 и поднимаем стакан 7 с водой так, чтобы вода в нём и в колбе находилась на одинаковом уровне, и затем снова закрываем зажим.
5. Воду выливаем из стакана и наливаем в него точный её объем – 100смі, предварительно отмерив его мензуркой.
6. Опускаем кончик сифона 6 в стакан 7 с водой.
7. Открываем оба зажима 8 на приборе и быстро вливаем раствор пероксида водорода в колбу 2 с катализатором.
8. Через 3минуты вновь приводим давление внутри прибора к атмосферному давлению.
9. Закрываем зажимы сифона 6 и измеряем объем воды, вытесненной в стакан кислородом.
10. Из измеренного объема воды вычитаем 100смі, т.е. объем воды, ранее добавленной в стакан.
Результаты опытов отражены в таблице 1:
Таблица 1.
| № п./п. | Катализатор | Объем выделившегося кислорода, смі |
| 1 |
Оксид железа (III) Fe2O3 |
9 |
| 2 | Активированный уголь С | 5 |
| 3 |
Перманганат калия KMnO4 |
3 |
| 4 |
Хлорид железа (III) FeCl3 |
10 |
| 5 |
Дихромат калия K2Cr2O7 |
8 |
| 6 |
Оксид марганца (IV) MnO2 |
7 |
В случае с перманганатом калия наблюдалось образование оксида марганца (IV), что указывает на протекание окислительно-восстановительной реакции, которую можно отразить следующим уравнением:
3H2O2 + 2KMnO4 2MnO2 + 3O2 + 2KOH + 2H2O
Поэтому говорить о KMnO4 как катализаторе не приходится. С учетом опытных данных располагаем испытанные катализаторы в порядке возрастания их каталитической активности:
Активированный уголь, оксид железа (III), дихромат калия, хлорид железа (III), оксид марганца (IV).
2.2 Действие твина-80 на разложение пероксида водорода при различных температурах
Объектами исследования были водные растворы пероксида водорода в концентрации 3% и 6%, так как они используются в качестве антисептика (3%-ный раствор), стерилизующего агента и моюще-дезинфицирующего средства (6%-ный раствор).
В приготовленные растворы H2O2 указанных концентраций добавляем твин-80 в концентрациях 0,2%; 0,5%; 1%; 2%. Контролем являлись растворы пероксида водорода 3% и 6% без добавок. [6] Приготовленные растворы помещали во флаконы из полимерного материала. Затем термостатировали при t=65єC и t=50єC. Через определенное время отбирали пробу от каждого раствора и проводили определение количественного содержания ПВ в приготовленных растворах и в контрольном опыте.
Для определения количественного содержания H2O2 использовали перманганатометрический метод (титрант - раствор перманганата калия).
Определение концентрации пероксида водорода проводили по следующей методике: из пробы модельного раствора отбирали аликвоту, равную 0,5мл., и переносили в колбу для титрования; в эту же колбу прибавляли около 5мл. дистиллированной воды и около 2,5 мл. серной кислоты разведенной 1:5. Содержимое колбы слегка перемешивали и титровали раствором перманганата калия до слабо-розового окрашивания, не исчезающего после перемешивания в течение 10-15 и более секунд. [7]
В основе метода лежит реакция:
![]() 2KMnO4 + 5H2O2
+ 3H2SO4 2MnSO4 + 5O2 + K2SO4
+ 8H2O,
2KMnO4 + 5H2O2
+ 3H2SO4 2MnSO4 + 5O2 + K2SO4
+ 8H2O,
в результате которой перманганат-ион переходит в бесцветный катион марганца (2+). Окончание титрования устанавливали по наличию розовой окраски перманганат-иона, не исчезающей в течение 30 секунд.
Концентрацию пероксида определяли по формуле:
![]() Vm*0.0017*100% ,
Vm*0.0017*100% ,
где С – концентрация H2O2 (%),
0.5 - Vm – объем раствора KMnO4,
ушедшего на титрование (смі),
0,5 – объем анализируемой пробы,
взятой для титрования (смі),
0,0017 – титр соответствия 0,2н
раствора перманганата калия по H2O2.
Результаты исследований отражены в таблицах 2.1, 2.2
Таблица 2.1. Изменение концентрации 3% и 6% водного раствора H2O2 в присутствии добавок твина-80 в различных концентрациях при температуре 65єС
|
№ |
Состав модельных растворов |
Время наблюдения |
||
| 0 ч. | 72 ч. | 168 ч. | ||
| Концентрация раствора ПВ, % | ||||
|
H2O2 3% Вода до 100% |
3 | 2,26 | 1,54 | |
|
1 |
H2O2 3% Твин-80 0,2% Вода до 100% |
3 | 2,91 | 2,81 |
|
2 |
H2O2 3% Твин – 80 0,2% Вода до 100% |
3 | 2,92 | 2,84 |
|
1 |
H2O2 3% Твин-80 0,5% Вода до 100% |
3 | 2,96 | 2,92 |
|
2 |
H2O2 3% Твин-80 0,5% Вода до 100% |
3 | 2,89 | 2,78 |
|
1 |
H2O2 3% Твин-80 1% Вода до 100% |
3 | 2,81 | 2,61 |
|
2 |
H2O2 3% Твин-80 1% Вода до 100% |
3 | 2,83 | 2,66 |
|
H2O2 6% Вода до 100% |
6 | 5,18 | 4,35 | |
|
1 |
H2O2 6% Твин-80 0,2% Вода до 100% |
6 | 5,35 | 4,69 |
|
2 |
H2O2 6% Твин-80 0,2% Вода до 100% |
6 | 5,31 | 4,64 |
|
1 |
H2O2 6% Твин-80 0,5% Вода до 100% |
6 | 5,17 | 4,36 |
|
2 |
H2O2 6% Твин-80 0,5% Вода до 100% |
6 | 5,18 | 4,37 |
|
1 |
H2O2 6% Твин-80 1% Вода до 100% |
6 | 5,55 | 5,12 |
|
2 |
H2O2 6% Твин-80 1% Вода до 100% |
6 | 5,62 | 5,2 |
Таблица 2.2. Изменение концентрации 6% водного раствора H2O2 в присутствии добавок твина-80 в различных концентрациях при температуре 50єС
|
№ |
Состав Модельных растворов |
Время наблюдения |
||||
| 0 ч. | 72 ч. | 144 ч. | 264 ч. | 432 ч. | ||
| Концентрация раствора ПВ, % | ||||||
|
1 |
H2O2 6% Вода до 100% |
6 | 5,57 | 5,03 | 4,97 | 4,78 |
|
2 |
H2O2 6% Вода до 100% |
6 | 5,99 | 5,10 | 4,90 | 4,76 |
|
3 |
H2O2 6% Вода до 100% |
6 | 5,57 | 5,17 | 4,76 | 4,43 |
|
1 |
H2O2 6% Твин-80 0,2% Вода до 100% |
6 | 5,92 | 4,90 | 4,83 | 4,83 |
|
2 |
H2O2 6% Твин-80 0,2% Вода до 100% |
6 | 5,61 | 4,76 | 4,76 | 4,76 |
|
3 |
H2O2 6% Твин-80 0,2% Вода до 100% |
6 | 5,99 | 4,83 | 4,83 | 4,83 |
|
1 |
H2O2 6% Твин-80 0,5% Вода до 100% |
6 | 4,74 | 4,76 | 4,76 | 4,76 |
|
2 |
H2O2 6% Твин-80 0,5% Вода до 100% |
6 | 4,69 | 4,76 | 4,76 | 4,76 |
|
3 |
H2O2 6% Твин-80 0,5% Вода до 100% |
6 | 4,74 | 4,76 | 4,76 | 4,76 |
|
1 |
H2O2 6% Твин-80 1% Вода до 100% |
6 | 4,76 | 4,76 | 4,76 | 4,76 |
|
2 |
H2O2 6% Твин-80 1% Вода до 100% |
6 | 4,69 | 4,69 | 4,76 | 4,76 |
|
3 |
H2O2 6% Твин-80 1% Вода до 100% |
6 | 4,69 | 4,69 | 4,76 | 4,62 |
|
1 |
H2O2 6% Твин-80 2% Вода до 100% |
6 | 4,63 | 4,63 | 4,76 | 4,62 |
|
2 |
H2O2 6% Твин-80 2% Вода до 100% |
6 | 4,76 | 4,76 | 4,76 | 4,62 |
|
3 |
H2O2 6% Твин-80 2% Вода до 100% |
6 | 4,69 | 4,63 | 4,76 | 4,62 |
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ
1. Изучено влияние различных веществ на процесс разложения пероксида водорода в водных растворах.
2. Экспериментально установлено действие различных катализаторов на скорость разложения H2O2.
3. При хранении раствора пероксида водорода с добавлением твина-80 при 50°С процесс разложения:
а) замедляется при небольшой концентрации твина-80 (0,2%);
б) ускоряется при больших концентрациях твина-80.
4. При хранении раствора пероксида водорода при 65°С с добавлением твина-80 (концентрация 0,2%, 0,5%, 1%) процесс разложения замедляется.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ И ЛИТЕРАТУРЫ
1. Соколова Л.Ф., Арефьева Л.И., Пархач М.Е. Стабилизация водных растворов пероксида водорода. Фармация. 1987, №4. с. 74-76
2. Глинка Н.Л. Общая химия. М., Интеграл-Пресс, 2009. с. 474-475
3. http://slovari.yandex.ru/dict/krugosvet/article.htm, И. Леенсон. Пероксид водорода.
4. Шамб У., Сеттерфилд Ч., Вентворс Р. Перекись водорода. Пер. с англ. М. 1958. с. 15-50
5. Химическая энциклопедия/ Под ред. И.Л. Кнунянц// М.: Большая российская энциклопедия, 1992. т.3. с. 245-249
6. Назарова Т.С., Грабецкий А.А., Лаврова В.Н. Химический эксперимент в школе. М., «Просвещение». 1987. с. 52-56
7. Методические указания МУ 42-51-7-93 «Приготовление растворов пероксида водорода с моющими средствами», утв. Департамента Госсанэпиднадзора Минздрава РФ 08.02.93.