Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Розвиток творчої активності школярів у процесі розв’язування розрахункових задач з хімії
Курсовая работа: Розвиток творчої активності школярів у процесі розв’язування розрахункових задач з хімії
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Кафедра хімії
Розвиток творчої активності школярів у процесі розв’язування розрахункових задач з хімії
ЗМІСТ
Вступ
Розділ 1. Творча активність школярів, як педагогічна проблема
1.1 Поняття творчої активності
1.2 Шляхи формування творчої активності школярів
1.3 Розвиток творчої активності школярів в процесі вивчення хімії
Розділ 2. Задачі з хімії як засіб формування творчої активності школярів
2.1 Розрахункові задачі в процесі навчання хімії
2.2 Система розрахункових задач для учнів 9 – 11 класів загальноосвітньої школи
2.3 Система розрахункових задач для позакласної і індивідуальної роботи з обдарованими дітьми
Розділ 3. Експериментальна перевірка ефективності використання розрахункових задач з хімії у розвитку творчих здібностей школярів
3.1 Суть і методика експериментального дослідження
3.2 Аналіз результатів експериментальних даних
Висновки
Список використаних джерел
Вступ
Актуальність дослідження. Освіта, що є могутнім фактором культури, повинна сприяти максимальній реалізації закладених у людині можливостей. Тому, розвиток конкретного учня є основною метою навчального процесу.
Розуміння особистості, як суб’єкта розвитку, обумовлює необхідність організації активної інтелектуальної діяльності у навчанні. Треба зазначити, що це можливо через постійне створення проблемних ситуацій, що переходять в усвідомлення учнями хімічних задач. Одним з головних показників засвоєння учнями знань з хімії є вміння успішно користуватися знаннями при розв’язуванні розрахункових задач. В умовах задач завжди передбачено використання знань в конкретних, а не рідко в зовсім нових для учнів зв’язках.
Формування і розвиток творчих здібностей учнів у процесі розв’язування задач є проблемою, що займає чинне місце у психологічних і дидактичних дослідженнях і відноситься до числа найбільш актуальних питань сучасної науки і практики.
Ось чому у працях Г.С. Альтшуллера, Л.С. Виготського, Дж. Гілфорда, П.Я. Гальперіна, К. Дункера, В.С. Івашкіна, Т.В. Кудрявцева, Ю.М Кулюткіна, Н. Майера, Я.О. Пономарьова, Н.Ф. Тализіної, О.К. Тихомирова та інших дослідників розкривається зміст деяких методів вивчення і одночасного розвитку творчого мислення в процесі розв’язування задач. Визначенням місця і ролі творчих задач у процесі навчання хімії та методів їх розв’язування займалися Н.М. Буринська, І.П. Середа, О.Г. Ярошенко, В.І. Новицька, В.В. Сорокін, І.В. Світанько, С.С. Чуранов, Ю.В. Холін, Л.О. Слета, Г.М. Розанцев, П.П. Попель, В.І. Староста та інші вчені-методисти.
Високо оцінюючи наукове і практичне значення виконаних досліджень з проблем розвитку творчих здібностей учнів у процесі розв’язування хімічних задач, ми змушені зазначити, що на сьогоднішній день ряд її аспектів не знайшов належного розв’язання. Зокрема, це питання впливу використання творчих задач з хімії в роботі з учнями загальноосвітньої школи на розвиток інтелекту.
У дидактичній літературі і методичних посібниках неповно розкриваються можливості використання ускладнених задач у навчальному процесі, задачі представлені в недостатній кількості.
Вищевикладені обставини обумовили вибір теми нашої дипломної роботи: “Розвиток творчої активності школярів у процесі розв’язування розрахункових задач з хімії”.
Об’єктом дослідження є навчальний процес з хімії в загальноосвітній школі.
Предметом дослідження вибрано хімічні задачі, як методом розвитку творчих здібностей учнів загальноосвітньої школи.
У відповідності до предмета дослідження визначена його мета: виявлення можливостей систематичного використання розрахункових задач для розвитку творчих здібностей учнів, побудова системи таких задач, а також теоретична розробка, обґрунтування педагогічної доцільності та експериментальна перевірка ефективності розробленої методичної системи, спрямованої на розвиток творчої активності школярів на уроках хімії в загальноосвітній школі.
В основу нашого дослідження покладено таку гіпотезу: використання запропонованої системи розрахункових задач з хімії активізує розвиток творчих здібностей учнів загальноосвітньої школи ІІ – ІІІ ступенів, сприяє підвищенню якості знань і оволодіння способами їх добування школярами.
Поставлена мета і сформульована гіпотеза дослідження визначають його конкретні завдання та логічну послідовність:
1. Розглянути психолого-педагогічні аспекти проблеми розвитку здібностей.
2. Провести аналіз сучасного погляду на навчальну задачу з хімії, розглянути її структуру, характерні особливості і специфіку.
3. Виявити можливості вдосконалення навчального процесу з хімії і підвищення якості його результатів за рахунок включення у процес навчання творчих задач. Розглянути їх як засіб стимулювання розвитку інтелекту учнів.
4. Розробити систему хімічних задач для розвитку творчих здібностей учнів загальноосвітньої школи.
5. У ході експериментального навчання, перевірити доступність і оцінити ефективність розробленої методичної системи, виявити її вплив на міцність, глибину й усвідомленість знань школярів, розвиток їх творчих здібностей.
Характер дипломного дослідження і його завдання зумовлюють використання таких методів дослідження:
– теоретичний аналіз проблеми на основі вивчення філософсько-методологічної, психолого-педагогічної літератури, пов’язаної з тематикою дипломної роботи;
– сукупність традиційних для дидактики методів (спостереження навчального процесу, анкетування, тестування, опитування, бесіда, вивчення шкільної документації, аналіз існуючого педагогічного досвіду), спрямованих на виявлення стану проблеми у шкільній практиці;
– проведення дослідно-експериментальної роботи в школі, що мала на меті апробацію запропонованої методичної системи і корекцію окремих її елементів;
– якісний і кількісний аналіз експериментально одержаних даних.
У ході дослідження названі методи використовувалися у взаємозв’язку і доповнювалися один одним. Саме дослідження проводилося у три етапи:
І етап. Вивчена психолого-педагогічна та науково-методична література з досліджуваної проблеми, аналіз програм і підручників.
ІІ етап. Розроблена система розрахункових задач з хімії 10 клас для розвитку творчих здібностей учнів. Також проводився пробний педагогічний експеримент, у ході якого відбувалася попередня перевірка, оцінювання і корекція розробленої методичної системи.
ІІІ етап. Був присвячений організації і проведенню остаточної експериментальної перевірки запропонованої методичної системи, обробці даних, отриманих у ході педагогічного експерименту, аналізу й узагальненню результатів дослідження, оформленню роботи.
Теоретичне значення проведеного дослідження заключається:
– у теоретичному обґрунтуванні можливостей розвитку творчих здібностей учнів засобами розв’язання системи творчих задач;
– в обґрунтування загальної системи хімічних задач, що сприяють розвитку творчих здібностей учнів загальноосвітньої школи;
– у розробці методичного підходу до організації навчання з метою оволодіння учнями знаннями і розвиток їх творчих здібностей.
Практичне значення дослідження визначається:
– побудованою загально-методичною системою хімічних задач для розвитку творчих здібностей, найбільш можливою, на нашу думку, її конкретизацією;
– розробкою методичних рекомендацій щодо розв’язання творчих задач, найбільш ефективного використання розробленої системи у навчальному процесі з хімії в загальноосвітній школі.
Розділ І. Творча активність школярів, як педагогічна проблема
1.1 Поняття творчої активності
У науці і педагогічній практиці часто використовують поняття “творчість”, “творчі здібності”, “творча активність”, “творче мислення”, “творчий розвиток”, але не дивлячись на те що в ці поняття вкладається різне значення, їх суть не завжди обговорюється. Спробуємо розкрити зміст вище зазначених понять, звернувши особливу увагу на характеристику основних компонентів досвіду, творчої активності, який формується в учнів при навчанні хімії.
У психології вважається класичним визначення “творчості” дане, ще в 50-х роках ХХ сторіччя С.Л. Рубінштейном: “Творчість – діяльність людини, споглядаюча нові матеріальні і духовні цінності, які мають суспільне значення, при цьому для учбової творчості визнається можливість суб’єктивної новизни створених учнями матеріальних і духовних цінностей і значимість для одного учня чи групи. Це визначення не відповідає суті самого процесу створення нового і невідомого. Тому довгий час існували дві протилежні точки зору. У відповідності з першою уміння творити розглядалося як дар природи чи Всевишнього, виник навіть термін “творча обдарованість”. У відповідності з другою точкою зору допускалась творчість за інструкцією.
У навчанні хімії довгий час переважав так званий результативний підхід до творчості: творчість часто пов’язували з конструюванням приладів і моделей, а також з одержанням нових для учнів речовин. У зв’язку з цим поширився термін “творчі здібності”. Ця характеристика здібностей учнів вказувала на можливість одержання ними якогось нового результату, тобто пов’язана з творчою результативністю.
Поняття “творчий розвиток учнів” ввійшло внаслідок введення в учбовий процес розвиваючого навчання. Тільки тоді з’явилась необхідність уточнення психологічних функцій особистості, які розвиваються при навчанні. У педагогічній практиці стали використовувати термін “розумовий чи інтелектуальний розвиток учнів”, який означав розвиток уваги, пам’яті, логічного мислення. Стали використовувати словосполучення “творчий розвиток”, яке розуміли як розвиток творчої результативності або творчого мислення.
На основі результатів психологічних досліджень у суть творчого процесу було введено поняття “досвід творчої діяльності”. Воно висвітлює змістовну, процесуальні, особистісну і комунікативну специфіку творчості.
Досвід творчої діяльності учнів, який формується при вивченні хімії, можна розглядати як складову частину досвіду учбової наукової творчості, який в свою чергу входить в загально-соціальний досвід творчої діяльності.
Основні компоненти досвіду учбової хімічної творчості можна поділити на характерні для всіх видів учбової творчості (можливість творчо мислити і здатність до співпраці) і специфічні, які пов’язані зі змістом предмету “хімія” (мотивація творчості, досвід використання різноманітних знань, розв’язанні учнями учбових творчих задач (проблеми), досвід технічної творчості (якщо він необхідний) (схема.1).
Розглянемо основні компоненти досвіду хімічної творчості учнів. Бажання учнів розв’язувати творчі задачі залежить від сформованості мотивів. А без великого бажання неможливо запропонувати оригінальний розв’язок.
Мотивація творчості може бути обумовлена інтересом до хімії, осмислення необхідності її вивчення для підготовки до майбутньої професії; на неї має вплив думок однокласників, батьків, учителів. Важливий мотив самоствердження. В учнів, які вивчали хімію поглиблено, цей мотив досить поширений. Вони також часто розв’язують творчі задачі, щоб перевірити правильність вибору шкільного предмету для поглибленого вивчення. Мотивація творчості суттєво збільшує задоволення від розв’язання творчих задач.
Схема 1 Основні компоненти досвіду творчої діяльності, яка формується при навчанні хімії
| здібність творчо мислити | здібність до творчого співробітництва | ||||
|
мотивація творчості |
|
творча продуктивність (результативність) |
|||
| розв’язання творчих задач | досвід технічної творчості | ||||
Найважливіша складова досвіду творчої активності – здатність творчо мислити. Творче мислення характеризується, по-перше, здібністю до перебудови стереотипів, які в значній мірі залежать від глибини знань учня. Але парадокс заключається в тому, що чим краще учень знає предмет, тим більше у нього формується стереотипів, про зміст яких він навіть не здогадується. Як вважали американські психологи Д. Креч, Р. Крачфілд, Н. Лівсон, “знання можуть обмежувати нас, привчати до використання традиційних стереотипів... Чим менше знань людина отримала у минулому, тим легше їй знайти оригінальну ідею розв’язку”. Тому дуже важливо учнів навчити осмислювати і переосмислювати розуміння предмету.
У якості другої специфічної риси творчого мислення можна виділити здібність до пошуку розв’язку в умовах невизначеності. Формування такої здібності особливо актуальне для учнів, які досягли успіхів у навчанні, оскільки не затрудняючись при навчанні і розв’язуючи, як правило, типові задачі, що відносяться до конкретної теми уроку, вони звикають до того, що в умові відразу можна знайти спосіб розв’язання. Зіткнувшись з ситуацією, коли не зрозуміло ні шлях розв’язку, ні потрібна глибина розв’язку, ні область знань, які необхідно використати, вони не рідко бояться, почувають себе не впевнено і не можуть здійснити пошук розв’язку задачі.
Характерною рисою творчого мислення можна назвати також здібність до переборювання творчих складностей. Більшість учнів з розвиненою пам’яттю і логічним мисленням звикли розв’язувати складні (але типові) задачі, не затрачаючи великих зусиль. Деякі вчителі вбачають у цьому вплив їх обдарованості. Пошук оригінального розв’язку завжди потребує більших зусиль від учня. якщо задача розв’язана легко, то неможливо визнати її творчою, оскільки учень мав необхідні дані для розв’язання цієї задачі. Творчий розв’язок з’являється після серії невдалих спроб в умовах глибокого внутрішньо особистісного конфлікту, коли учень або відмовляється від розв’язання (тоді йому потрібна допомога вчителя) або у його голові раптово з’являється продуктивна ідея.
На ефективність творчого мислення впливають цілий ряд факторів. Один з них – інтелект (гарна пам’ять, стабільна увага, логічне мислення). На основі експериментальних досліджень можна стверджувати, що у дітей до 11 – 12 років інтелект і творче мислення розвиваються взаємопов’язано.
У підлітків старше 12 років інтелектуальний розвиток закінчується, розвиток творчого мислення відбувається незалежно від інтелекту. Відомо, що людина з високим творчим потенціалом необов’язково повинна мати високий інтелект. Наприклад, багато видатних вчених погано навчалися в школі, вузі. Також відомо, що люди з низьким рівнем інтелекту не можуть мати високий творчий потенціал, бо їм краще використовувати відомий шлях розв’язку, навіть тоді, коли необхідно розробити новий спосіб розв’язку задачі.
Здатність до співпраці – важлива для творчості якість особистості. Вміння чітко сформулювати свою думку, аргументовано критикувати як свої, так і чужі ідеї впливає на вибір розв’язку. При формуванні суті своєї ідеї учень краще її розуміє. Крім цього, кожний бачить свій зміст в умові задачі, у своїх ідеях і ідеях партнера. Розгляд цих змістів і їх оцінка складе більш повне бачення проблеми і шляхи її розв’язку.
Практика показує, що далеко не всі учні можуть творчо співпрацювати. Не рідко в учнів, які мають високий рівень інтелекту, завищений рівень самооцінки. Вони втрачають здібність слухати інших, особливо тих, хто не має великих успіхів у навчанні. Практично відсутня здібність до співпраці також у багатьох відстаючих учнів, які не можуть висловлювати свої думки, боячись показатися некомпетентними. Таким чином, здібність учнів до творчої співпраці, у більшості випадків, обумовлена формуванням здорових міжособистісних відносин у класі.
Наступним складовим досвіду творчої активності являється – досвід використання для розв’язання проблеми різноманітних розділів хімії. Без гнучких і усвідомлених знань творчість неможлива. У той же час творчість можна розглядати як засіб збільшення гнучкості і осмислення знань учнів. Отримати, так зване, замкнуте логічне коло. Вихід з нього – поступове зближення учнів до творчості, тобто вибір задач, які відповідають їхньому рівню знань. Творчі задачі можна також розглядати як засіб підвищення здібностей учнів до рефлексії, без якої неможливо досягнути високої якості знань.
Як компонент досвіду учбової наукової творчості являються всі розв’язані учнем учбові творчі задачі. Відповідно, чим їх більше, тим багатший досвід учбової наукової творчості.
По мірі накопичення кількості розв’язаних творчих задач учень оволодіває загальними прийомами пошуку оригінального розв’язку, які називають евристичними: бачення нової функції об’єкту, осмислення його структури, пошук альтернативних шляхів розв’язку, комбінування раніше відомих способів розв’язку, розширення області пошуку розв’язку, аналіз і порівняння різноманітних способів розв’язку.
Досвід технічної творчості часто визначає успіх розв’язання експериментальних задач з хімії, які потребують проектування технічних устроїв, а також вміння працювати з матеріалом. Зміст технічної творчості по кожному шкільному предмету має свою специфіку. Так, специфіка досвіду технічної творчості по хімії виявляється в проектуванні і виявленні конструкційних особливостей приладів для здійснення хімічної реакції в умовах шкільної лабораторії.
Таким чином, мотивація творчості з хімії, досвід використання різноманітних хімічних знань для розв’язання творчих задач, досвід технічної творчості з хімії визначають індивідуальний соціальний досвід як досвід учбової хімічної творчості.
Важлива характеристика творчості – продуктивність. Під творчою продуктивністю розуміють можливість запропонувати різноманітні способи розв’язання творчих задач і знайти оригінальний розв’язок.
1.2 Шляхи формування творчої активності школярів
Однією з проблем освіти, зокрема, шкільної, є творчий розвиток особистості, підвищення її творчого потенціалу.
Більшість вчених розглядають здібності з позицій діяльності (Б. Теклов, С. Рубінштейн, О. Ковальов, В. Мисинцев, В. Моллено, М. Бургін, С. Гончаренко): вони вважають, що здібності – це синтез властивостей та якостей особистості, які забезпечують успішність виконання того чи іншого виду діяльності.
Здібності поділяються на загальні, притаманні кожній людині, та спеціальні, які характерні не всім і передбачають певний вплив якісних сторін психологічних процесів особистості. Вони лежать в основі спеціальних здібностей і є однією з умов їх розвитку.
Творчі здібності відносяться до загальних, оскільки виявляються у будь-якій сфері життєдіяльності людини на тому чи іншому рівні. Вони мають складну структуру. За даними психолого-педагогічної науки, можна виділити такі основні складові компоненти творчих здібностей: мотиваційні, інтелектуально-логічні, інтелектуально-евристичні, комунікативні, здібності до самоорганізації.
Вони виявляються: мотиваційні – у допитливості, творчому інтересі, почутті захопленості, емоційному сплеску, прагненні до творчих досягнень, до отримання високої оцінки; інтелектуально-логічні – в здатності аналізувати, порівнювати, виділяти головне, доводити свою думку, пояснювати; інтелектуально-евристичні – у здатності до висунення ідеї розв’язання проблеми, до фантазії, самостійного перенесення знань та умінь у нову ситуацію, до оціночних суджень; здібності до самоорганізації – у здатності планувати і раціонально використовувати час, до самоконтролю, до вольових зусиль, старанності; комунікативні – у здатності до співробітництва, уникнення конфліктів та успішного розв’язання їх.
Усі компоненти творчих здібностей тісно взаємопов’язані між собою і в процесі творчої діяльності відіграють певну роль.
Постановивши питання про розвиток творчих здібностей, ми неминуче переводимо дослідження в площину форм і методів навчання. Творчості не можна навчити, регламентуючи способи дії.
Визначення методів формування в учнів творчої діяльності включає вивчення більш широкого кола питань і, перш за все, уточнення самого поняття “метод навчання”. Ми розглядаємо його, виходячи з підходів, розроблених у вітчизняній педагогічній науці А.М. Алексюком, В.І. Бондарем, В.О. Онищуком.
Метод навчання – це багато якісне, різнобічне явище, яке має внутрішню структуру та зовнішню форму виявлення; розв’язує певну дидактичну мету, являє собою форму обміну науковою інформацією між вчителем і учнями, визначає вид і рівень пізнавальної діяльності; це спосіб стимулювання та мотивації учіння, сукупність взаємопов’язаних прийомів і операцій у діяльності вчителя і учнів, спрямованої на досягнення поставлених цілей і завдань.
Як показали теоретичні та експериментальні дослідження, розвиток творчості вимагає комплексних заходів, удосконалення навчання на базі таких принципів:
– звільнення особи від тотальної всеохоплюючої регламентації мислення, оцінювання фактів і явищ, висловлювання здогадок, поведінки в процесі навчання;
– здійснення навчанні на високому рівні складності, адже, за дослідженнями психологів, лише таке навчання спонукає до творчості;
– систематичне створення ситуацій вибору для учнів, можливості здійснювати свій вибір;
– зростання питомої ваги діалогічної форми навчання, як особливої взаємодій повноцінних розумінь (М. Бахтін), що зумовлює поєднання зовнішнього і внутрішнього діалогів.
Реалізація цих принципів передбачає формування особливої особистісно-розвиваючої моделі навчального процесу, передусім – удосконалювання змісту освіти, зокрема, застосування творчих завдань.
Навчання набуває творчого характеру, якщо воно організовується з урахуванням рис творчої діяльності і самостійного переносу знань і вмінь у нову ситуацію; виявлення нової проблеми у знайомих умовах, нової функції знайомого об’єкту; вміння бачити альтернативу рішенню; вміння комбінувати відомі способи розв’язування задач по-новому; створювати оригінальні способи поряд з відомими іншими.
Набуття школярами досвіду творчої діяльності забезпечується, коли вони залучаються у посильний творчий процес, якщо поступово ускладнюються, цьому сприяє застосування методів навчання, склад яких визначається прийомами та операціями, які виконують вчитель і учні, рівнем пізнавальної діяльності, рівнем самостійності школяра – від усвідомлення прийомів, які демонструє вчитель до самостійного використання. Методи навчання, які на нашу думу є одними з найвпливовіших у процесі навчання хімії наведені в таблиці 1.
Виділення такого методу, як пояснення, дає можливість розпочати роботу над формуванням в учнів творчих умінь на ранніх стадіях навчання, подолати невідповідність ступеня складності програмованого матеріалу навчальними можливостями дітей, який часто виявляється завищеним під час застосування відомих методів навчання.
Конструктивна бесіда поєднує можливості етапів відтворення знань, часткового пошуку, розв’язання проблем і цим визначає плавний перехід школярів до самостійної творчої діяльності.
Таблиця 1 Методи навчання
| Метод навчання | Характер діяльності | Прийоми та операції | |
| вчителя | учня | ||
| Пояснення | Інформаційно-спонукальний | Творче відтворення |
Вчитель повідомляє нові знання, доводить твердження, формулює питання, проблеми, показує шляхи їх розв’язання. Учні спостерігають факти, явища, виділяють головне, відповідають на запитання. |
| Конструктивна бесіда | Пояснювально-спонукальний | Частково-пошуковий |
Вчитель ставить запитання репродуктивного, частково-пошукового характеру, кожне наступне випливає з попереднього – в результаті чого розв’язуються поставлені завдання. Школярі аналізують, порівнюють, дають визначення, змінюють, роблять висновки. |
| Творчі завдання і вправи | Спонукальний | Творче відтворення, частково-пошуковий, пошуковий | Вчитель пропонує завдання, учні використовують, розв’язуючи їх прийоми, які дозволяють більш глибоко осмислювати навчальний матеріал; оперують всіма відомими знаннями, способами, застосовують їх у змінених умовах, шукають нових шляхів розв’язання поставленої мети, вдосконалюють свої знання, використовують їх у нових ситуаціях, створюють оригінальні творчі підходи. |
Основним є метод творчих знань і вправ, які виступають активною формою і засобом засвоєння досвіду творчої діяльності в умовах активної роботи мислення, напруги пам’яті, активізації вже накопичених знань і вмінь.
1.3 Розвиток творчої активності школярів у процесі вивчення хімії
Утвердження демократичного стилю відносин між учителями й учнями, взаємодовіра і взаємоповага між ними – ось провідні стрижневі ідеї нової організації навчально-виховного процесу. Визнання учня рівним собі партнером, коли вчитель вбачає в кожній дитині передусім особистість працює з ним на рівних засадах – це не стільки нова педагогіка і навіть не метод, скільки особистісне ставлення вчителя до учнів, що створює сприятливі умови для розкриття й розвитку обдарувань і здібностей школярів. Застосування найбільш продуктивних нетрадиційних і водночас гуманних форм і методів роботи, найбільша увага до розвитку особистості, надання всебічної допомоги й підтримки в корисних і цінних починаннях, підтримка в неї прагнення до розумової праці – важливе завдання вчителя сучасної національної школи.
Успішне виконання цих завдань передбачає (за В.Вернадським):
• проведення детального аналізу явища, що його вивчають;
• глибоке вивчення суті явища: виділення його найхарактерніших ознак, властивостей, особливостей в результаті описування й аналізу;
• простеження історії ідей явища, що його вивчають, збирання якомога більше інформації, відомостей про нього різних, головно наукових джерел;
• встановлення загальних закономірностей і перенесення на пізнання інших споріднених або близьких явищ і процесів;
• виявлення нових, нерозв’язаних проблем під час проведеної роботи.
У процесі оволодіння теоретичним матеріалом учням потрібно самостійно розпізнати й описати явище, що його вивчають, розпізнати, описати і з’ясувати його зв’язки і відносні (довести закономірний характер цих зв’язків і відносин); на основі цього розпізнати і сформувати правила перетворення даного явища; встановити нові протиріччя, нерозв’язані проблеми, виявлені у процесі оволодіння навчальним матеріалом.
Успішне розв’язання цих завдань залежить від того, якою мірою учні володіють методами наукового пізнання: загальними специфічними, чуттєвими й раціональними, експериментальними й логічними. У зміст освіти, очевидно, повинні входити відповідні обов’язкові елементи методів пізнання, з якими вчитель ознайомлює учнів. Такими елементами зокрема є: специфічний понятійний апарат; способи розпізнавання специфічних ознак, зв’язків і відносин; навички орієнтації в багатогранності цих ознак, зв’язків і відносин; специфічні способи і системи доведень; специфічні способи формулювання правил, висновків і узагальнень. У процесі вивчення будь-якого навчального предмета учень зможе самостійно описати те чи інше явище через визначення його сутності тільки тоді, коли він володітиме відповідними поняттями.
Розв’язуючи задачі на розвиток мислення, треба пам’ятати: якою б мірою самостійності не здійснювалася пізнавальна діяльність учня, який би характер вона не мала (репродуктивний чи прогностичний), вона завжди була й буде похідною, залежною від діяльності вчителя. Щоб успішно управляти пізнавальною діяльністю, динамікою складових її елементів (зміст, способи, процедура, мотиви тощо), вчителеві потрібно чітко уявляти головні завдання прогнозу: що прогнозувати і як прогнозувати? Як вказує проф. Б.Коротяєв, загальне завдання прогнозу зводиться до передбачення тих умов, засобів, форм змісту діяльності, які є оптимальними для розвитку й удосконалення особистості учня загалом, зокрема світогляду й ідейних переконань, творчого мислення, пізнавальних інтересів, духовних потреб і здібностей, високих гуманних якостей.
Часткові завдання – це, по-перше, прогнозування пізнавальної діяльності за змістом навчального матеріалу або передбачення всього того, що створює сприятливі умови для економного, глибокого и міцного засвоєння тієї чи іншої системи наукових знань; по-друге, прогнозування пізнавальної діяльності за її способами проведення, або передбачення руху учнів від елементарних рівнів і форм діяльності до складніших і вищих. У процесі розв’язання першого часткового завдання істотним є відбір і створення таких логічних конструкцій знань які могли б бути знаряддям або способом пізнавальної діяльності і забезпечили б перехід від репродуктивної діяльності прогностичної, від емпіричного рівня до теоретичного, від абстрактного до конкретного. Під час розв’язання другого часткового завдання істотним є створення й відбір таких способів діяльності, які учні можуть використати для засвоєння теоретичного матеріалу на творчому рівні.
Загальний педагогічний прогноз розвитку пізнавальної діяльності учнів повинен точно розраховувати її перехід від репродуктивного рівня до репродуктивно-творчого, а від репродуктивно-творчого до творчого. Такий перехід виявиться цілком можливим за умови, коли учні матимуть відповідні обсяг знань, умінь і навичок, зокрема репродуктивні і творчі, а також умітимуть самостійно одержувати їх.
Підготовленість учнів повинна виражатися в уміннях розпізнавати, глибоко розуміти й осмислювати інформацію; систематизувати, відбирати найістотніше, головне і запам’ятовувати його; відтворювати й застосовувати одержані знання і практиці; переносити ці знання, провідні ідеї на пізнання інших явищ і процесів. Важливо при цьому відзначити, що процес навчання в цих умовах будують так, щоб перцептивні (зорові, слухові, тактильні та ін.) і словесно-логічні (порівняння, аналіз, синтез, абстрагування) операції спонукали учнів до активної пізнавальної діяльності, щоб процесі цієї діяльності народжені в учнів нові ідеї, думки, судження проривалися з підсвідомості і ставали результатами їхньої самостійної пошукової роботи. Для цього на уроці створюють невимушену, але діяльнісну обстановку, атмосферу творчої взаємодії вчителя й учнів. Наприклад, подаючи теоретичний матеріал, учитель виконує не тільки функції викладача, а дослідника, що “відкриває” істину, збуджує в учнів бажання дійти сміливого рішення, зайняти власну позицію, створює таку атмосферу, коли пізнані наукові закономірності спрацьовують.
Розвитку творчості сприяє реалізація принципу радості напруження. Учитель не передає учням знання в “готовому вигляді”, не пропонує стандартних розв’язків, не підкреслює окремих авторитетних поглядів, а створює атмосферу бачення конфліктних ситуацій, логічних суперечностей, заохочує оригінальні судження. Учитель будує навчальний процес так, щоб учні активно заглиблювалися в пошук, втручалися в розгляд проблеми, усвідомлено приймали багатоваріантні розв’язки і на основі порівняння й зіставлення обирали оптимальні. Усе цінне, що закладено в альтернативних пропозиціях окремих учнів, знаходить застосування в доопрацюванні основного варіанта, прийнятого за основу. В кінцевому підсумку з’являється варіант розв’язання, що є продуктом колективної творчості. У процесі такого навчання вчитель озброює учнів механізмом процесу мислення, навчає послідовно виконувати операції мислення, разом з ними намічає основні етапи, стадії пізнавального пошуку, активізує діяльність думки й почуттів. Учитель допомагає учням не підказками всього ходу розв’язку, а вказує лише орієнтири, спрямовує хід думки так, щоб основну частину пошукового процесу вони виконали самі. В цьому разі вчитель навчає способів розуміння суті поставленого завдання і, спираючись на це, розгортає на уроці такі діалоги, під час яких формується уже колективне творче мислення. Звичайно, атмосферу колективного творчого пошуку на уроці може створити вчитель, який вільно володіє психолого-педагогічним механізмом пізнання, наділений дидактичним чуттям, глибиною й багатством почуттів і переживань. Колективна творчість стимулюється за рефлексивного управлінського впливу, у процесі якого на уроці періодично змінюються ритм і темп роботи, зміст заняття, стиль взаємовідносин, критерії оцінки.
Межа між репродуктивною й творчою діяльністю вчителя і учнів на уроці завжди умовна й досить рухлива. Елементи тієї й іншої знаходять своє відображення певною мірою в різних зонах, етапах навчального процесу і в різних видах пізнавальної діяльності. Кількість елементів творчості в кожній ланці навчального процесу також умовна: їх може бути мало або багато. Все залежить від виду навчально-пізнавальної діяльності, її мети і завдань.
Розв’язування задач, виконання вправ, лабораторно-практичних робіт – у цих видах діяльності досить чітко виявляється межа між репродукуванням і творчістю. Перебіг процесу пізнання тут відбувається відповідно до закономірностей оптимального поєднання репродукування і прогнозування.
Отже, при виділенні комплексів знань, умінь і навичок важливо керуватися такими психолого-педагогічними умовами, які сприяють формуванню творчого мислення учнів:
• учні мають засвоювати не окремі розрізнені знання, а їх систему, яка відображає, наскільки це можливо, структуру сучасних наукових знань;
• засвоєні учнями системи повинні перебувати в постійному русі, у співвідношенні з іншими системами, перебудовуватися відповідно до завдань пізнання й конкретних умов застосування знань. При цьому здійснюється не простий перехід від однієї системи до другої, а відбувається широке узагальнення утворених систем знань, створення нових систем, а також широке перенесення одержаних знань у різні життєві ситуації;
• учні повинні засвоїти не тільки знання, а й способи оперування ними, методи, що допомагають здобувати їх.
Кожний вчитель повинен у своїй свідомості чітко уявляти, які комплекси знань, умінь і навичок він зможе і повинен сформувати у навчальному процесі. Відтак на основі міжпредметних зв’язків розробляти загальні комплекси з чітким диференціюванням: основні особистісні якості учня повинні формувати всі вчителі, а конкретні вміння й навички виробляють учителі трьох-чотирьох дисциплін на матеріалі, який для цього найсприйнятливіший. Так здійснюється інтеграція знань, умінь і навичок у процесі навчання.
Ідея формування міжпредметних комплексів знань, умінь і навичок, на наш погляд, заслуговує уваги. Тому важливо, щоб процес озброєння ними не переривався з переходом від однієї дисципліни до іншої. Наукові, ідейні концепції попередньої дисципліни повинні розвиватися під час вивчення наступних дисциплін. На жаль, ще й тепер у деяких школах спостерігається традиція, коли між окремими, навіть спорідненими навчальними предметами зводять досить високі “бар’єри”. Виникає потреба у створенні наскрізних, збірних, інтегрованих програм навчання, в яких проблему міжпредметних зв’язків і наступності слід визначити точно і методично продумано. При цьому слід наголосити, що така система вивчення навчальних дисциплін у школі сприятиме підвищенню якості не тільки прикладних знань, умінь і навичок, а й і світоглядних методологічних позицій випускників загальноосвітньої школи.
Розділ 2. Задачі з хімії як засіб формування творчої активності школярів
2.1 Розрахункові задачі в процесі навчання хімії
Об’єм знань з хімії визначається державною програмою і конкретизується відповідними розділами підручника. У програмі відмічено, що знання з хімії повинні бути наукові, свідомі, конкретні.
Розв’язання задач в хімічній освіті займає важливе місце, бо являється одним із прийомів навчання, через яке забезпечується більш глибоке і повне засвоєння навчального матеріалу по хімії і виробляє вміння самостійного використання набутих знань.
У методичні літературі немає одностайності в визначенні поняття “задача”. М.В. Метельський стверджує, що “задача” – поняття, яке не визначається і в широкому розумінні являється тим, що потребує розв’язку. Задачу можна визначити, як об’єкт розумової діяльності, який потребує виконання якогось практичного перетворення або відповіді на теоретичне питання шляхом пошуку умов, які надають можливості розкрити зв’язки між відомими і невідомими її елементами.
Проталов П.М. хімічну задачу розглядає як систему, стан якої характеризується конкретними параметрами. Хімічною задачею він називає невелику проблему, яка розв’язується за допомогою логічних висновків, математичних дій, хімічного експерименту на основі понять, законів і методів хімії.
Кожна хімічна задача складається з сукупності даних – умови задачі і запитання. Крім того, є конкретна система функціональних залежностей, які пов’язують шукане з даними і дані між собою. Ці залежності і дають можливість пошуку розв’язку задачі.
За А.В. Шаповаловим, процес розв’язку хімічної задачі передбачає вибір стратегії, загальних і спеціальних правил, які можна використовувати при розв’язуванні задачі. Під стратегією розуміють вичерпний план дій, які формуються під час розв’язку задачі. Виділяють три етапи:
– вивчення і аналіз умов задачі;
– співставлення плану розв’язку;
– її розв’язок.
Загальні правила направлені на визначення основних підходів до розв’язання майже всіх хімічних задач. Спеціальні правила використовуються при розв’язку вузької групи хімічних задач.
Останнім часом в дослідженнях по методиці викладання хімії усе частіше використовується системно-структурний підхід. Він базується на тому, що специфіка навчального процесу (системи) не вичерпується особливостями її складових частин. Вона залежить ще й від характеру зв’язків і співвідношення між окремими елементами навчального процесу. Основними елементами цієї системи ї хімічні поняття і хімічне мислення. Змісту і структурі навчального матеріалу з хімії відповідає конкретна система задач, яка будується на основі зв’язків між елементами системи знань.
Системність в розв’язку задач передбачає, що кожна наступна задача повинна мати конкретну новизну, бути посильно важкою, потребувати відповідних прийомів праці над нею.
При системному підході до курсу хімії теоретичні знанні і вміння розв’язувати задачі складають єдину систему хімічних знань, яка забезпечує поглиблене і зрозуміле засвоєння знань учнями одночасно з оволодінням структурою самих задач.
У процесі розв’язування задач відбувається уточнення і закріплення хімічних понять про речовини і процеси. Задачі, які включають визначені ситуації, стають стимулом самостійної роботи учнів над навчальним матеріалом. Стає зрозумілою загальноприйнята в методиці думка, що мірою засвоєння матеріалу потрібно вважати не тільки і навіть не скільки переказ тексту підручника, скільки умінню використовувати одержані знання при розв’язуванні різноманітних задач.
Тісна взаємодія знань і умінь являється основою формування різноманітних прийомів мислення: доведення, судження і умовиводів. У свою чергу знання, які використовують при розв’язуванні задач можна розділити на два типи: знання, які учень набуває при розборі тексту задачі і знання, без використання яких процес розв’язку неможливий. Сюди належать різноманітні визначення, знання основних теорій і законів, різні хімічні поняття, фізичні і хімічні властивості речовин, формули сполук, рівняння хімічних реакцій і т.д. психологи і дидакти розглядають розв’язування задач як модель комплексу розумових дій. Мислення при цьому виступає як проблема “складання” операцій в конкретну систему знань з її послідуючим узагальненням.
Значна роль задач в організації пошукових ситуацій, які необхідні при проблемному навчанні, а також в процесі перевірки знань учнів, при закріпленні отриманого на уроці матеріалу.
Для виявлення функцій, ролі і місця хімічних задач у системі методів навчання, рівня засвоєння учнями навчального матеріалу, розвитку пізнавальних здібностей і творчих можливостей учнів задачі класифікують за різноманітними ознаками. У підручниках з методики хімії (Н.М. Буринська, Г.М. Чернобельська, О.С. Зайцев), спеціальних методичних посібниках по розв’язуванню задач і в інших виданнях приводяться різноманітні варіанти класифікації задач. Загальновизнаною є класифікація на дві групи:
– розрахункові;
– якісні.
При розв’язуванні якісних задач визначаються якісні співвідношення між хімічними поняттями. При розв’язуванні кількісних задач – кількісну залежність між даними і шуканим. Щоб отримати відповідь на кількісну задачу, потрібно провести конкретні математичні операції. Початковим етапом розв’язку розрахункових задач є якісний аналіз, який доповнюється кількісним.
Д.П. Єригін і Є.А. Шишкін умовно поділяють хімічні розрахункові задачі на три групи:
1. Задачі, які розв’язуються з використанням хімічної формули речовини або на виведення формули;
2. Задачі, для розв’язання яких використовують рівняння хімічних реакцій;
3. Задачі, які пов’язані з розчинами речовин.
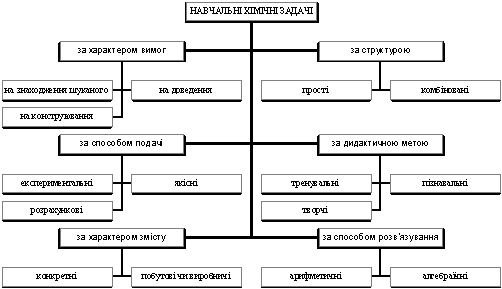
У методичній літературі і в програмах шкільного курсу хімії задачі в основному класифікуються за способами розв’язування. Пропонуємо таку класифікацію для визначення місця задач у навчальному процесі (схема 2).
Схема 2

Кожна з груп включає різноманітні типи задач (схема 3).
Різноманітність типів задач, які отримані авторами – Шаповаленко С.Г., Шевальовою А.С., Плентером Ю.В. і Полосіним В.С. – Єригін Д.П і Шишкін Є.А. оформили у вигляді таблиці (таблиця 2).
Коли навчаєш хімії, на практиці, часто бувають випадки, коли кількісні задачі розв’язуються без достатнього якісного аналізу, підстановкою даних в пропорцію або формулу, які підбираються за допомогою формальних властивостей. При цьому, на перший план виступають математичні операції, які перекривають хімічну суть задачі.
Схема 3
За психологічними дослідженнями розв’язування хімічних задач досить часто ускладнюється великим розрахунковим апаратом, який створює видимість розумових зусиль, а насправді, штучно утримує використання активних форм розумової діяльності учнів. Захоплення математичними розрахунками під час розв’язку хімічних задач призводить до того, що хімічна суть переходить на другий план. Внаслідок цього друга сигнальна система, яка функціонує під час визначення словесними і математичними формулами не знаходить достатньої опори у першій сигнальній системі, а отже , – і в фактах дійсності.
Тільки це і дало можливість М.В. Зуєвій зробити висновки про незначну методичну цінність розрахункових хімічних задач.
Таблиця 2 Класифікація задач за типами, які запропоновані різними методистами
| Шаповаленко С.Г. | Шевальова А.С. | Плетнер Ю.В, Полосін В.С. |
| 1. Ознайомлення з хімічною мірою маси, “моль”. | 1. Розрахунки за формулами. | 1. Розрахунки за формулами. |
| 2. Розрахунки за хімічною формулою співвідношень мас елементів. | 2. Обчислення за хімічною формулою, пов’язані з поняттям “моль” і законом Авогадро. | 2. Розрахунки маси розчинника і розчиненої речовини для приготування розчину заданої концентрації. |
| 3. Розрахунки за формулою маси елемента по масі речовини. | 3. Розрахунки за хімічними рівняннями. | 3. Знаходження об’ємних співвідношень реагуючих газів. Обчислення відносної густини газів. |
| 4. Розрахунки відносної молекулярної маси за відносною густиною і об’ємом газів за масою речовин. | 4. Виведення формул речовин. | 4. Знаходження відносної молекулярної маси за масою даного об’єму газу і виведенням молекулярної формули речовини. |
| 5. Розрахунки за розчинами. | 5. Періодичний закон і будова атома. | 5. Знаходження практичного виходу речовин. |
| 6. Розрахунки за хімічними рівняннями. | 6. Розчини. | 6. Знаходження кількості речовини, яке буде в продуктах реакції, якщо одна з речовин взята в надлишку. |
| 7. Співставлення найпростіших і молекулярних формул. | 7. Комбіновані задачі з політехнічним змістом. | 7. Знаходження кількості речовини, яке може бути одержаним із вихідної речовини, що містить певний відсоток домішок. |
| 8. Знаходження кількості газоподібних продуктів реакції в об’ємних одиницях виміру. |
При розв’язуванні кількісних задач необхідний глибокий і всебічний якісний аналіз, знаходження хімічної суті задачі. У такому випадку розв’язування кількісних задач буде сприяти глибокому і усвідомленому засвоєнню учнями законів, теорій і понять хімії, формуванню міцних знань, вихованню діалектико-матеріалістичного світогляду учнів.
Виходячи з числа залежностей, які включені в задачу, кількісні хімічні задачі діляться на прості і комбіновані.
Прості задачі потребують нескладного аналізу і незначних математичних розрахунків, які наскільки спрощені, що їх можна розв’язувати усно. Мета розв’язування простих задач – допомогти учням запам’ятовувати формули , конкретизувати одержані знання, закріпити знання від окремих хімічних явищ і фактів.
За дидактичною метою майже всі прості задачі відносяться до тривіальних.
Якщо в задачах використовується кілька закономірностей із різних розділів хімії, а іноді і фізики, то їх називають комбінованими. Такі задачі іноді містять матеріал, який впливає на створення проблемної ситуації. Комбіновані задачі можна використовувати для поглиблення знань учнями, розширення їх бачення про хімічні явища, а також для тематичної перевірки знань учнів. За дидактичною метою майже всі комбіновані задачі відносяться до пізнавальних або розвиваючих.
Вміння розв’язувати прості задачі – необхідні умови для розв’язування складних задач. При наявності такого вміння проблема в тому, щоб знайти сукупність простих задач розв’язання яких призведе до шуканої відповіді. Пошук такої сукупності може відбуватися двома шляхами: синтетичним і аналітичним.
Аналіз задач активізує мислення учнів. Оволодіння аналітико-синтетичними операціями – одна із складних, але в той же час і важливих цілей навчання школярів розв’язуванню хімічних задач. Зрозуміти задачу – значить так чи інакше передбачити її розв’язування, розібратися у тому, що дано і що потрібно знайти. Аналіз задачі важливий для всього процесу розв’язку, так як дає можливість “намітити гіпотезу, як ідею розв’язування задачі (Гаврусейко І.П.)”.
Як показує практика, складності в розв’язуванні задач, обумовлені невмінням аналізувати запропоновану задачу. При систематичному методі аналізу роздуми будуються від змісту задачі до питання, тобто від відомих величин до невідомих, а при аналітичному – від шуканої величини до відомої.

Учитель повинен пояснити учням два способи мислення, щоб можна було використовувати той шлях, який найбільше відповідає їх мисленню. При використанні синтетичного шляху встановлюється, що дано в умові задачі, які величини це дозволяють визначити, що потрібно знайти в кінцевому результаті, чи досить інформації для знаходження шуканої величини.
Якщо ж учню важко встановити зв’язок між відомими і невідомими величинами, то дослідження задачі краще вести аналітичним шляхом, де звертається увага на невідому величину, як її визначити, тобто яке теоретичне положення або закон необхідно для цього використати. Виявивши питання, виділяють прямі і непрямі зв’язки шуканої величини з відомими даними умови задачі.
На практиці при розв’язуванні хімічних задач практично неможливо чітко розділити методи аналізу і синтезу. Вони поєднуються і доповнюються один одним. Аналітичний метод впливає на розвиток продуктивного, логічного і функціонального мислення учнів. Внаслідок систематичного використання аналітичного методу в учнів швидше, ніж при використанні синтетичного, формується вміння самостійно розв’язувати нові для них задачі.
Шляхи розв’язування задач різноманітні. Розв’язування хімічних задач складається з різноманітних і багатьох операцій, які повинні бути конкретних чином взаємопов’язані між собою, використовуватися у певній послідовності, мати певну логіку. Важливим фактором при навчанні розв’язування задач є необхідність обробки деякої послідовності дій. Вона може бути такою (схема 4):
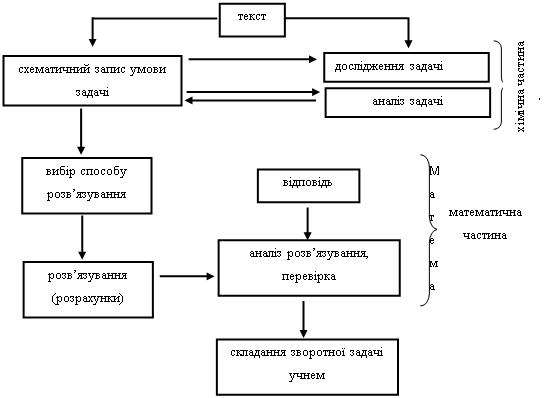 Схема 4
Схема 4
У практиці роботи учителів хімії зустрічаються два способи розв’язування задач. Традиційний спосіб здійснюється за такою схемою: пояснення методів розв’язування – колективне розв’язування – самостійне розв’язування контрольних задач. Іноді колективне розв’язування заміняють самостійною роботою вдома. У цьому випадку ефективність навчання значно знижується.
Другий спосіб відбувається за такою схемою: пояснення шляхів розв’язування задач – колективне розв’язування задач – напівсамостійна робота учнів – самостійна робота – контрольна робота. Методична і навчаюча ефективність цього методу досить висока. На жаль, на практиці роботи вчителів хімії цей метод використовується дуже рідко (С.Г. Шаповаленко).
У методичних посібниках при навчанні вмінню розв’язувати розрахункові задачі, пропонують активно використовувати алгоритми, які допомагають вибирати найбільш раціональний спосіб розв’язування задач, а також прискорюють темпи навчання. При цьому суттєво зменшуються не продуктивні затрати часу на уроці. Цей прийом активізує діяльність учнів, розвиває у них логічне і творче мислення, сприяє виробленню необхідних при розв’язуванні розрахункових задач умінь і навичок.
Таким чином, як свідчить аналіз літератури, розв’язування розрахункових задач – важливий процес навчання хімії. Найкращих результатів можна досягти при систематичному розв’язуванні різноманітних видів задач. Методологічною основою розв’язування розрахункових хімічних задач являється єдність якісної і кількісної сторін хімічних явищ, отже в процесі розв’язування задач важливо обумовити хімічну частину, а потім тільки робити розрахунки.
2.2 Система розрахункових задач для учнів 9 – 11 класів загальноосвітньої школи
Шкільні олімпіади є однією з наймасовіших та найефективніших форм пошуку навчання та виховання учнівської молоді. Роль предметних олімпіад у розвитку творчих здібностей учнів важко переоцінити. Саме на олімпіадах кожний учасник має можливість виявити знання, висловити свою думку, захистити власну ідею, показати навички та вміння дослідницької роботи, адже це і є творчість.
Учнівські олімпіади з базових дисциплін складаються з кількох етапів, але не мають точно визначених початку і кінця. Написання учнями робіт, що власне, прийнято вважати олімпіадою певного етапу – це лише вершина айсберга, основою якого є наполеглива, кропітка праця учнів та їх учителів протягом навчального року. дуже важливим є те, що олімпіади, як і будь-які змагання, захоплюють, змушують долати труднощі в здобутті нових знань та вмінь.
Для дітей, охоплених олімпіадним рухом, наукові змагання стали невід’ємною частиною їхнього повноцінного життя. Вони стимулюють розвиток юної особистості в науковому, інтелектуальному плані, загартовують волю, адже психологічне навантаження під час змагань досить велике. Можна сказати, що олімпіада – це школа життя, де потрібно вміти визнавати стратегію і вибудовувати тактику досягнення перемоги, уміти гідно програвати та робити правильні висновки з поразок.
Завдання хімічних олімпіад потребують не тільки формальних знань і наявності стандартних навиків при розв’язуванні задач, але й умінь творчо використовувати набуті знання для вирішення тих чи інших проблем. Відмітимо особливості олімпіад них задач, які, як правило, являються комплексними, з широким використанням міжпредметних зв’язків., тобто при розв’язуванні необхідно використовувати різноманітні уміння і навички.
Задачі і вправи, які ми пропонуємо, можуть бути використані не тільки при складанні завдань хімічних олімпіад, а навіть при проведенні конкурсів. Більшість задач якісного характеру можна використовувати на практичних заняттях хімічних кружків і при позакласній роботі. Деякі задачі вчитель може використовувати як дидактичний матеріал, особливо при індивідуальній роботі учнів.
Система задач для учнів 8 – 11 класів.
І. Тексти задач для учнів 8 класу.
1. Будова зовнішнього електронного шару атома елемента – 3s23p3. Складіть повну електронну формулу будови цього атома; Визначте якому елементу вона відповідає. Напишіть формулу вищого гідроксиду цього елементу і наведіть два рівняння реакції, які характеризують властивості гідроксиду.
2. Складіть структурні формули вищих оксиду йоду і гідроксиду йоду.
3. Які з перерахованих сполук будуть реагувати з розчином гідроксиду натрію: гашене вапно, оксид стронцію, оксид фосфору (V), сірчана кислота, гідроксид алюмінію? Напишіть рівняння можливих реакцій.
4. Маємо такі речовини: соляна кислота, сіль кухонна, кварц, їдкий натр. За допомогою яких хімічних реакцій їх можна розрізнити.
5. 1 літр вуглекислого газу при нормальних умовах має масу 1,977 г. Який об’єм молю цього газу при нормальних умовах? Відповідь поясніть.
6. На урівноважено дві колби, в яких знаходиться по 100 г 20% соляної кислоти. У одну з них внесли 20 г металічного цинку, в другу – 20 г мармуру. Чи зміниться рівновага по закінченню реакції? Відповідь підтвердіть розрахунками.
7. Мідну пластинку масою 20 г на деякий час опустили у розчин нітрату ртуті (ІІ). Маса пластинки збільшилась на 2,74 г. Потім пластинку нагріли і вона стала початкового кольору. Скільки важить пластинка після нагрівання?
8. При нагріванні водного розчину Н4Р2О7 утворюється ортофосфорна кислота Н3РО4. Розрахуйте концентрацію розчину Н4Р2О7 при нагріванні якого отримуємо 10% розчин Н3РО4.
9. У якому об’ємному співвідношенні потрібно змішати 20%-ний розчин сірчаної кислоти (r=1,14 г/см3) і гідроксиду натрію (r=1,22 г/см3), щоб отримати нейтральний розчин?
10. До 110 г 10%-ної соляної кислоти додали 480 г 5%-ного розчину їдкого натру, а потім добавили ще 367,5 г 8%-ного розчину сірчаної кислоти. Розчин випарували і отриманий сухий осад розігріли до плавлення. Яка вага осаду після нагрівання?
11. У стакан, який містить 200 г 10%-ного розчину соляної і бромоводневої кислот, опустили цинкову пластину. Коли її витягли, промили і висушили, її маса на 6,5 г стала меншою, ніж до реакції. Визначте концентрацію соляної кислоти, яка залишилася в розчині.
12. Для нейтралізації 20 мл розчину соляної і бромоводневої кислот потрібно 50 мл 0,4Н розчину лугу, а при дії на таку ж кількість розчину кислот надлишку розчину солі срібла випало 0,3315 г осаду. Визначте концентрацію кислот у вихідному розчині.
13. Який хлорид і в якій кількості можна виділити із розчину, що одержаний при обробці заліза масою 5,6 г розчином соляної кислоти 16,6 мл 20%-ним (r=1,1 г/см3)?
14. Розчин хлориду трьохвалентного металу масою 1,450 г обробили розчином нітрату срібла і одержали при цьому 2,298 г хлориду срібла. Визначте, що за елемент входить до складу вихідного хлориду.
15. При розкладі 5,26 г кристалогідрату сульфату нікелю (ІІ) було отримано 2,16 г води. Виведіть вихідну формулу кристалогідрату.
16. Суміш металів, масою 0,94 г, які проявляють валентність у сполуках 2 і 3, повністю розчинили в надлишку розчину їдкого натру. При цьому виділилось 896 мл газу. Визначте які метали входили до складу суміші, якщо атомна маса одного з металів в 1,5 рази більше, ніж атомна маса другого металу, а їх атомне співвідношення в суміші рівне 2 :1.
17. Сіль натрію якоїсь кислоти має 21,6% натрію, а сіль калію цієї ж кислоти – 31,8% калію. Визначне формулу цієї кислоти.
18. Сполука А2В3 утворена елементами, які знаходяться в одному періоді періодичної системи. Оксид елементу А має 47% кисню, а воднева сполука елементу в – 94,1% елементу В. Визначте елементи А і В.
19. Сполуки А з В і А з С взаємодіють з водою. Утворені водні розчини змінюють колір лакмусу відповідно у червоний і синій. Сполука всіх трьох елементів – нерозчинна у воді, але при одночасній дії води і вуглекислого газу перетворюється у розчин. Назвіть елементи А, В і С.
20. Розчин гідроксиду натрію, концентрація якого 50%, а густина r=1,53 г/см3. Який об’єм цього розчину необхідно використати, щоб одержати 2 літри розчину гідроксиду натрію з густиною r=1,012 г/см3.
ІІ. Тексти задач для учнів 9 класу.
1. Будова зовнішнього електронного шару атома елемента 3s23p5. Складіть повну електронну формулу будови цього атома, Визначте, якому елементу вона відповідає і напишіть по два рівняння реакцій, у яких даний елемент проявляє вищу і нижчу ступінь окислення.
2. Чи будуть реагувати між собою такі речовини:
а) вуглекислий магній і азотна кислота;
б) гідрат оксиду кальцію і кислий вуглекислий кальцій;
в) цинк і сірчана кислота;
г) фосфорнокислий кальцій і сірчана кислота.
Напишіть іонні рівняння всіх можливих реакцій і вкажіть умови їх протікання.
3. Скільки молекул знаходиться і 1 мл води?
4. Підпалили суміш, яка складається з 10 г Н2 і 10 л О2. скільки утворилося води? Який газ і в якій кількості в надлишку?
5. Скільки грамів гідриду літію необхідно взяти, щоб при його взаємодії з водою виділився водень, яким можна заповнити шар об’ємом 3 м3? (Тиск 760 мм.рт.ст. або 101,3 кПа, температура 20°С).
6. У посудину об’ємом 1 л, яку заповнили аміаком при тискові 101,3 кПа і температурі 500°С, помістили платиновий каталізатор. Як зміниться тиск у посудині? Відповідь поясніть.
7. Визначте кількість оксиду фосфору (V), який потрібно розчинити в 10 г 35%-ного розчину фосфорної кислоти, щоб концентрація останньої була рівна 40%.
8. У якій кількості води потрібно розчинити 1,42 г пероксиду калію К2О4, щоб отримати 22,4%-ний розчин гідроксиду калію?
9. На 31,6 г перманганату калію подіяли концентрованою соляною кислотою. Газоподібний продукт реакції повністю прореагував з 625 мл розчину сірчистої кислоти концентрацією 0,8 моль/л. Визначте концентрацію іонів водню в розчині, отриманому при взаємодії газу з сірчистою кислотою.
10. Який об’єм 20%-ного розчину сірчаної кислоти (r=1,14 г/см3) потрібно на нейтралізацію 4 г 13,6%-ного розчину гідроксиду натрію?
11. У 100 мл 65%-ного розчину азотної кислоти (r=1,4 г/см3) внесли 3 г металічної міді. Визначте концентрацію в процентах по масі отриманого розчину.
12. Визначте об’єм аміаку, який виділився при нагріванні з надлишком гашеного вапна 1 г технічного нашатирю, який має 1% сульфату амонію. Яку мінімальну кількість 20%-ної сірчаної кислоти (r=1,14 г/см3) потрібно взяти для повного поглинання утвореного газу?
13. До 50 см3 1Н розчину хлориду алюмінію добавили 30 см3 2Н розчину гідроксиду натрію. Осад відфільтрували і прожарили. Визначте його масу.
14. Змішали 41,66 мл 22,2%-ного розчину хлориду кальцію (r=1,20 г/см3) і 24,59 мл 23%-ного розчину карбонату калію (r=1,22 г/см3). Осад відфільтрували. Знайдіть процентну концентрацію речовин, які є у фільтраті.
15. 3,36 л суміші азоту і оксиду сірки (IV) (н.у.) пропустили через надлишок розчину гідроксиду натрію. При цьому маса розчину збільшилась на 6,4 г. Визначте склад газової суміші в процентах по масі.
16. Для повної нейтралізації 250 мл розчину, який складається з сірчаної і соляної кислот, потрібно 23,15 мл 11,2%-ного розчину гідроксиду калію (r=1,08 г/см3). Після нейтралізації до розчину додали розчин хлориду барію, випало 4,66 г осаду. Визначте нормальність кожної кислоти у вихідному розчині.
17. 4 мл деякого газу в результаті взаємодії з 6 мл кисню дали 4 мл сірчистого газу і 4 мл водяних парів. Назвіть формулу газу.
18. Дано три елементи: А, В і С. Сполука В з С розчинна у воді і одержаний розчин зафарбовує лакмус в синій колір. А з В утворюють більше трьох сполук. Водний розчин сполуки в яку входять всі три елементи розчиняє навіть срібло. Назвіть елементи А, В, С і напишіть рівняння реакцій.
19. При дії на сплав з двох металів надлишку розбавленої сірчаної кислоти виділилося 2,24 л водню, а маса сплаву зменшилася на 6,5 г. При розчиненні 1 г залишку в надлишку концентрованої сірчаної кислоти виділилось 112 мл сірчистого газу. Які метали входять до складу сплаву?
20. При електролізі розчину 13 г якоїсь речовини А, що складається з 2 елементів, в розплавленому фториді натрію на аноді виділилося 1 моль водню. Яка речовина піддалась електролізу? Напишіть хімічну формулу речовини і опишіть її властивості.
ІІІ. Тексти задач для учнів 10 класу.
1. До 342 г 105-ного розчину гідроксиду металу другої групи додали надлишок розчину карбонату натрію. При цьому виділився осад масою 39, 4 г. Осад відфільтрували та перемішуючи, розчинили в 46,5 мл 20%-ної хлоридної кислоти (r=1,1 г/см3). Який газ і в якому об’ємі (н.у.) при цьому виділився?
2. При спалюванні 7,3 г невідомої речовини утворилося 8,96 л вуглекислого газу (н. у.), 1,12 л азоту, 9,9 г води. Встановіть формулу речовини, якщо відносна густина її пари за воднем 36,5. Обчисліть, скільки молекул даної речовини міститься в 7,3 г цієї речовини.
3. Для нейтралізації 0,19 г поширеної органічної кислоти, густина парів якої за воднем 30, потрібно 31,7 мл 0,1М розчину гідроксиду натрію. Напишіть структурну формулу цієї кислоти та дайте їй назву.
4. Суміш газів, яка виділилася при розкладі 37,6 г купрум(ІІ) нітрату, розчинили в 28,8 мл води. Яка масова частка утвореної кислоти в одержаному розчині?
5. Пропускаючи через надлишок розжареного вуглецю кисень, одержали 232 л газоподібних продуктів, виміряних при температурі 800°С і р=101,3 кПа. Густина одержаної суміші за воднем складає 17,2. обчисліть об’єм кисню, що вступив у реакцію і склад (в % за об’ємом) утворених газів.
6. 224 мл (н.у.) газоподібного насиченого нециклічного вуглеводню спалили, і продукти розчинили в 1 л 0,148%-ної вапняної води (r=1,0 г/мл), при цьому було одержано 1,0 г осаду. Визначити формулу вуглеводню.
7. Гази, що утворилися при спалюванні 1,12 л суміші ацетилену і пропену (н.у.), пропустили через 300 мл 0,5М розчину гідроксиду калію. Одержаний при цьому розчин може поглинути ще 448 мл оксиду вуглецю (IV). Визначити склад вихідної суміші в процентах за об’ємом, якщо утворюється кисла сіль.
8. Реакція двох газів, змішаних у мольному відношенні 1:2, в замкненому об’ємі призводить до утворення розчину плавикової кислоти з масовою часткою 69%. Що це за гази? Відповідь мотивуйте.
9. Невідомий метал масою 13 г обробили надлишком розбавленого розчину азотної кислоти. До одержаного розчину додали надлишок гарячого розчину гідроксиду калію; при цьому виділилося 1,12 л газу (н.у.). Який метал був розчинений в азотній кислоті?
10. Константа рівноваги гомогенної системи:
СО(г) + Н2О(г) Û СО2(г) + Н2(г)
при 850°С дорівнює 1. Обчислити концентрації всіх речовин при рівновазі, якщо вихідні концентрації СО і Н2О відповідно становлять 3 моль/л і 2 моль/л.
11. При спалюванні суміші три метиламіну і метиламіну утворилося оксиду вуглецю (IV) в 4.4 рази більше за об’ємом, ніж азоту. Визначте масові частки три метиламіну і метиламіну у вихідній суміші.
12. Спалили суміш етану і пропану об’ємом 4,48 л (н.у.) і відносною густиною за воднем 19,9. Одержаний вуглекислий газ пропустили через розчин, що містить 25,6 гідроксиду натрію. Визначте масу і склад солей, які утворюються в результаті реакцій.
13. Етиленовий вуглеводень масою 2,8 г приєднує 2,24 л хлору (н.у.). Знайдіть молекулярну формулу сполуки.
14. При взаємодії насиченого одноатомного спирту масою 40,8 г з надлишком металічного натрію виділився водень об’ємом 4,48 л (н.у.). Знайдіть формулу спирту.
15. При спалюванні 1 моля насиченого вуглеводню утворюється на 112 л менший об’єм оксиду вуглецю (IV), ніж кисню, що витрачається при цьому (н.у.). Знайдіть формулу сполуки.
16. Які солі утворяться при взаємодії ортофосфатної кислоти масою 9,8 г з гідроксидом натрію масою 5 г? Розрахуйте кількість речовини кожної з них.
17. До 200 мл 0,5М розчину сульфатної кислоти додали 150 мл 1М розчину гідроксиду натрію. Які солі і в якій кількості при цьому утворилися?
18. Який об’єм водню можна добути внаслідок взаємодії 4,6 г натрію з 62,5 мл етанолу (масова частка 95,5% густина 0,8 г/см3).
19. У розчин, що містить 3,2 г двохвалентного металу у вигляді хлориду, занурили залізну пластинку масою 50 г. Після повного виділення металу маса пластинки збільшилася на 0,8%. Визначте, що це за метал.
20. При прожарюванні 7,28 г суміші калію і натрію нітратів утворюється 6 г суміші калію і натрію нітритів. Визначте склад вихідної суміші.
IV. Тексти задач для 11 класу.
1. При обробці нітруючою сумішшю ароматичної речовини А, молекулярна формула якої С8Н10 утворюється переважно дві речовини В і В¢, з молекулярною формулою С8Н9О2N. При окисленні речовини А підкисленим водним розчином перманганату калію утворюється речовина С з молекулярною формулою С7Н6О2. окислення при тих же умовах речовин В і В¢ дає ізомерні речовини Д і Д¢. Встановіть будову речовин А, В, В¢, С, Д і Д¢. Напишіть рівняння відповідних реакцій.
2. У колбі нагріли 0,18 г простої речовини А з надлишком концентрованої сірчаної кислоти. Газоподібні продукти реакції пропустили через надлишок розчину гідроксиду кальцію, при цьому утворилося 5,1 г осаду. Визначте вихідну речовину А. Відповідь підтвердьте відповідними розрахунками і рівняннями реакцій.
3. Рівновага реакції 2NO + O2 Û 2NO2 встановилася при таких концентраціях реагуючих речовин. С(NO) = 0,5; C(O2) = 0,7; C(NO2) = 2,1. Як зміниться швидкість прямої і зворотної реакції, якщо в системі зменшити загальний тиск в 2 рази? Чи відбудеться при цьому зміщення рівноваги реакції? Відповідь підтвердьте розрахунками.
4. Сполука Х складається з нітрогену і гідрогену. Сильне нагрівання3,20 г речовини Х веде до його часткового розкладу без утворення твердого залишку. Одержана в цих умовах суміш газів частково абсорбується сульфатною кислотою, при цьому об’єм газів зменшується в 2,8 рази. Газ, що не поглинувся являє собою суміш водню і азоту, при нормальних умовах займає об’єм 140 л і має густину 0,786 г/л. Знайдіть формулу речовини Х.
5. Реакція проходить за рівняння А + В = С + Д. Рівноважна концентрація речовини В – 0,5 моль/л; С – 0,2 моль/ л. константа рівноваги реакції – 0,04. Визначте вихідні концентрації речовин А і В.
6. Суміш порошків заліза та сірки нагріли без доступу повітря. На одержані продукти подіяли хлоридною кислотою, в результаті чого утворилося 6,72 л газів. При повному їх згоранні утворилося 0,2 моль газу. Об’єми всіх газів приведені до нормальних умов. Визначте склад вихідної суміші.
7. Хлорпохідне насиченого вуглеводню має відносну молекулярну масу 237. масова частка хлору в сполуці дорівнює 0,899, а масова частка карбону дорівнює 0,101. Знайдіть молекулярну формулу хлорпохідного.
8. На суміш порошків алюмінію і магнію масою 30 г подіяли надлишком соляної кислоти, а газ, що виділився припустили при 400°С через трубку з оксидом міді (ІІ), а потім через трубку з оксидом фосфору (V). У результаті маса другої трубки збільшилася на 27 г. Визначте масову частку алюмінію в суміші в % з точністю до цілих.
9. Органічна речовина А містить 41,38% С і 3,45% Н, решта Оксиген. При нагріванні з етанолом у присутності кислоти ця речовина утворює сполуку Б, що містить 55,61% С і 6,97% Н і Оксиген. При взаємодії з бромоводнем речовина А утворює продукт В, який при кип’ятінні у воді дає речовину Г, що містить 35,82% С і 4,48% Н і Оксиген. 2,68 г цієї речовини взаємодіє з 20 мл 2М розчину гідроксиду калію. Виведіть структурні формули речовин А, Б, В, Г.
10. На нейтралізацію одноосновної карбонової кислоти масою 5,92 г витратили розчин гідроксиду натрію масою 8 г з масовою часткою лугу 40%. Виведіть молекулярну формулу кислоти.
11. Для реакції 2СО2 = 2СО +О2 при 2000°С склад рівноважної суміші виражається частками: 65,2% СО2, 9,9% СО і 4,9% О2, а загальний тиск в системі складає 1,013 ´ 105. чому дорівнює константа рівноваги цієї реакції при даній температурі, виражена через: а) парціальні тиски реагуючих речовин (Кр); б) їх молекулярні концентрації (Кс)?
12. Який об’єм розчину азотної кислоти з масовою часткою 205 і густиною 1,119 г/моль необхідний для реакції зі сплавом масою 2 г, що складається із міді і золота: масова частка золота 58%. Який газ і в якому об’ємі (н.у.) при цьому виділиться?
13. Відносна молекулярна маса органічної речовини, що складається з вуглецю, водню і кисню рівна 88. При повному згоранні 0,44 г речовини утворюється 560 мл оксиду вуглецю (ІV) (н.у.). Встановіть молекулярну формулу речовини, напишіть можливі формули її ізомерів.
14. При взаємодії 3,25 г металу Х з розчином сполуки У виділився газ і утворився розчин. Якщо до останнього поступово додавати сірчану кислоту, то спочатку з’являється осад, який розчиняється у надлишку кислоти. Газ реагує з киснем з утворенням 0,9 г води. Знайдіть метал.
15. Через суміш аніліну, фенолу і бензолу масою 5 г пропустили хлороводень. Утворився осад, маса якого складає 2,6 г. Осад відфільтрували, фільтрат обробили бромною водою і добули другий осад масою 9,93 г. Визначте масову частку бензолу в суміші.
16. Суміш етанової кислоти і фенолу масою 2,48 г нейтралізували гідроксидом натрію. Через утворені продукти пропустили вуглекислий газ. Об’єм поглинутого вуглекислого газу складає 4,48 л (н.у.). Обчисліть масовий склад вихідної суміші.
17. У закритій посудині спалили 70 мл метану та етану з 120 мл кисню. Після спалювання, поглинення оксиду вуглецю та води і приведенням утвореної суміші до відповідних умов об’єм газу, в якому спалахує тліюча скіпка, складає 30 мл. Визначте об’ємний склад вихідної суміші.
18. Визначити склад і будову насиченої одноосновної карбонової кислоти, якщо на нейтралізацію 7,04 г цієї кислоти необхідно витратити 16,95 мл розчину гідроксиду калію, густина якого складає 1,18 г/см3, а масова частка лугу – 22,4%.
19. При спалюванні 8,96 л суміші метану з етаном (н.у.) і пропускання продуктів реакції горіння через розчин гідроксиду калію утворилося 200 мл 2,6М розчину калію карбонату. Визначте об’ємні частки газів у складі вихідної суміші.
20. При спалюванні 28 л органічної речовини утворилося 112 л вуглекислого газу (н.у.) і 67,5 л води. Густина пари речовини за воднем дорівнює 27. Встановіть молекулярну формулу речовини.
2.3 Система розрахункових задач для позакласної і індивідуальної роботи з обдарованими дітьми
Найважливішим завданням навчання являється формування в учнів уміння використовувати набуті знання. А при аналізі методичної літератури з вивчення практики вчителів видно, що найбільшої уваги вони приділяють формуванню знань, а не правильному використанню цих знань.
Вивчивши програму загальноосвітньої школи з хімії, ми прийшли до висновку, що використовувати розрахункові задачі у процесі навчання хімії, можна і без додаткових затрат часу – на лабораторних, практичних роботах при розв’язуванні експериментальних і експериментально-розрахункових задач.
Ми можемо передбачити, що не важко буде використовувати розрахункові задачі на окремих уроках хімії в якості “індикатору” знань, створивши гетерогенні групи і використавши диференціальний підбір задач. А досить складні задачі учні можуть розв’язувати на факультативних заняттях.
Так, як розв’язування розрахункових задач, в основному, знаходиться на репродуктивному рівні, ми в своєму дослідженні зробили спробу розробити тексти розрахункових задач для учнів 10 класу по темах “Ацетиленові вуглеводні” та “Ароматичні вуглеводні”, які піднімуть процес розв’язування задач до творчого рівня.
Задачі до теми “Ацетиленові вуглеводні”
1. З технічного карбіду кальцію масою 20 г утворюється ацетилен об’ємом 4,48 л (н.у.). Масова частка домішок у такому карбіді кальцію за умови, що практичний вихід ацетилену дорівнює теоретичному, становить: а) 64%; б) 36%; в) 50%.
2. У лабораторії з ацетилену об’ємом 11,2 л (н.у.) і достатній кількості бромоводню добули 1,1-диброметан масою 84,6 г. Яка масова частка виходу продукту реакції від теоретично можливого?
3. Із пропіну кількістю речовини 0,5 моль і хлороводню об’ємом 44,8 л одержали 2,2-дихлорпропан. Яка його маса?
4. У результаті взаємодії пропіну з воднем об’єм суміші зменшився на 12 л і залишилося 4 л водню. Який об’єм займав пропін у початковій суміші?
5. Вуглекислий газ, одержаний спалюванням алкіну об’ємом 2,24 л, пропустили крізь розчин натрію гідроксиду й одержали кислу сіль масою 42 г. Яка формула алкіну?
6. Алкін масою 27 г повністю прореагував з бромоводнем об’ємом 22,4 л (н.у.). Яка його молекулярна формула?
7. Органічна речовина об’ємом 1 л важить 1,1607 г, а 2,24 л цієї сполуки згорає з утворенням вуглекислого газу об’ємом 4,48 л. Яка молекулярна формула цієї органічної сполуки?
8. Ацетилен одержують піролізом метану, який складає природного газу. Розрахуйте об’єм ацетилену, добутого з 2800 м3 метану, якщо об’ємна частка виходу ацетилену від теоретично можливого складає 8,8%.
9. Зразок технічного карбіду кальцію масою 16 г обробили надлишком води. Визначте об’єм газу, який при цьому отримали, якщо відомо, що масова частка домішок у карбіді кальцію складає 20%, а практичний вихід дорівнює 0,8.
10. Який об’єм ацетилену (н.у.) можна одержати взаємодією води з 1 кг технічного карбіду кальцію, масова частка домішок у якому складає 20%?
11. Визначте масову частку домішок у зразку карбіду кальцію, якщо з 200 г його було одержано 56 л ацетилену (н.у.), а практичний вихід складає 100%.
12. При зануренні зразка технічного карбіду кальцію масою 0,08 кг у воду, виділилося 22,4 л (н.у.) ацетилену. Визначте масову частку домішок у технічному карбіді кальцію.
13. При спалюванні 1 моль ацетилену виділилося 1300 кДж теплоти. Яка кількість теплоти виділиться при спалюванні ацетилену, одержаного з технічного карбіду кальцію масою 147,13 г, що містить 13% домішок.
14. Масова частка карбіду кальцію у технічному карбіді кальцію масою 6 г становить 80%. Який об’єм кисню витратили на спалювання одержаного з нього ацетилену?
15. У наслідок спалювання вуглеводню кількістю речовини 0,4 моль утворилася вода масою 21,6 г і оксид вуглецю (IV) об’ємом 35,84 л. Визначте формулу сполуки.
16. Суміш водню і ацетилену об’ємом 56 л пропустили над нагрітим каталізатором. Ацетилен прореагував повністю, а об’єм утвореної суміші становив 44,8 л. Визначте об’ємні частки газів у вихідній суміші.
17. Із технічного карбіду кальцію масою 200 г, де вміст домішок дорівнював 20%, одержали ацетилен, який піддали гідратації. Практичний вихід продукту реакції складає 75%. Яка маса етаналю утворилася?
18. Під час спалювання ацетилену кількістю речовини 1 моль виділяється 1350 кДж теплоти. Скільки теплоти виділяється внаслідок спалювання ацетилену об’ємом 448 л (н.у.)?
19. При спалюванні 28 л органічної речовини утворилося 112 л вуглекислого газу (н.у.) і 67,5 г води. Густина пари речовини за воднем дорівнює 27. Встановіть молекулярну формулу вихідної сполуки.
20. Виведіть молекулярну формулу вуглеводню, при спалюванні 2,24 л якого утворюється 4,48 л оксиду вуглецю (IV), а густина сполуки дорівнює 1,1067 г/см3.
21. Щоб спалити 1 моль ацетиленового вуглеводню необхідно 56 л кисню (н.у.). Встановіть формулу сполуки.
22. На спалювання 0,5 моль ацетиленового вуглеводню необхідно 44,8 л кисню (н.у.). Встановіть формулу сполуки.
23. Вуглекислий газ, що виділився при спалюванні 0,25 моль ацетиленового вуглеводню (н.у.) вистачило на утворення 100 г карбонату кальцію. Назвіть формулу сполуки.
24. Пара води, яка утворилася при спалюванні 0,1 моль ацетиленового вуглеводню, була поглинена оксидом фосфору (V). При цьому утворилося 26,14 г ортофосфорної кислоти. Встановіть формулу сполуки.
25. До 100 мл суміші ацетилену з азотом додали 300 мл кисню. В результаті реакції горіння об’єм суміші зменшився до 280 мл. Визначте об’ємний склад вихідної газової суміші після приведення її до нормальних умов.
26. При пропусканні суміші етану й ацетилену через склянку з бромною водою маса вмісту склянки збільшилася на 1,3 г, а при повному згоранні такої ж кількості суміші утворюється 14 л оксиду вуглецю (IV) (н.у.). Визначте об’єм вихідної суміші за нормальних умов.
Задачі до теми “Ароматичні вуглеводні”
1. Тримеризацією ацетилену об’ємом 62,7 л (н.у.) одержали Бензол масою 19,5 г. Яка масова частка виходу продукту від теоретично можливого?
2. Під час згорання бензолу кількістю речовини 1 моль виділяється 3267,7 кДж теплоти. Яка кількість теплоти виділиться при спалюванні бензолу масою 15,6 г?
3. За умови, що практичний вихід продукту реакції становить 100% із бензолу масою 46,8 і нітратної кислоти масою 25,2 г утворюється нітробензол. Яка його маса?
4. Якщо практичний вихід нітробензолу складає 92%, то які його масу можна добути з бензолу масою 3,9 г?
5. У результаті спалювання ароматичного вуглеводню масою 10,6 г одержали оксид вуглецю (IV) об’ємом 17,92 л (н.у.). Виведіть молекулярну формулу ароматичного вуглеводню.
6. Яку кількість водню за нормальних умов може приєднати бензол кількістю речовини 0,2 моль?
7. Яка відносна молекулярна маса толуолу?
8. У результаті спалювання речовини масою 13,8 г одержали вуглекислий газ об’ємом 23,52 л (н.у.) і воду кількістю речовини 0,6 моль. Густина парів сполуки за воднем складає 46. Яка її молекулярна формула?
9. Ацетилен, одержаний з технічного карбіду кальцію масою 900 г, в якому масова частка домішок становила 14,7%, піддали полімеризації. Яка маса утвореного бензолу?
10. Бромуванням бензолу масою 31,2 г одержали бромбензол масою 40 г. Яка масова частка виходу бромбензолу від теоретично можливого?
11. Із толуолу масою 18,4 г і азотної кислоти масою 18,9 г за умови, що практичний вихід продуктів реакції становить 90% утворюється тринітротолуол. Визначте кількість речовини продукту реакції.
12. Об’єм розчину гідроксиду калію з масовою часткою лугу в ньому 5% і густиною 1,05 г/см3 поглинув вуглекислий газ утворений спалюванням толуолу масою 9,2 г. Визначте об’єм утвореного розчину.
13. Визначте кількість речовини гексахлорциклогексану, добутого з бензолу масою 390 г і хлору об’ємом 358,4 л (н.у.).
14. Яка маса тринітротолуолу утворюється з толуолу масою 23 г, якщо практичний вихід реакції становить 88%?
15. Визначте масу бензолу, отриманого при пропусканні 210 кг циклогексану над платиновим каталізатором при 350 – 450 °С, якщо масова частка виходу бензолу складає 0,85 від теоретично можливого.
16. При спалюванні 1,84 г органічної речовини утворюється 3,136 л оксиду вуглецю (IV) і 1,44 г води (н.у.). Молекулярна маса речовини дорівнює 92 г/моль. Знайдіть молекулярну формулу сполуки.
17. Внаслідок спалювання 0,65 г речовини добули 2,2 г оксиду вуглецю (IV) та 0,45 г води. Густині пари цієї речовини за воднем дорівнює 39. Знайдіть молекулярну формулу сполуки.
18. На спалювання гомолога бензолу кількістю речовини 1 моль витрачається кисню на 2 моль більше ніж утворюється при цьому вуглекислого газу. Що це за гомолог?
19. При спалюванні ароматичного вуглеводню кількістю речовини 1 моль утворюється вода кількістю речовини у 2,5 рази меншою від кількості речовини кисню витраченого на спалювання. Визначте формулу сполуки.
20. На спалювання 0,2 моль ароматичного вуглеводню витрачається 2,1 моль кисню. Встановіть формулу сполуки.
21. При дегідруванні етилбензолу масою 4,24 г, отримали стирол. Вихід продукту реакції дорівнює 75%. Яка маса розчину брому в тетрахлориді вуглецю може знебарвити отриманий стирол, якщо масова частка брому в розчині складає 4%?
22. Який об’єм повітря 9н.у.) необхідно для повного згорання 1,4-диметилбензолу масою 5,3 г? Об’ємна частка кисню в повітрі складає 21%.
23. При згоранні гомолога бензолу, масою 0,92 г в кисні одержали оксид вуглецю (IV), який пропустили через надлишок розчину гідроксиду кальцію. При цьому утворився осад масою 7 г. Визначте формулу вуглеводню.
24. Ароматичний вуглеводень, який є гомологом бензолу, масою 5,3 г спалили, отримали вуглекислий газ об’ємом 8,96 л (н.у.). Визначте формулу вуглеводню.
25. Із ацетилену об’ємом 3,36 л (н.у.) добули бензол об’ємом 2,5 мл. Визначте вихід продукту, якщо густина бензолу становить 0,88 г/мл.
26. Бензол, отриманий дегідруванням циклогексану об’ємом 151 мл і густиною 0,779 г/мл, піддали хлоруванню при світлі. Отримали хлорпохідне масою 300 г. Визначте вихід продукту реакції.
27. Суміш бензолу з циклогексаном масою 4,39 г знебарвлює бромну воду масою 125 г з масовою часткою брому 3,2%. Яка маса води утворюється при спалюванні в кисні тієї ж кількості вихідної суміші за нормальних умов?
28. При бромуванні бензолу в присутності броміду заліза (ІІІ) отримали бромоводень, який пропустили через надлишок розчину нітрату срібла. При цьому утворюється осад масою 7,52 г. Розрахуйте масу отриманого продукту і назвіть його.
29. Суміш бензолу і стиролу деякої маси знебарвлює бромну воду масою 500 г з масовою часткою брому 3,2%. При спалюванні суміші тієї ж маси виділився оксид вуглецю (IV) об’ємом 44,8 л (н.у.). Визначте масові частки брому і бензолу в суміші.
Розділ 3. експериментальна перевірка ефективності використання розрахункових задач з хімії на розвиток творчих здібностей школярів
3.1 Суть і методика експериментального дослідження
Розглянемо можливості використання розрахункових задач на заняттях, підсумкових уроках, і факультативних годинах.
Виходячи з аналізу літератури з проблем розв’язування хімічних задач, ми розробили наступну методику розвитку творчої і пізнавальної активності учнів. Спочатку вчитель детально пояснює розв’язування задач учням, показуючи, як потрібно розглянути задачу і записати умову, рівняння реакції, як на основі аналізу задачі намітити план її розв’язування. У залежності від конкретних умов (ступінь активності класу, рівень теоретичної підготовки) учитель пояснює один чи два раціональних способи розв’язування задач, чітко витримуючи оформлення розв’язування і запис відповіді.
Коли розв’язування буде осмислено і зафіксовано у зошитах учнів, то переходять до наступного етапу навчання – фронтальному розв’язуванню подібних задач усім класом. У форму бесіди проводиться запис умови, аналіз і складання плану. Учитель направляє учнів по правильному шляху раціонального вибору способу розв’язку, а саме розв’язування виконують учні самостійно.
Нарешті наступає етап повної самостійності учнів при розв’язуванні задач даного типу. Перевірка самостійної роботи на перших етапах навчання розв’язувати задачі проходить при обов’язковому порівнянні розв’язку, даного учнями, з правильними (схема 5).
У нашому дослідженні сам факт розв’язування задачі – це не саме головне, головним являється повторення конкретних хімічних понять, пов’язаних з задачею або розгляд нового фактичного матеріалу, оволодіння новими прийомами мислення, тобто кожна задача повинна давати нові знання.
Схема 5 Модель формування вмінь розв’язувати розрахункові задачі
|
Розв’язування задачі за зразком (учитель пояснює розв’язок задачі при активній участі учнів) |
|
|
| Розв’язування видозмінених учбових задач (фронтальне, групове розв’язування розрахункових задач) |
|
|
|
Розв’язування варіативних учбових задач (індивідуальне розв’язування задач) |
|
|
| Розв’язування творчих задач (індивідуально-диференційоване розв’язування розрахункових задач при ускладнених умовах) |
Направляти учнів до самостійного аналізу способу розв’язування можна не тільки постановкою питань про хід розв’язування задачі, а й шляхом застосування захисту учнями запропонованого способу розв’язування перед класом, організації взаємоперевірки між учнями.
Проведена експериментальна робота в школі і аналіз методичної літератури дає можливість рекомендувати деякі конкретні шляхи використання розрахункових задач при навчанні хімії. Розглянемо деякі організаційні форми розв’язування розрахункових задач.
Демонстраційне розв’язування учителем. Ця форма може бути використана при поясненні нового матеріалу і при ознайомленні учнів з розв’язуванням задач нового типу.
Ця організаційна форма розв’язування розрахункових задач привчає використовувати тільки що отримані знання для розв’язання питань практичного характеру, для засвоєння і уточнення матеріалу, а також навчанню правильних вмінь і навичок.
Демонстраційне розв’язування задач учнями. Ця форма розв’язування розрахункових задач особливо цінна при текучій перевірці знань учнів. Вона служить первинним “індикатором” знань учнів з хімії. Від учнів вимагається правильно використовувати отримані знання, що дає можливість визначити розуміння викладеного матеріалу.
Ця форма може бути використана таким чином:
а) задачу розв’язує біля дошки один учень, а весь клас приймає участь в обговоренні шляхів розв’язування задачі, пропонує різні способи розв’язку і захищає їх;
б) біля дошки 3 – 4 учня. Кожен розв’язує свою задачу, пояснюючи її розв’язок. Клас також працює над цими задачами.
Групове розв’язування розрахункових задач. Клас розбивається на гетерогенні групи по 5 – 6 учнів. Кожна група отримує свою задачу. У групі є консультант, який відповідає за підготовку і розв’язування задачі. Після закінчення роботи представник кожної групи (як правило найслабший) зачитує умови даної їм задачі і пояснює її розв’язок. Інші учні записують у зошити рівняння хімічних реакції, якщо вони потрібні, та короткий розв’язок задачі.
Групове розв’язування дає можливість розв’язувати більшу кількість задач, але не забезпечує необхідної індивідуальної роботи.
Класна фронтальна форма розв’язування задач. Ця форма найбільш якісна при навчанні учнів розв’язувати задачі нового типу. Всі учні отримують одну й ту ж задачу і під керівництвом учителя поступово розв’язують її. При цьому відбувається відбір однієї правильної із запропонованих версій розв’язування задачі. Дуже важливо, щоб вчитель не задиктовував шлях розв’язування задачі, а лише направляв його в потрібне русло. Учні не повинні пропонувати власні шляхи розв’язування задачі.
Індивідуальна форма розв’язування розрахункових задач. Ця форма використовується з метою повторення і закріплення методу розв’язування задач нового типу. Для проведення даної методики навчання складають індивідуально-диференційовані завдання, враховуючи рівень підготовки і індивідуальні особливості учнів.
Для цього виділяється три групи учнів і розробляється три варіанти завдань: основний, ускладнений і спрощений.
Неоднакові варіанти завдань мають різний рівень складності, що дозволяє усім учням працювати на повну можливість своїх сил і можливостей.
Задачі основного варіанту передбачають використання знань і вмінь, якими повинні володіти всі учні. Задачі ускладненого варіанту підходять для учнів, які найбільш успішно оволоділи знаннями і вміннями в розв’язуванні розрахункових задач, виявляють більшу самостійність в учбово-пізнавальній діяльності, виявляють значну гнучкість при розв’язуванні розрахункових творчих задач.
Задачі спрощеного варіанту передбачають використання їх у тих випадках, коли в учня виникають труднощі при розв’язуванні задач основного варіанту.
Можна при цій формі роботи використовувати картки – завдання для економії часу. Причому в учня є можливість самому вибирати рівень складності задачі.
Усі учні отримують різні задачі. Кожен учень повинен розв’язати їх самостійно і здати вчителю.
Ця форма роботи учнів найбільш цікава і корисна.
При розв’язуванні задач учні перевіряють себе, наскільки вони уміють використовувати свої знання для вирішення задач. Хід і результати розв’язування задач дають можливість вчителю визначити пробіли в знаннях і вчасно їх ліквідувати.
Контрольно-залікова форма розв’язування розрахункових задач. Використовується, в основному, після вивчення значного об’єму матеріалу. Перед контрольною роботою учитель називає тему, з якої вона буде проводитися, нагадує які типи задач будуть використовуватися, надає приклади.
Нами апробовано різноманітні форми ознайомлення учнів з умовами розв’язування задач:
1. Умова читається вчителем.
Учні записують її в зошит. Ця форма використовується, головним чином, при початковому ознайомленні учнів з новим типом задач.
2. Запис умови на дошці.
Учитель до уроку записує на дошці умови тих задач, які учні повинні розв’язати до кінця уроку. Запис використовується при груповому розв’язуванні задач, коли для кожної групи учитель пише лише умову задачі. Учні записують умову в зошит. Ця форма не завжди доцільна, бо займає багато часу.
3. Картки з завданнями.
Це найкращий спосіб ознайомлення учнів з умовами задачі, які можуть бути використаними учителем при різних формах розв’язування розрахункових задач. При підготовці до уроку учитель відбирає картки (їх доцільно розкласти в конверти по темах) в тому ж порядку як запропонує їх розв’язувати на уроці, бо картки-задачі суворо індивідуальні, вони стимулюють творчість учнів, підвищують їх відповідальність за якість підготовки до уроку, дають можливість учителю об’єктивно оцінювати рівень сформованих знань і вмінь при розв’язуванні розрахункових задач.
Під час нашої роботи в школі, в результаті спостереження за учбовою діяльністю учнів, ми побачили, що вони інколи, розв’язують задачу по тому зразку, який дав вчитель і не пропонують зробити це нестандартним способом, по своєму. Адже більшість збірників задач, які використовують учителі хімії, в своїй роботі, відповідають класичному репродуктивному підходу і здебільшого розраховані на тренування пам’яті, а не на розвиток логічного мислення і використання творчих методів. Підбір індивідуальних карток-завдань являється метою, для учнів не стільки одержанням відповіді якимись діями, а вмінням зрозуміти задачу – значить так або інакше передбачити її розв’язання, розібратися в тому, що дано, і що потрібно знайти. Аналіз задачі важливий для всього процесу розв’язку, так як це дає можливість помітити гіпотезу як ідею розв’язування задачі.
У зв’язку з цим ми запропонували, що при розв’язуванні розрахункових задач слід використовувати аналітико-синтетичний шлях, тобто той шлях, який використовують самі учні.
Спираючись на дані аналізу методичної літератури, свої спостереження за учнями процес розв’язування розрахункових задач ми представили як ряд взаємних етапів.
Перший етап: уважно прочитати текст задачі. Якщо текст задачі сформульований автором задачника не зовсім зрозумілий, можна перефразувати умову. В результаті цього учень зрозуміє, про що говориться в умові задачі, про хімічні процеси, чи певну речовину.
Другий етап: перетворення умови задачі на хімічну мову, тобто вираження даних речовин хімічними формулами. Правильне оформлення даних задачі впливає на успішний аналіз її змісту і вибору по черговості розв’язку.
Третій етап: якщо в умові йдеться про хімічні процеси, то записують рівняння реакцій, про речовини – формули. З’ясовується фізична чи хімічна суть явищ, про які йдеться мова в умові, аналізується умова задачі.
Четвертий етап: на основі аналізу задачі – пошуком, що відомо і що потрібно знайти складається план розв’язування задачі.
П’ятий етап: вибирається раціональний шлях розв’язку задачі, який вимагає найменше математичних обчислень. Записується розв’язок задачі, проводяться математичні обчислення і знаходиться величини, які необхідно було знайти за умовою задачі.
Ми вважаємо, що крім загального алгоритму розв’язування задач, потрібно використовувати конкретний алгоритм на певний вид задачі, тоді слабші учні також зможуть продуктивно працювати.
Іноді при розв’язуванні задач можна дозволити користуватися зошитом, підручником. У тому випадку, коли проводять контрольну роботу це заборонено.
Розрахункові задачі можна використовувати на початку і в кінці комбінованого уроку, коли на основі отриманих знань виводиться ціла драбина нових понять і явищ. Так як ми вже вказували, однією з функцій розрахункових задач є функція контролю, отже доцільно використовувати їх на заключних уроках з певної теми. У цьому випадку ефективний індивідуальний розв’язок розрахункових задач. І нарешті, на контрольних роботах. Розрахункові задачі на різних типах уроків можна використовувати з метою систематизації отриманих знань, розвитку логічного мислення, досягнення вправності при їх розв’язуванні. Для досягнення високої якості вміння розв’язувати задачі потрібно на кожному етапі навчання використовувати спеціально підібрані і складені завдання зі зростаючою важкістю, розраховані на роботу з різними групами учнів, включати навчаючі, тренувальні і контрольні розрахункові задачі у різноманітні види самостійних робіт, а також в програми факультативних занять.
3.2 Аналіз результатів експериментальних даних
Для перевірки ефективності використання розрахункових задач у процесі навчання хімії ми провели пробний експеримент в 10-х класах загальноосвітньої школи № 10 м. Полтави. Навчання десятикласників у цій школі проводиться диференційовано. З цією метою за рівнем учбових можливостей усі учні чотирьох 10-х класів були розділені на групи.
У групі “А” зібрані учні з низьким рівнем учбових можливостей. У групах “Б” і “В” – основним, і в групах “Г” і “Д” зібрані учні з високим і творчим рівнем. Як і передбачено програмою, кожна група займається вивченням хімії 2 години на тиждень, але для цього в школі складено додатковий розклад, згідно з яким іноді проводяться нульові і сьомі уроки.
Перед тим, як почати роботу з цими групами, були проведені спостереження за діяльністю учнів на уроках хімії, бесіди з учителем хімії про особливості учнів кожної групи, індивідуальні бесіди з школярами 10-х класів, були вивчені їхні письмові роботи з розв’язками розрахункових задач. Також ознайомилися з методичними прийомами, які використовувалися при навчанні учнів розв’язувати розрахункові задачі різних типів, виявили різноманітність підходів до розв’язування задач, встановили помилки і проблеми, які виникали в процесі розв’язування задач, виявили їх причини.
Спостерігаючи за учнями, ми цікавилися також їхнім відношенням до розв’язування задач.
Індивідуальні бесіди, які проводили з учнями до початку уроків і після них передбачали: виявити рівень знань учнів з хімії (особливо із задач). Передбачалося також зниження недовіри учнів до творчого підходу при розв’язуванні задач і налагодження робочої атмосфери.
Цінним фактичним матеріалом були продукти діяльності учнів – розв’язування розрахункових задач. Ці матеріали, головним чином, використовувалися для фіксації і аналізу проблем і помилок, які виникали при діяльності учнів.
На уроках були проведені 10-ти хвилинні самостійні роботи з розв’язування розрахункових задач. Також ми запропонували за 10 хвилин до кінця уроку розв’язувати задачі інших типів.
Констатуючий експеримент показав, що розв’язувати правильно розрахункові задачі можуть ½ учнів. Приблизно ¼ частина учнів приступають до розв’язування завдань не зрозумівши змісту умови задачі, і не завжди у зв’язку з цим, передбачають собі той результат, який повинен бути отриманий. Практично 2/3 учнів не уміли правильно виконувати елементарні дії (провести подумки експеримент, який потребує всебічного аналізу хімічного процесу, на базі якого сформований сюжет задачі, виявлено багато суттєвих помилок при записі формул, умов задачі).
У подальшій своїй роботі, перед тим, як приступати до розв’язування розрахункових задач ми ознайомили учнів з тими знаннями і уміннями які необхідні для розв’язування задач з тем: “Ацетиленові вуглеводні” та “Ароматичні вуглеводні”. Учні повинні знати та уміти:
Знати:
1. Склад, хімічну будову ацетиленових і ароматичних вуглеводнів.
2. Хімічні властивості і застосування, умови проведення хімічних реакцій;
3. Назви вивчених сполук.
Уміти:
1. Складати електронні та структурні формули речовин, пояснювати їх зміст;
2. Складати рівняння хімічних реакцій, які характеризують властивості вивчених сполук їх взаємозв’язок;
3. Обчислювати: масу, об’єм або кількість речовини за відомими даними про вихідні речовини, один з яких взято в надлишку; вихід продуктів реакції відносно теоретичного і молекулярну формулу речовини за результатами аналізу, знаючи її відносну густину або масову частку елементів, які входять до складу цієї речовини.
Велику увагу приділяли самопідготовці учнів, якість якої перевірялася на початку формуючого експерименту.
Починали ми формувати уміння розв’язувати розрахункові задачі з демонстраційного розв’язування задач, акцентуючи увагу учнів на найбільш суттєвих моментах.
Деякі задачі розв’язували сильні учні, вони ж і пояснювали хід розв’язку класу.
Наступним етапом було розділення класів на групи. У групах “Б” і “В” першу задачу нового типу розв’язував учитель, приймаючи до уваги запропоновані учнями шляхи розв’язку. У групах “Г” і “Д” на розв’язування цих же задач викликалися 2 сильні учні. Увесь клас активно приймав участь, пропонуючи ті чи інші шляхи розв’язку.
На наступному рівні була запропонована групова форма роботи по розв’язуванню розрахункових задач. У кожній групі був визначений консультант, який відповідав за підготовку всієї групи. Він пояснював учням незрозумілі моменти у проведенні розрахункової частини задачі. Коли було необхідно вони консультувалися в учителя.
Потім з кожної групи виступав представник (ми намагалися, щоб це був слабкий учень), який розповідав про обраний шлях розв’язування задачі. По відповіді цього учня ми оцінювали роботу всієї групи.
На окремих уроках під час опитування 1 – 2 учні розв’язували задачі біля дошки. Проводили 15-ти хвилинну самостійну роботу. На ній було 6 варіантів. Завдання давалися різних рівнів складності.
Оцінювання проводили за такою шкалою:
| Рівень | Показники якості розв’язування розрахункових задач |
|
високий |
Умова задачі може бути передана своїми словами чи коротко записана, самостійно вибраний раціональний хід розв’язування. Якщо можливо, розв’язування проведено кількома способами. В оформленні і розв’язуванні задачі відсутні логічні помилки. Розрахунки зроблені правильно з поясненнями. |
|
середній |
Хід розв’язування раціональний. Логічних помилок не має, але пояснення неповне. Допущено не більше однієї суттєвої помилки. |
|
достатній |
У розрахунках допущено 1 – 2 не суттєвих помилки. Хід розв’язування не раціональний. Робота виконана з допомогою вчителя. |
|
низький |
Зроблено менше ½ роботи. При розв’язку допущені суттєві помилки. Задача не розв’язана. |
Аналіз показав, що із 57 учнів:
| групи “Г” і “Д” | групи “Б” і “В” | |
| І. Виконали завдання повністю | 15 | 7 |
| ІІ. Виконали частково | 7 | 12 |
| ІІІ. Не виконали зовсім | — | 6 |
Коефіцієнт формування умінь розв’язувати розрахункові задачі рівний:
К = SLo ¸ n ´ LA
де, SLo – загальна сума виконаних завдань;
n – загальна кількість учнів;
LA – загальне число запропонованих завдань.
К » 0,3 бали.
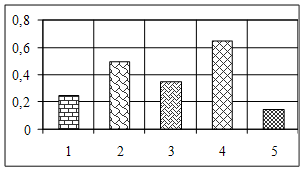
Успішність при цьому:
Х = 5 ´ 11 + 13 ´ 4 + 18 ´ 3 + 5 ´ 2 ¸ 57 = 3,1
При розв’язуванні розрахункових задач з теми “Ацетиленові вуглеводні” ми запропонували учням розв’язувати 1 складну задачу замість 2 посередніх. Тут ми знову притримувалися індивідуально-диференційованого підходу.
Ось що показали результати аналізу роботи:
| групи “Г” і “Д” | групи “Б” і “В” | |
| І. Виконали завдання повністю | 10 | 4 |
| ІІ. Виконали складну частину | 12 | 6 |
| ІІІ. Виконали завдання середньої важкості | 5 | 19 |
| ІV. Не виконали зовсім | — | 7 |
К = 0,35 бали
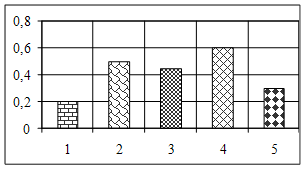
Успішність:
Х = 14 ´ 5 + 22 ´ 4 + 20 ´ 3 + 7 ´ 2 ¸ 63 = 3,4
Ми продовжували роботу з учнями і при вивченні теми “Ароматичні вуглеводні”, де були отримані наступні результати:
К = 0,41 бал.
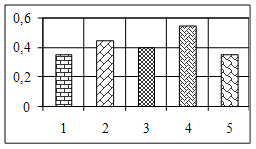
Успішність:
Х = 18 ´ 5 + 23 ´ 4 + 18 ´ 3 + 2 ´ 2 ¸ 61 = 3,7
Після проведення діагностичного експерименту, ми прийшли до висновків, що розрахункові задачі ефективно використовувати на уроках з хімії, так як при розв’язуванні цих задач удосконалюються знання з хімії, підвищується розуміння хімічних процесів, розвивається логічне мислення, підвищується успішність учнів.
Безумовно, для формування творчого підходу до розв’язування розрахункових задач потрібно більше часу. Але навіть на основі експерименту не важко побачити, що постійне акцентування уваги учнів на розрахункових задачах через певний час дасть переможців олімпіад.
ВИСНОВКИ
Результати теоретичного й експериментального дослідження підтверджують висунуту гіпотезу й дозволяють сформулювати такі висновки:
1. Аналіз науково-методичних та психолого-педагогічних джерел дав можливість прийти до висновку про необхідність розгляду проблеми розвитку творчих здібностей у гносеологічному і особистісно-процесуальному аспектах.
Розвиток інтелектуальних здібностей учнів шляхом включення в активну навчально-пізнавальну діяльність як її суб’єкта – обов’язкова умова досягнення освітніх, виховних і , особливо, розвиваючих цілей навчання.
2. Проведений психолого-педагогічний аналіз проблеми, опрацювання навчально-методичної літератури з хімії дозволили висунути і обґрунтувати ідею про необхідність розробки і доцільність впровадження у шкільну практику системи хімічних задач для розвитку творчих здібностей учнів.
3. Експериментальне дослідження показало, що використання запропонованої системи розрахункових задач є ефективним засобом активізації навчально-пізнавальної діяльності учнів на заняттях з хімії, сприяє формуванню в них стійких пізнавальних інтересів, що поступово переходять у пізнавальну потребу, творчих вмінь робити винаходи, досліджувати, оцінювати, розкривати сутність хімічних явищ, процесів, законів та методів пізнання.
4. Наслідування внутрішньої логіки хімічної науки при навчанні методам розв’язування розрахункових задач досягається за умови встановлення зв’язку між відомою учням і новою для них навчальною інформацією та врахування циклічності процесу і служить реальною передумовою розвитку творчих здібностей школярів на заняттях з хімії.
5. Цілеспрямоване включення системи розрахункових задач у навчальний процес з хімії сприяє розвитку у них конвергентного і дивергентного мислення, мнемічних здібностей, формує реалістичну “я – концепцію”, дає можливість наблизити навчальну діяльність до наукової, що підвищує науковий рівень шкільного курсу з хімії.
6. Вивчення і використання запропонованої методичної системи викладачами шкіл розширить їх погляд на хімічну задачу, як на загально-дидактичну категорію, метод навчання та засіб розвитку творчих здібностей учнів навчальному процесі з хімії.
СПИСок використаних джерел
1. Абкин Г.А. Методика решения вычислительных задач по химии. – М.: Учпедгиз. – 1958. – 86с.
2. Астахов О.І. Методика викладання хімії. – К.: Рад. Школа. – 1954.
3. Балюбаш Я., Дробчан В.Д. Розвивати творчі здібності школярів // Радянська школа. – 1988. – № 8. – С. 34 – 36.
4. Бердоносов С.С., Добрынина Н.А. Решение задач на процентную концентрацию растворов // Химия в школе. – 1976. – № 1. – С. 59.
5. Богданова А., Борисов С. Складові творчості // Завуч. – 2001. – № 6. – С. 2 – 5.
6. Богданова А., Борисов С. Технологія організації творчого педагогічного процесу // Завуч. – 2001. – № 6. – С. 6 – 9.
7. Богоявленская Д.Б., Богоявленская М.Е. Творческая работа – просто устойчивое словосочетание // Педагогика. – 1998. – № 3. – С. 36 – 43.
8. Брайко В.И., Мушкало Н.М. Олимпиадные задачи по химии. – К.: Рад. Школа. – 1979.
9. Буринська Н., Величко Л. Програми для загальноосвітніх навчальних закладів хіміко-біологічного профілю навчання // Хімія. Біологія. – 2001. – № 53.
10. Буринская Н.Н. Методика преподавания химии. – К.: Высшая школа. – 1987.
11. Буринская Н.Н., Дроздов С.Н. Творческий поиск учителя // Химия в школе. – 1985. – № 3. – С.52 – 55.
12. Веденин А.Я. решение расчётных задач по химии. – М.: Просвещение. – 1972.
13. Вывюрский В.Я. Самостоятельные работы по органической химии. – М.: Высшая школа. – 1982.
14. Галатюк Ю. Творча функція навчання // Шлях освіти. – 2000. – № 3. – С. 36 – 43.
15. Гара Н.М. Учить творчеству. – М.: Высшая школа. – 1987.
16. Гирін В. Учнівські олімпіади з хімії: якими їм бути? // Хімія. Біологія. – 2000. – № 25 – 26. – С. 4.
17. Глинка Н.Л. задачи и упражнения по общей химии. – Ленинград.: Химия. – 1984.
18. Гольдфарб Я.Л., Ходаков Ю.В. Сборник задач и упражнений по химии. Изд. 3-е. – М.: Просвещение. – 1974.
19. Глориозов П.А. формирование умений и навыков в процессе обучения химии // Химия в школе. – 1980. – № 3. – С. 18 –20.
20. Грузнова С., Зарицька Т. Комбінований підхід до підбору олімпіадних завдань // Хімія. Біологія. – 2000. – № 25 – 25. – С. 3.
21. Дейнеко В.И. Как научить школьников решать задачи по химии. – М.: Просвещение, 1987
22. Денисова В.Г. Школьная химическая олимпиада // Химия в школе. – 2001. – № 8. – С. 78 – 82.
23. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии. – М.: Просвещение. – 1989.
24. Енгекова Т.М. Как мы используем качественные задачи при изучении химии // Химия в школе. – 1982. – № 5. – С. 44.
25. Зуева М.В. Развитие учащихся при обучении химии. – М.: Просвещение. – 1978. – 125с.
26. Из опыта решения задач повышенной трудности // Химия в школе. – 1989. – № 3. – С. 80.
27. Казанцева І. Творча діяльність як засіб формування міцності знань школярів // Рідна школа. – 2001. – № 2. – С. 26 – 28.
28. Калягин Ю.М., Оганесян В.А. Учись решать задачи. – М.: Просвещение. – 1980.
29. Клесктон Г. Любой ребёнок склонен к творчеству // Шкільний світ. – 2001. – № 11 – 12. – С. 12 – 13.
30. Клименко В. Механізм творчості: чим його розвивати // Шкільний світ. – 2001. – № 25 – 28. – С. 1 – 94.
31. Коновальчук С. Підготовка старшокласників до участі в предметних олімпіадах // Хімія. Біологія. – 2001. – № 62. – С. 3 – 4.
32. Корчанова О. Формування в учнів досвіду творчої діяльності // Шлях освіти. – 1999. – № 1. – С. 35 – 39.
33. Кульман А.Г. Сборник задач по общей химии. Издание 2-е. – М.: Высшая школа. – 1975.
34. Лабий Ю.М. Решение задач по химии с помощью уравнений и неравенств. – М.: Просвещение, 1980.
35. Линькова Н.О. Анализировать ход поиска решений // Наука и техника. – 1984. – № 11. – С. 34.
36. Методика обучения химии в средней и высшей школе. – М.: Просвещение. – 1978.
37. Момот Л., Шелестова Л. Творчий розвиток учнів у процесі навчання // Шлях освіти. – 1998. – № 1. – С. 10 – 12.
38. Момот Л., Шелестова Л. До проблеми формування творчих здібностей у процесі навчання // Педагогіка і психологія. – 1997. – № 2. – С. 53 – 59.
39. Никифоров В.Д. К исследованию эффективности решения задач различными методами // Химия в школе. – 1975. – № 2. – С. 75.
40. Орієнтовна програма підготовки до олімпіади з хімії // Хімія. Біологія. – 1999. – № 45. – С. 3.
41. Осадченко І. Проблема стимулювання активної творчості школярів // Рідна школа. – 2001. – № 11. – С.54 – 55.
42. Пасечникова И. Создание условий для формирования творческой личности учащегося // Імідж сучасного педагога. – № 3 – 4.– С. 87.
43. Плетнер Ю.В., Полосин В.С. Практикум по методике преподавания химии. – М.: Просвещение, 1981.
44. Преподавание неорганической химии в средней школе. – М.: Просвещение. – 1975.
45. Протасов П.Н., Цитович И.К. Методика решения расчётных задач по химии. Издание 3-е. – М.: Просвещение. – 1978. – 136с.
46. Педагогіка і психологія. – 1996. – № 3. – С. 70 – 74.
47. Пойя Д. Как решать задачу. – М.: Учпедгиз. – 1961.
48. Романова Н.В. Загальна та неорганічна хімія. – К.: Вища школа. – 1998. – 465с.
49. Рудзитис Г.Е., Фельдман Ф.Р. Неорганическая химия. – М.: Просвещение. – 1990.
50. Семёнов И.Н. Психология рефлексии и педагогика творчества // Химия: методика преподавания в школе. – 2001. – № 4. – С. 46 – 52.
51. Середа И.П. конкурсные задачи по химии. – К.: Высшая школа. – 1984.
52. Скребков К.Ф. Решение задач на смешение растворов // Химия в школе. – 1975. – № 3. – С. 41.
53. Творчі здібності людини // Основи психології (за ред. В.А. Рошенця). – К.: Освіта, 1995. – С. 343 – 346.
54. Тушева В. Формувати творчу активність учнів // Рідна школа. – 1998. – № 4. – С. 67 – 68.
55. Уфимцева А.С., Хрусталёв А.Д., Процайко Т.А., Ковальчук А.А. К решению расчётных задач // Химия в школе. – 1987. – № 6. – С. 45.
56. Ходаков Ю.В., Энштейн Д.А., Глориозов П.А. Неорганическая химия. – М.: Просвещение. – 1986.
57. Хомченко И.Г. Сборник задач и упражнений по химии. – М.: Высшая школа. – 1989.
58. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в Вузы. – М.: Высшая школа. – 1986.
59. Хрусталёв А.Ф. О решении некоторых задач на выведение молекулярной формулы вещества // Химия в школе. – 1975. – № 4. – С. 64.
60. Хрусталёв А.Ф. Выбирать оптимальные варианты решения задач // Химия в школе. – 1984. – № 1. – С.54.
61. Цветков Л.А., Иванова Р.Г, Полосин В.С. Общая методика обучения химии. – М.: Просвещение. – 1981.
62. Черненко А.П. Основи творчості // Радянська школа. – 1989. – № 7 – 8. – С. 11 – 34.
63. Чернобельская Г.М. Основы методики обучения химии. – М.: Просвещение. – 1987.
64. Шаповалов А.І. Методика розв’язання задач з хімії. – К.: Радянська школа. – 1963.
65. Шевалёва А.С. Задачник-практикум по методике решения расчётных задач по химии. – М.: Учпедгиз. – 1963.
66. Шаповаленко С.Г. Методика обучения химии. – М.: Учпедгиз. – 1963.
67. Шелинский Г.И., Никанорова Л.А. Существенные недостатки в знаниях по химии // Химия в школе. – 1987. – № 5. – С. 47.
68. Шишкин Е.А. О решении задач когда одно из веществ взято в избытке // Химия в школе. – 1975. – № 3. – С. 43.
69. Шмуклер Е.Г. Развития у учащихся умений и навыков в решении типовых задач в ІХ и Х классах // Химия в школе. – 1989. – № 2. – С. 34.
70. Якушкина М.С., Кондратюк И.П. Воспитание одарённости: альтернативная олимпиада // Химия в школе. – 2001. – № 62. – С. 3 – 4.