
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Курсовая работа: Методические разработки урока по теме "Спирты"
Курсовая работа: Методические разработки урока по теме "Спирты"
ВВЕДЕНИЕ
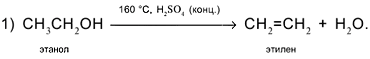
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
ГЛАВА 1. ПРОИЗВОДСТВО ЭТАНОЛА ФЕРМЕНТАЦИЕЙ БИОМАССЫ
Получение этанола. Обычно этанол получают отгонкой, и, по всей вероятности, этот способ будет применяться и в ближайшем будущем. Отгонка производится в колоннах путем последовательного отделения этанола от других компонентов жидкой фазы.
Отделение барды. В первой колонне отделяются продукты ферментации (главным образом этанол) и некоторое количество воды от неферменти-рующихся твердых веществ в жидкой фазе (барде). Эта колонна обычно называется «пивным перегонным кубом». Желательно, чтобы на этом этапе из жидкой среды был отогнан весь этанол. В некоторых конструкциях колонн возможно увеличение концентрации этанола в верхнем погоне путем ректификации. Для отделения твердых веществ из жидкой фазы, движущейся вниз, предусмотрена отпарная секция.
Производство безводного этанола. Последовательность перегонки после «пивного перегонного куба» зависит от требований, предъявляемых к этанолу. При производстве пищевого этанола последний должен быть очищен в соответствии с требованиями спецификаций на этанол или продукт, в котором он будет использован. При производстве этанола промышленного назначения необходимо удалить из него все загрязняющие вещества, в том числе сивушные масла, которые являются побочными продуктами ферментации. При получении безводного к очищенному продукту добавляют вещества, разрушающие водно-этанольную азеотропную смесь. Этанол и азотообразующую компоненту отделяют друг от друга в следующей колонне. В стандартных условиях для производства безводного этанола требуется по крайней мере четырехкратная перегонка.
Этанол, предназначенный для использования в качестве топлива, не должен содержать воду [8]. Вместе с тем предполагается, что из такого этанола нет необходимости отделять сивушные масла. Поэтому перегонная система для получения этанола, предназначенного для использования в качестве топлива, включает «пивной перегонный куб» с ректификацией и колонны для азеотропной перегонки и отпарки. Спецификации на готовый продукт. Количество энергии, расходуемой на очистку этанола, определяет числа действующих колонн. В каждой колонне для поддержания заданного равновесия паров и жидкости над тарелками расходуется значительное количество тепловой энергии. Поэтому с энергетической точки зрения важное значение имеет спецификация на готовый продукт. В зависимости от спецификации и гибкости установки для производства более широкого ассортимента продуктов эксплуатационные расходы могут возрасти больше или меньше.
Глава 2. ЭКОЛОГИЧЕСКИЕ И ЭКОНОМИЧЕСКИЕ АСПЕКТЫ ПРОИЗВОДСТВА ЭТАНОЛА
Получение этанола — одно из крупнотоннажных промышленных производств основного (тяжелого) органического синтеза. При его изучении можно проследить основные тенденции технического прогресса в химической промышленности. Большие масштабы производства этанола предъявляют определенные требования к экономике производства, в первую очередь в решении проблемы выбора сырья (в себестоимости химической продукции доля сырья достигает 70 %) и рационального оформления технологического процесса. Кроме того, эти требования направлены на сокращение числа стадий производства; укрупнение единичных Мощностей аппаратов и установок в целом; повышение комплексности использования сырья; создание малоотходных технологических процессов; обеспечение необходимых мер по охране окружающей среды; максимальное внедрение на всех стадиях производства АСУ.
Этанол (метилкарбинол, этиловый, винный спирт) известен человеку с глубокой древности. Первые упоминания о нем относятся к VIII в. В арабских источниках (950 г.) описано получение водного этанола. В 1050—1150 гг. этанол получали ректификацией вина, в котором он образуется при брожении глюкозы, и использовали под названиями «aqua ardens» («вода горючая»), «aqua vitae («вода жизни»), «spiritus vinb («дух вина»). Последний термин удержался в фармакологии до настоящего времени,
С XIII в. этанол стали применять в медицине под названиями «мать», «государыня», «царица всех, лекарств». К 1440 г. относится исследование состава спирто-водных смесей (водки). С 1600 г. этанол используют в химических опытах для экстракции органических веществ. В книге А. Либавия «Алхимия» (1597) приведен проект химической лаборатории, в которой предусмотрен «винный погреб».
В 1682 г. И. Бехер впервые описал метод получения водного этанола (водки) из картофеля, а в 1748 г. он опубликовал сообщение Шведской академии наук о промышленном способе получения этанола из картофеля. Попытка получить в 1775 г. Т. Бергманом. Впервые безводный этанол получил Т. Е.Ловиц в 1796 г. В 1798 г. А. Арганд описал применение метода ректификации для перегонки этанола. Однако только в 1820 г. для этой цели была сконструирована промышленная ректификационная колонна.
В 1783 г. А. Лавуазье установил элементный состав этанола и попытался объяснить природу спиртового брожения. Окончательно химизм этого процесса был выяснен в XIX в. Исследование Д. И. Менделеевым в 1864 г. систем «этанол — вода» стало основой для разработки им гидратной (химической) теории растворов.
До 1934 г. в стране этанол получали исключительно из пищевого сырья. В 1934 г. было освоено производство этанола гидролизом древесины, а в 1935 г. построен первый гидролизный завод в Ленинграде. С 1930 г. в стране велись работы по получению этанола сернокислотной гидратацией этилене, ив 1936 г, вступил в строй опытный завод в Баку. Поиски технологического решения производства этанола методом прямой f-идратации этилена были прерваны войной. В 1952 г. поэтому методу началось освоение производства этанола в г. Сумгаите, а в период с 1953 по 1958 г. вошли в строй заводы в Саратове, Уфе, Грозном, Самаре.
В результате этих работ к 1960 г. доля синтетического этанола достигла уже 25 % в общем объеме его производства. В 1988 г. на основе этилена было получено 26,5 дал. этанола, что эквивалентно 2,7 млн. тонн картофеля или 0,86 млн. тонн зерна. Однако, несмотря на более низкую себестоимость -синтетического этанола, его доля в общем балансе продукции возрастала медленно. Так, в 1975 г. в СССР пищевой этанол составлял 60,0%, синтетический — 26,7%, гидролизный — 8,3%, в то время как в США уже в 1970 г. производство синтетического этанола достигло 83 %. С 1964 г. в стране было полностью прекращено использование для технических целей этанола, полученного из пищевого сырья, что отвечало решению общей задачи по сокращению доли пищевого сырья в сырьевом балансе химической промышленности.
Разработка промышленных методов производства этанола из этилена и гидролизом древесины позволила в свое время решить в стране важнейшую народнохозяйственную задачу по увеличению производства мономеров для синтетических каучуков (бутадиен-1,3) и переводу производства на дешевое непищевое сырье. В настоящее время перевод производства бутадиена на углеводородное сырье (бутана и бутилен-дивинильная фракция продуктов пиролиза) высвобождает значительное количество синтетического этанола. Его предполагается использовать как сырье для производства кормовых дрожжей — белковых добавок к кормам, по качеству значительно превосходящих кормовой белок из парафина, а само производство не будет столь вредным в экологическом аспекте. В этой связи экономически целесообразна схема производства, основывающаяся на этане природного газа, который у нас в настоящее время не находит должного применения и, как правило, его сжигают. Таким образом, значение технологического процесса получения синтетического этанола не только сохраняется, но и возрастает, так как потребность в этом продукте для указанной цели в 5—10 раз превышает уровень его современного производства.
В связи с этим гидролизные заводы переводят на производство кормовых дрожжей и производство гидролизного этанола прекращается.' Это в свою очередь вызывает необходимость вновь использовать часть мощностей по производству этанола из пищевого сырья для получения спирта высокой чистоты для специальных технических целей.
Этанол образует с водой азеотропную смесь (95,67 % этанола), кипящую при 78,15 °С, поэтому получение безводного (абсолютного) этанола требует специальных методов обезвоживания! Он обладает наркотическим действием (ПДК=1000 мг/м3).
Этанол относится к числу важнейших продуктов основного органического синтеза. Это сырье для производства ацетальдегида, хлороформа, диэтилового эфира, сложных эфиров органических кислот, пищевой уксусной кислоты, бутадиена, лекарственных препаратов. Его используют в качестве растворителя, антисептика, компонента моторных топлив, применяют в пищевой и парфюмерной промышленности. На основе разбавленных растворов этанола разработано производство кормовых дрожжей методы производства, этанола.
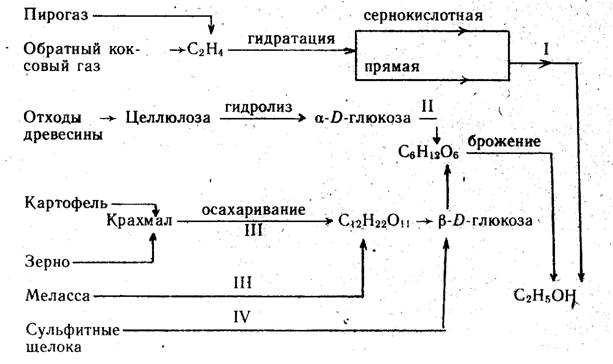
В основу классификации всех существующих промышленных методов производства этанола могут быть положены виды используемого сырья (углеводородные газы, древесина, пищевые продукты, отходы производства) и химизм превращений (гидратация, брожение), лежащих в основе технологических процессов (схема 1).
В соответствии с этой классификацией различают производства синтетического (I), гидролизного (II), ферментативного (пищевого) (III) и сульфитного (IV) этанола.
Выход этанола существенно зависит от вида сырья и составляет (в л на 1 т сырья): для этилена — 740, картофеля -г 93— 117, зерна — 185—361, мелассы — 270—300, древесины — 160—200, сульфитных щелоков — 90—110 (в расчете на 1 т древесины). При использовании в качестве сырья древесины и сульфитных щелоков помимо этанола образуются дрожжи, фурфурол, лигнин и лигниносульфонаты, гипс. Во всех вариантах биохимического метода производства этанола выделяется оксид углерода (IV).
В настоящее время синтетический этанол получают исключительно прямой гидратацией этилена. Метод сернокислотной гидратации сохранил значение только для производства изопропанола и бутанолов вследствие низкой экономичности процесса.
Производство этанола прямой гидратацией этилена
Этилен как сырье в этом методе производства этанола может быть выделен из пирогаза, полученного пиролизом низкооктанового бензина, из газов нефтепереработки или попутного газа, из этиленовой фракции обратного коксового газа (ОКГ), а также получен пиролизом этана (Схема 2).
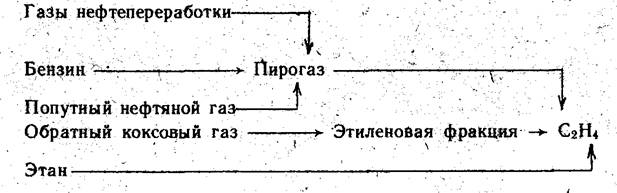
Основную массу этилена в настоящее время получают пиролизом нефтяного сырья, преимущественно бензина.
Физико-химические основы прямой гидратации этилена;
Из уравнения реакции следует, что равновесный выход этанола зависит от условий гидратации и растет с понижением температуры, повышением давления и увеличением мольного отношения воды и этилена.
Процесс гидратации катализируется кислыми и нейтральными катализаторами, среди которых наибольшее применение получила фосфорная кислота на носителе в виде кизельгура или силикагеля. В присутствии фосфорной Кислоты происходит электрофилыюе присоединение воды к этилену по схеме:
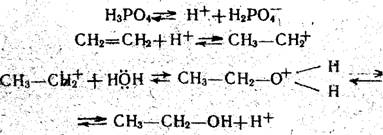
Катализ осуществляется свободной фосфорной кислотой, которая в жидком состоянии находится на поверхности зерен носителя. Таким образом, активность катализатора зависит от концентрации кислоты. При концентрации кислоты ниже. 83% активность катализатора резко падает. В свою очередь, концентрация кислоты зависит от парциального давления паров воды в системе и температуры. Поэтому, вопреки, требованиям термодинамики данного процесса, его нельзя вести при большом мольном отношении воды (пара) и, этилена, так как это снижает концентрацию кислоты, а следовательно, и активность катализатора. На практике это отношение' поддерживают в пределах (0,6-0,7):1.
Время работы катализатора — около 500 ч, после чего его активность падает, так как часть кислоты уносится током продуктов. Это вызывает необходимость непрерывного добавления фосфорной кислоты в процессе работы установки. При соблюдении этого условия и применении в качестве сырья газа с высоким содержанием этилена интенсивность катализатора составляет 180—200 кг этанола с 1 м3 катализатора в час. В качестве побочных продуктов при гидратации этилена образуются ацетальдегид, диэтиловый эфир и различные олигомеры.
Технологическая схема прямой гидратации этилена. В промышленности процесс гидратации может осуществляться- в двух вариантах: в жидкой и паровой фазах. На практике реализован, преимущественно второй вариант. В этом случае процесс ведут при температуре 290 °С и давлении 8 МПа, что позволяет обеспечить степень конверсии этилена за один проход до 6% при выходе этанола по этилену около 95 %.
Технологический процесс получения этанола прямой гидратацией этилена в паровой фазе строится по циклической схеме. В ней', предусмотрены приготовление, парогазовой смеси (этилен и водяной пар), пополнение потерь катализатора, нейтрализация уносимой с газовым потоком фосфорной кислоты, периодическая отдувка циркуляционного газа для удаления из него примесей и рациональный теплообмен с использованием теплоты реакции гидратации.
Парогазовую смесь готовят совместным нагреванием паров воды и этилена в теплообменниках и трубчатой печи или смешением этилена с перегретым паром высокого давления.
В промышленном масштабе реализованы обе схемы, однако вторая, используемая в нашей' стране, экономически целесообразна при наличии ТЭЦ вблизи производства этанола, В последнее время для приготовления парогазовой смеси вместо пара высокого давления рекомендуют использовать рецикловую воду и паровой конденсат.
На рис. 1 приведена схема гидратации этилена в паровой фазе.
Вводимый этилен сжимают в компрессоре 1до 8 МПа и смешивают с циркуляционным газом. Так как давление циркуляционного газа ниже, чем этилена (объем газа уменьшился за счет образования этанола), его дополнительно сжимают в компрессоре 2. Смесь свежего этилена с циркуляционным, газом подогревают до 300 °С в теплообменнике 3 продуктами реакции и смешивают с перегретым да 450 °С паром при давлении 8 МПа. Парогазовая смесь поступает в гидрататор 4. Гидрататор выполнен в виде реактора идеального вытеснения ~ (РИВ-Н) представляет собой стальной цилиндр диаметром 1,5 м и высотой 10 м; футерованный изнутри медью и наполненный катализатором, насыпанным на перфорированный конус
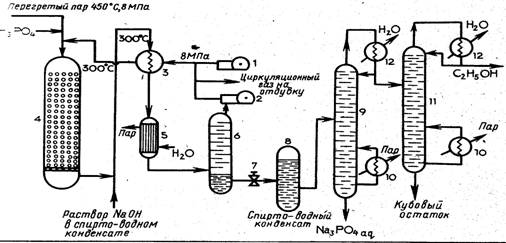
Рис. 1. Схема гидратации этилена в паровой фазе:
1 — компрессор этилена; 2 — компрессор циркуляционного; 3 — теплообменник; 4—гидрататор; 5—котел-утилизатор
На выходе из гидрататора смесь этанола, водяного пара и непрореагировавшего этилена обрабатывают водным раствором гидроксида натрия для нейтрализации унесенной потоком фосфорной кислоты, охлаждают в теплообменнике 3 и направляют в котел-утилизатор 5, в котором вырабатывается пар низкого давления, поступающий затем в пароперегреватель.
Из котла-утилизатора продукты поступают в сепаратор (газоотделитель) высокого давления 6. Здесь отделяется циркуляционный газ, направляемый в компрессор 2, а спирто-водный конденсат с содержанием этанола до 15 % дросселируют через редукционный вентиль 7 до давления 0,5—0,6 МПа и направляют в сепаратор (сборник) низкого давления 8. В сборнике за счет снижения давления выделяется растворенный в конденсате этилен, который добавляют к циркуляционному газу.
Из сепаратора-сборника 8 спирто-водный конденсат поступает в отпарную ректификационную колонну 9. Здесь за счет нагревания жидкости паром через кипятильник 10 и ректификации смеси происходит отделение паров этанола, загрязненных примесями, от водного раствора фосфата натрия. Из колонны 9 этанол направляют в ректификационную колонну. После ректификации получают очищенный этанол-ректификат, содержащий ацетальдегид (до 2 %) и диэтиловый эфир (не более 1 %).
Последующая очистка синтетического этанола и требования к нему зависят от области использования этанола. Производительность современных установок прямой гидратации этилена достигает 30 тыс. тонн этанола в год.
Производство этанола гидролизом древесины
Гидролизное производство. Производство этанола из древесного сырья представляет собой частный случай гидролизного производства, т. е. производства, основанного на химической переработке растительных материалов путем каталитического превращения содержащихся в них полисахаридов в моносахариды. При этом непищевое растительное сырье (отходы древесины, подсолнечная лузга, кукурузные кочерыжки и др.) может быть превращено в пищевые, кормовые и технические продукты. Из образующихся в результате гидролиза этих полисахаридов водных растворов моносахаридов (гидролизатов) кристаллизацией получают пищевую глюкозу и техническую ксилозу; гидрированием — ксилит и сорбит; дегидратацией — фурфурол; окислением — органические кислоты; микробиологической переработкой — этанол, бутанол, ацетон, кормовые дрожжи, антибиотики.
Из лигнина, остающегося после отделения гидролизата, термической обработкой получают активированный уголь, уксусную кислоту и фенол; химической переработкой — активированный лигнин и щавелевую кислоту; прессованием — строительные материалы.
Процесс гидролиза растительных материалов, как пример малоотходного производства, представлен на схеме 3.
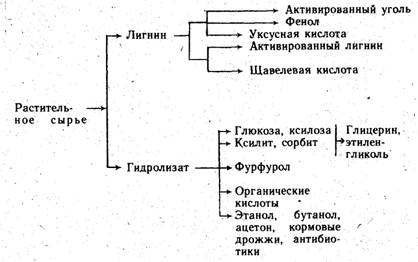
В зависимости от природы целевых продуктов гидролизное производство строится по той или иной технологической схеме. При этом, если в качестве сырья используют древесные отходы, то из 1 т абсолютно сухой древесины может быть получено 220 кг кормовых дрожжей, или 35 кг дрожжей и 175 л этанола, или 110 кг дрожжей и 80 кг фурфурола.
Физико-химические основы производства гидролизного этанола. Наиболее распространенное сырье для производства гидролизного этанола — древесина — представляет собой сложную систему, состоящую из целлюлозы, гемицеллюлоз, лигнина, а также небольших количеств смол, эфирных масел, дубильных и красящих веществ. Элементный состав органической части древесины практически постоянен: углерод — 49—51 %, Водород — 6,1—6,9 %, кислород — 43—45 %, азот — 1 %. В то же время содержание целлюлозы, лигнина и гемицеллюлоз зависит от природы древесины. В среднем в сухой древесине хвойных пород, используемой для производства этанола, содержится 52—58 % целлюлозы, 28—29 % лигнина и около 20 % гемицеллюлоз. Гемицеллюлозы — это олигомеры различной степени нолимеризации, состоящие из пентозанов и гексозанов (С6Н1005)п. Пентозаны построены из остатков, моносахаридов ксилозы и арабинозы, гексозаны — из остатков моносахаридов маннозы, галактозы, фруктозы и глюкозы.
Гидролиз древесины — каталитический процесс взаимодействия полисахаридов (целлюлозы, пентозанов и гексозанов гемицеллюлоз) с водой. При этом они превращаются в соответствующие моносахариды: ксилозу, a-D-глюкозу и т. д., например:
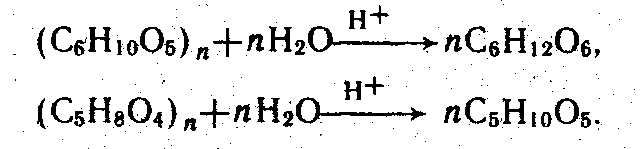
Катализаторы процесса гидролиза —концентрированные и разбавленные кислоты или кислые соли. При этом скорость гидролиза возрастает с увеличением константы диссоциации кислоты, ее концентрации и при повышении температуры гидролизата существенно зависят от природы катализатора. Гидролиз в присутствии разбавленной серной кислоты (0,4—0,7 %-ной) проводят при температуре 120—190 "С и давлении 0,6—1,2 МПа. В результате получают гидролизат, загрязненный фурфуролом, органическими кислотами и другими веществами. Это объясняется тем, что параллельно с гидролизом протекают реакции разложения образовавшихся моносахаридов, скорость которых с повышением температуры также возрастает. Поэтому, несмотря на то что константа скорости реакции гидролиза больше константы скорости реакции разложения, выход гексоз в этом Случае не превышает 70 % от теоретически возможного при степени гидролиза около 90%. Гидролиз в присутствии концентрированных кислот (70— 80 %-ной серной кислоты или 31—41 %-ной соляной кислоты) проводят при температуре не выше 60 "С и атмосферном давлении. Он дает чистый гидролизат с выходом моносахаридов до 95% от теоретически возможного.
Брожение (ферментация) процесс разложения углеводов под воздействием микроорганизмов или выделенных из них ферментов. В производстве этанола используют одну из разновидностей брожения — спиртовое брожение, вызываемое ферментом зимазой, содержащимся в дрожжевых клетках. Из моносахаридов спиртовому брожению подвергаются только гексозы. Процесс спиртового брожения, a-D-глюкозы, составляющей структурную единицу целлюлозы, происходит без доступа кислорода (анаэробное брожение) и включает ряд стадий с участием фосфорорганических соединений. В результате сложных превращений из глюкозы образуется этанол.
Параметры процесса брожения выбирают, исходя из оптимальных условий развития дрожжевых клеток и подавления развития их спутников — кислотообразующих бактерий молочнокислого и уксуснокислого брожения.
Так как оптимальные температуры размножения дрожжевых клеток практически совпадают и равны 35— 50 °С, то подавить развитие бактерий изменением температуры нельзя. Для этого повышают кислотность среды, вводя в гидролизат серную или молочную кислоту. При рН 4,2 дрожжевые клетки интенсивно растут, а бактерии не размножаются. Поэтому на практике процесс брожения проводят при температуре 27 С, атмосферном давлении и в кислой среде (рН= =3,8—4,0).
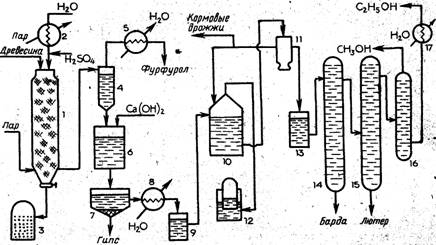
Технологическая схема производства этанола гидролизом древесины. Процесс производства этанола складывается из двух последовательных стадий; объединенных в единую технологическую схему: гидролиза древесины и сбраживания образующегося гидролизата. В нашей стране распространен метод гидролиза древесины разбавленной серной кислотой. В качестве сырья используют отходы хвойной древесины с высоким содержанием гексозанов.
Производство этанола по этой схеме представляет собой полунепрерывный перколяциоиный процесс, в основе которого лежит принцип: непрерывной фильтрации раствора кислоты через периодически загружаемое в реактор древесное сырье с непрерывным в течение нескольких часов отбором гидролизата.. При этом раствор кислоты служит одновременно экстрагентом образующихся при гидролизе моносахаридов. Схема производства этанола гидролизом древесины приведена на рис. 2.
Древесное сырье в виде опилок или измельченной щепы загружают в гидролиз-аппарат 1 — цилиндрический стальной сосуд, футерованный внутри кислотоупорным материалом. После загрузки сырья в аппарат через специальное оросительное устройство подают нагретый до 1$0—190 °С раствор серной кислоты концентрацией около 0,5 %. Воду для получения раствора кислоты подогревают в подогревателе 2. В гидролиз-аппарат вводят также пар и создают давление 1,0—1,2 МПа. Через фильтрующее устройство, расположенное в нижней части гидролиз-аппарата и выполненное в виде перфорированных медных трубок, из аппарата непрерывно отводят гидролизат и направляют его в испаритель 4. Вследствие снижения давления гидролизат вскипает и пары, содержащие фурфурол (tKHn= 161,7 °С при атмосферном давлении), поступают в конденсатор 5. Цикл непрерывной работы гидролиз-аппарата от загрузки до выгрузки составляет несколько часов, затем оставшийся в нем лигнин передавливают после открытия заслонки в сборник после этого в аппарат загружают новую порцию древесного сырья.
После отделения фурфурола гидролизат из испарителя поступает в нейтрализатор 6, куда подают раствор гидроксида кальция, а оттуда —
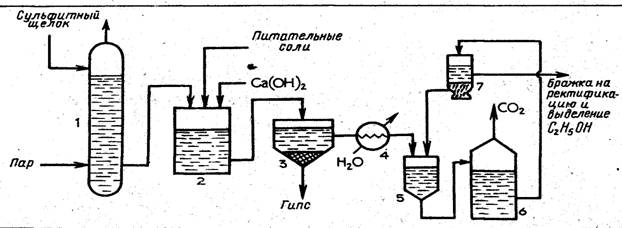
Сульфитный щелок подают в колонну /, где из него паром выдувают примеси. Очищенный щелок поступает в нейтрализатор 2, куда подают раствор гидроксида кальция и вводят питательные соли. Из нейтрализатора щелок после охлаждения до 30 °С в холодильнике 4 направляют сначала на первую ступень брожения в дрожжанку 5, а затем на вторую ступень брожения в бродильный чан 6 и в. сепаратор 7. В сепараторе дрожжи отделяются от образовавшейся бражки, и их возвращают в дрожжанку. После сепаратора бражку, содержащую 1,0— 1,2 % спирта, направляют на концентрирование и выделение этанола аналогично тому, как это происходит в производстве гидролизного этанола (см. рис. 2).
Переработкой сульфитных щелоков можно получить (в расчете на 1 т воздушно-сухой древесины) 90—110 л этанола, 40—50 кг белковых дрожжей, 600—700 кг сухих лигносульфонатов.
Комплексная переработка сульфитных щелоков имеет и большое значение в экологическом плане. Существующие промышленные способы производства целлюлозы не обеспечивают полной утилизации и переработки его отходов — варочных сульфитных щелоков и отдувочных газов. Вследствие этого целлюлозно-бумажная промышленность в настоящее время — одна из основных источников загрязнения водоемов сточными водами.
этанол урок одноатомный спирт
Глава 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «СПИРТЫ»
Система уроков по теме: "Предельные одноатомные спирты"
Пояснительная записка.
Все классы органических соединений преподаю блоками. Блок состоит из трех частей:
1. урок-лекция,
2. тренировочные домашние упражнения,
3. урок-коррекция.
Урок-лекция (объяснение нового материала).
Цели:
- ввести понятие предельных одноатомных спиртов, свойств;
- развитие интереса, умения выделять главное, научить сравнивать и анализировать.
1. Определение.
Органические соединения, которые состоят из предельного углеводородного радикала и содержат одну функциональную гидроксильную группу (-ОН), называются насыщенными одноатомными спиртами.
Общая
формула СnН2n+1ОН ( где n![]() 1) или R – ОН
1) или R – ОН
2. Гомологический ряд и номенклатура
СН3 ОН – метиловый спирт (метанол),
СН3 СН2ОН – этиловый спирт (этанол)….
- СН2 - гомологическая разница
Пример: 3-метилгексанол – 1
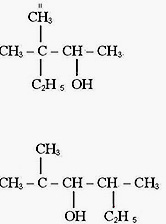
2. Изомерия положения функциональной группы (-ОН)
Пример: бутанол-1 -> бутанол-2
3. Изомерия между классами (предельные одноатомные спирты изомерны простым эфирам)
4. Физические свойства
1) Спирты от С1 до С11 – жидкости, от С12 до С - твердые.
2) Легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют.
3) Низшие спирты (до пропилового) смешиваются с водой в любых отношениях. Высшие спирты практически нерастворимы в воде.
Межмолекулярная водородная связь возможна между отдельными молекулами спирта и между молекулами спирта и воды. Это влияет на физические свойства спиртов: повышает температуру кипения, снижает летучесть, способствует хорошей растворимости в воде, не позволяет перегонкой получить 100% спирт из его водного раствора.
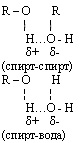
5. Химические свойства (с примерами):
1) горение,
2) взаимодействие с активными металлами;
3) взаимодействие с органическими кислотами, с неорганическими кислотами;
4) с галогеноводородами;
5) окисление
- первичный спирт -> альдегид,
- вторичный спирт -> кетон,
- третичный спирт: тяжело окисляется с разрывом С-С связи;
6) дегидратация:
- внутримолекулярная,
- межмолекулярная с образованием простых эфиров;
7) дегидратация и дегидрирование (реакция Лебедева).
6. Получение одноатомных спиртов (с примерами).
В промышленности:
1) получение СН3 ОН
- из синтез-газа
- во время сухой перегонки древесины (древесный спирт),
2) гидратация алкенов,
3) брожение сахаристых веществ.
В лаборатории:
1) из алканов через галогенопроизводные,
2) восстановление альдегидов.
Физиологическое действие спиртов на организм негативно.
СН3 ОН – сильный яд! В малых количествах вызывает слепоту, в больших – приводит к смерти.
С2Н5ОН – наркотик. Под влиянием этанола у человека ослабляется внимание, затормаживается реакция, нарушается корреляция движений. При продолжительном употреблении вызывает глубокие нарушения нервной системы, заболевания сердечно-сосудистой системы, пищеварительного тракта, наступает тяжелая болезнь – алкоголизм.
7. Применение спиртов.
1) Метанол:
- в промышленном органическом синтезе (производство формальдегида),
- как растворитель,
- как добавка к бензину.
2) Этанол:
- производство уксусной кислоты,
- как растворитель,
- в парфюмерии,
- в медицине,
- как топливо,
- в пищевой промышленности.
8. Связь между ациклическими углеводородами и спиртами (показать на примерах).
Домашнее задание: пар. 17 (учебник О.С. Габриелян), тренировочные упражнения.
Приложение 1. Закрепление (если позволяет время)
1. Назвать по международной номенклатуре (2-4 примера).
2. Написать структурные формулы изомерных спиртов С4Н9 ОН и назвать их.
Приложение 2. Тренировочные домашние упражнения.
Тема: “Одноатомные спирты”.
Сложность 1 (оценка “удовлетворительно”).
1. Написать структурные формулы следующих соединений: 2-метилпентанол-1; 2,3-диметилбутанол-2; 2-метилпентен-1-ол-3.
2. Назвать вещество и написать два его гомолога и два изомера
1. Какой объем водорода выделится при взаимодействии 19,5 г калия с этанолом.
Сложность 2 (оценка “хорошо”).
1. Чем объясняется изомерия спиртов? Пояснить это на примере спирта, в молекуле которого четыре атома углерода. Назвать каждый изомер.
2. Написать реакции получения метанола.
3. Осуществить превращения:
Этан -> бромэтан-> этен-> этанол-> метилэтиловый эфир. Где происходит дегиратация?
4. При сжигании 4,8 г органического вещества образовалось 3,36 л оксида углерода (IV) и 5,4 г воды. Плотность паров этого вещества по метану 2. Определить формулу вещества.
Сложность 3 (оценка “отлично”).
1. Чем отличаются первичные, вторичные и третичные спирты? (Привести примеры каждого и назвать их)
2. Предложить схему получения из пропана пропанол-1.
3. Осуществить превращения (предложить две цепочки).
4. При межмолекулярной дегидратации 100г одноатомного предельного спирта неизвестного строения выделилось 21,09 г воды и выход продукта реакции составил 75% от теоретического. Определить строение спирта.
Урок-коррекция.
1 этап. 10-15 минут. Учащиеся задают вопросы по тренировочным упражнениям.
2 этап. 20-30 минут. Самостоятельная работа. Работа разноуровневая. Учащиеся выбирают любой вариант.
Самостоятельная работа (тема: “Одноатомные спирты”).
Оценка “удовлетворительно”
| Вариант 1 | Вариант 2 |
|
1. Какие вещества называют спиртами? (привести примеры). 2. Какие спирты образуются в результате гидратации следующих веществ: этена, бутена-2. 3. Осуществить превращения: 1)С2Н 5 ОН->С2Н 4 ->С2Н 5 Cl->С2Н5 ОН 2)ацетилен- >А-> этанол 4. При взаимодействии 12,8 г спирта с натрием образовалось 4,48 л водорода. Какой это спирт? |
1. Написать общую формулу спиртов. Что такое функциональная группа? 2. Написать уравнение гидролиза водным раствором щелочи следующих соединений: хлорэтана, 2-хлорбутана. 3. Осуществить превращения: 1)СН 4 -> С2Н 2 -> С2Н 4 -> С2Н 5 ОН 2)этанол -> А-> этан 4. При дегидратации 12 г спирта образовался алкен и 3,6 г воды. Какой это спирт? |
Оценка “хорошо”
| Вариант 3 | Вариант 4 |
|
1. Объяснить образование водородных связей между молекулами спирта и влияние на физические свойства. 2. Как получить спирты из алкенов (привести два примера). 3. Осуществить превращение: оксид углерода (IV) – метанол – хлорметан – этан – углекислый газ. 4. Найти молекулярную массу вещества А: пропанол-1 – А - пропанол-2 5. 0,5 моль метанола нагрели с KBr и H2SO4 и получили 38 г бромметана. Найти выход бромметана |
1. Как доказать, что спирты отравляюще и пагубно действуют на организм человека. 2. Дописать уравнения и назвать вещества. 1. СН 3 – CHCl - СН 2 - СН 3 + КОН(водн) 2. СН 3 – CHCl - СН 2 - СН 3 + КОН(спирт) 1. Осуществить превращения: метан – этан – этен – этанол – углекислый газ 2. Определить молекулярную массу вещества А: этанол – А – 1,2-дихлорэтан. 3. Какая масса этилата натрия получится при взаимодействии этанола массой 11,5 г с натрием массой 9,2 г? |
Оценка “отлично”
| Вариант 5 | Вариант 6 |
|
1. Почему температура кипения спиртов намного выше, чем соответствующих углеводородов? 2. Сколько изомерных бутиловых спиртов может образоваться из изомерных алкенов С4Н 8 при их гидратации? 3. Написать уравнения реакций, в результате которых можно получить из метана бутадиен-1,3. 4. Метанол массой 2,04 кг получили взаимодействием оксида углерода (11) объемом 2 м3 с водородом объемом 5 м3 (ну). Найти выход продукта реакции. 5. Определить массу пропанола-2, взятого для реакции, если во время дегидратации пропанола-2 получили пропен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%. |
1. Почему нельзя физическими методами получить 100%-ный этанол из его водного раствора? 2. Сколько изомерных третичных спиртов имеют состав .С6Н13 ОН ? Написать формулы и назвать . 3. Написать уравнения реакций, в результате которых можно получить из метана диэтиловый эфир. 4. Какую массу бутадиена-1,3 можно получить из спирта объемом 230 л и плотностью 0,8 кг/л, если массовая доля этанола в спирте 95%? Выход продукта реакции составляет 60%. 5. Вычислить массу добытого продукта, если выход на обеих стадиях синтеза составляет по 60%, если известно, что из пропанола-2 массой 24 г добыт 2-бромпропан, из которого синтезировали 2,3-диметилбутан. |
Химические свойства спиртов
Одноатомные спирты не обладают ни щелочными, ни кислотными свойствами. Водные растворы спиртов на индикаторы не действуют.
Рассмотрим химические свойства спиртов на примере этанола. В молекуле этилового спирта СН3–СН2–ОН имеется четыре типа химических связей, различающихся полярностью: 1) Н–О;
2) С–О; 3) С–Н; 4) С–С. В результате химических превращений разрываются наиболее полярные связи Н–О, С–О и С–Н. Неполярная связь С–С в реакциях спиртов не разрывается.
1. Разрыв связи Н–О в реакции с натрием:
![]()
2. Одновременный разрыв связей Н–О и С–Н, находящихся при спиртовом атоме углерода, под действием окислителя (CuO) с отщеплением молекулы Н2О и образованием альдегида (СН3СНО):
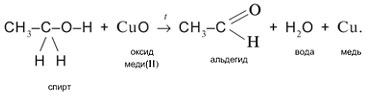
2.
Разрыв
связи ![]() под действием
нуклеофильных реагентов (ионов В– или молекул с неравномерным
распределением заряда в молекуле
под действием
нуклеофильных реагентов (ионов В– или молекул с неравномерным
распределением заряда в молекуле ![]() ) в кислой среде.
) в кислой среде.
3. а) Действие кислот НСl или НВr с образованием галогеналканов:
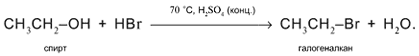
б) Действие кислородсодержащих кислот – неорганических и органических – с образованием сложных эфиров (подробнее см. урок 29):
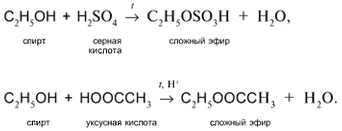
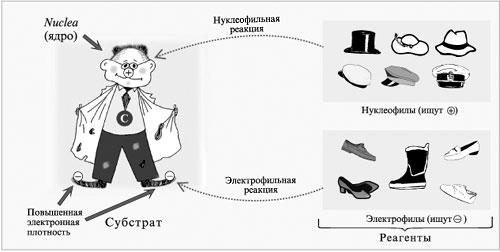
Модель нуклеофильного и электрофильного процессов
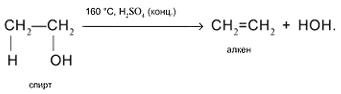
4. Внутримолекулярное отщепление Н и ОН от соседних атомов С в присутствии концентрированной серной кислоты при нагревании с образованием алкена:
5. Межмолекулярное отщепление Н и ОН от двух разных молекул спирта при умеренном нагревании в присутствии дегидратирующих агентов. Продукт реакции – простой эфир:
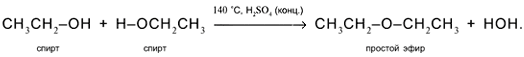
6. Спирты горят на воздухе с расщеплением всех связей и образованием углекислого газа и воды:
С2Н5ОН
+ 3О2 ![]() 2СО2 + 3Н2О.
2СО2 + 3Н2О.
Задача. Составьте уравнения реакций пропанола-1 СН3СН2СН2ОН со следующими реагентами: а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
Решение
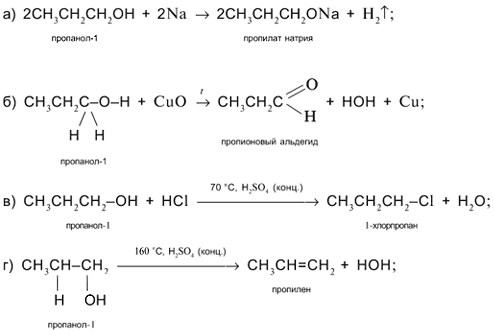
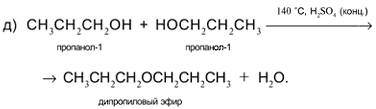
1. Составьте уравнения реакций пропанола-2 СН3СН(ОН)СН3 со следующими реагентами:
а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
2. Алюминий реагирует со спиртами подобно натрию. При этом происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2. Реакция протекает при нагревании около температуры кипения спирта. Составьте уравнения реакций металлического алюминия со спиртами: а) метанолом; б) этанолом.
3. Почему температуры кипения спиртов выше, чем у соответствующих по молекулярной массе углеводородов (С2Н5ОН, Мr = 46, tкип = 78 °С; С3Н8, Мr = 44, tкип = –42 °С)?
4. Напишите схему реакций, с помощью которых пропанол-1 можно превратить в пропанол-2.
Из спиртов ROH получают соединения многих других классов: алкилгалогениды RHal, алкены R'СН=СН2, простые эфиры RОR', сложные эфиры R'СООR, альдегиды R'СНО, карбоновые кислоты R'СООН и т.д. Спирты используют в качестве растворителей при синтезе новых соединений, производстве лаков и красок, фармацевтических препаратов, душистых веществ, парфюмерно-косметической продукции. Этанол используют как дезинфицирующее средство, горючее в двигателях. Он идет также на изготовление алкогольных напитков.
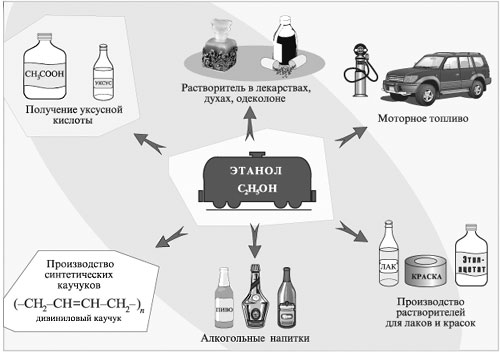
Применение этилового спирта
Для прочного усвоения знаний по химии надо овладеть умением составлять и решать цепочки химических превращений. Решить цепочку – это значит записать уравнения реакций, соответствующие каждой стрелке схемы. В результате удается из имеющихся в наличии веществ получать новые необходимые вещества. Для решения цепочек необходимо знать:
а) способы получения веществ и б) химические свойства веществ различных классов.
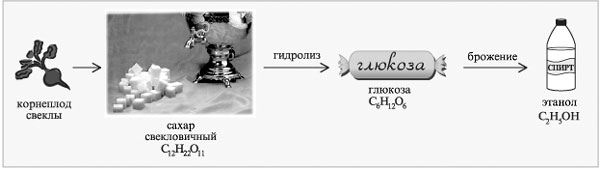
Пример цепочки химических превращений в производстве этанола
Задача. Составьте уравнения реакций для цепочки превращений:
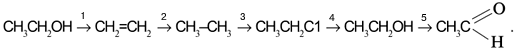
Решение
Воспользуемся удобным способом, помогающим определять реагенты, требуемые для превращения одного вещества в другое: будем находить отличие в составе двух веществ, стоящих по разные стороны от стрелки, и из химической формулы с большим числом атомов вычитать формулу с меньшим числом атомов. Так, для первой стрелки схемы:
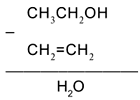
Следовательно, чтобы превратить спирт СН3СН2ОН в алкен СН2=СН2, надо отщепить молекулу воды от молекулы спирта:
Вторая реакция схемы состоит в присоединении водорода к алкену:
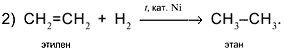
Третья стрелка схемы представляет реакцию замещения водорода в алкане СН3–СН3 на хлор. Это достигается действием молекулярного хлора на алкан:
![]()
Четвертое превращение – замещение атома хлора в хлорэтане С2Н5Сl на гидроксильную группу ОН:
![]()
Пятая реакция заключается в отщеплении двух атомов водорода от молекулы спирта. На практике это означает окисление спирта кислородом [O] окислителя, т.е. связывание избыточных атомов Н в форме Н2О:
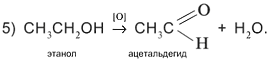
ЛИТЕРАТУРА
1. О.В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47.
2. Ахметов Н.С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18.
3. Ахметов Н.С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
5. Материалы сайта www.1september.ru
6. О.С. Габриелян, Н.П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
7. Малинин К.М. Технология серной кислоты и серы. М., Л., 1994.
8. Васильев Б.Г., Отвагина М.И. Технология серной кислоты. М., 1985.
9. Отвагина М.И., Явор В.И., Сретенская Н.С., Шарифов М.Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4.
10. Резницкий И.Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4.
11. Березина Л.Т., Борисова С.И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12.
12. Громов А.П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12.
13. Лидин Р.А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70.
14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А.А. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
15. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
16. Р.П. Суровцева, С.В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.