
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Контрольная работа: Соответствие лекарственного вещества показателям мутности. Условия титрования
Контрольная работа: Соответствие лекарственного вещества показателям мутности. Условия титрования
КОНТРОЛЬНАЯ РАБОТА ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ №1
Вопрос 9
Какие жидкости по ГФ считаются прозрачными? В ФС на резорцин указано, что 1 г резорцина растворяют в 20 мл свежепрокипяченной и охлажденной воды. Полученный раствор по степени мутности не должен превышать эталон 1. Как проверить соответствие лекарственного вещества требованиям ГФ по этому показателю?
Прозрачность и степень мутности жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталонами.
Испытание проводят при освещении электрической лампой матового стекла мощностью 40 Вт на черном фоне при вертикальном положении пробирок (смотрят СБОКУ).
Эталоны - это взвеси из гидразина сульфата и гексаметилентетрамина. Эти взвеси готовят путем растворения вышеназванных веществ в воде, а потом их оставляют на несколько часов или даже дней настояться.
Эталоны для сравнения приготавливают из основных растворов путем разбавления их раствором серной кислоты (0,1 моль/л). Эталоны следует хранить по 5 мл в бесцветных, герметически укупоренных пробирках или запаянных ампулах вместимостью 5 мл в защищенном от света месте.
Срок годности эталонов № 1, 2, 3, 4 — 4 дня.
Соответствие резорцина требованиям ГФ Резорцина (ГФ Х, ст. ФС 42-2048-93 577) 10 г или 20 г Натрия пиросернистокислого (метабисульфита натрия) (ГОСТ 10575-76 или ГОСТ 11683-76, сорт
1) 1 г Спирта этилового 70% (ФС 42-3071-94) до 1000 мл Резорцина 1% и 2% Резорцина (ГФ Х, ст. Резорцина (ГФ Резорцина (ГФ Х, ст. ФС 42-2048-93 577) 10 г или 20 г Натрия пиросернистокислого (метабисульфита натрия) (ГОСТ 10575-76 или ГОСТ 11683-76, сорт 1) 1 г Спирта этилового 70% (ФС 42-3071-94) до 1000 мл 577) 10 г или 20 г Натрия пиросернистокислого (метабисульфита натрия) (ГОСТ 10575-76 или ГОСТ 11683-76, сорт 1) 1 г Спирта этилового 70% (ФС 42-3071-94) до 1000 мл ФС 42-2048-93
Определение степени мутности окрашенных жидкостей производят в компараторе. Часть испытуемой жидкости фильтруют через бумажный фильтр; в компараторе помещают рядом пробирки с фильтрованной и нефильтрованной жидкостями; позади пробирки с нефильтрованной жидкостью ставят пробирку с растворителем, позади пробирки с фильтрованной жидкостью помещают последовательно пробирки с соответствующими эталонами мутности до появления мути, сходной с мутью нефильтрованной жидкости. Пробирки просматривают при подсвечивании электрической лампы в 40 Вт.
Вопрос 18
Рассчитать содержание ионов аммония в 1 л раствора Б , если 0,1256 г хлорида аммония растворяют в воде в мерной колбе , вместимостью 500 мл и доводят водой до метки (раствор А) . 5 мл раствора А помещают в мерную колбу вместимостью 500 мл и доводят водой до метки (раствор Б).
1 мл раствора соли аммония (0,002—0,006 г иона аммония) нагревают с 0,5 мл раствора едкого натра
NH4Cl + NaOH NH3 + NaCl + H2O
Выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги
Содержание NH+4 находят по калибровочному графику, учитывая сделанные разбавления. Для построения калибровочного графика в мерные колбы вместимостью 50 мл наливают 0, 1, 2, 3, 4, 5, 6, 8, 10 и 12 мл рабочего стандартного раствора хлорида аммония и доводят каждый раствор до метки безаммиачной водой, концентрации NH+4 в полученных растворах равны соответственно 0; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,8; 1,0 и 1,2 мг/л. Эти растворы обрабатываются и по результатам измерения оптической плотности строят калибровочный график.
Вопрос 59
Привести уравнения химических реакций, подтверждающих амфотерные свойства алифатических аминокислот
Самым простым методом синтеза всех аминокислот, казалось бы, должен являться метод, основанный на реакции между а-галоидными производными кислот и аммиаком.
R—СН—COOH + NHa R—СН—C001i+NH4C1
I I
CI NH2
Наряду с аминокислотой образуется некоторое количество аминокислоты. Во избежание этой вторичной реакции приходится брать аммиак в большом избытке, или же проводить синтез по измененному методу Чирониса, заключающемуся в том, что в реакции применяют углекислый аммоний. Образующееся карбаминовое производное аминокислоты не вступает в дальнейшую реакцию.
R—СН—COOH+(NH4)» CCv^R-CH-COOH
I I л
Cl NHCOOH
Можно также пользоваться методом Габриэля и действовать на а-галоидокислоту фталимидом калия. Последующим гидролизом или обработкой гидразином или фенилгидразином получают аминокислоты.
СО СО
С6Н4 NK+RCH—СООН - С6Н4 NCH (R) СООН
\/ I \/
СО Cl СО (I)
н2о
I > С6Н4 (COOH)2+NH2CH (R) СООН
NH2NH, /
I » С6Н4
CO-NH
СО—NH
+ NH2CH (R) СООН
До самого последнего времени легко доступными а-галоидопроизводными были только производные алифатических кислот. Поэтому этот метод широко использовался только для синтеза глицина, аланина, валина, лейцина и их изомеров.
В 1956 г. А. Н. Несмеянов и P. X. Фрейдлина разработали новый метод синтеза со- и а-галоидных кислот на базе реакции теломеризации и тем самым сделали доступными как а-, так и о-моно- и полигалоидные органические кислоты. Последовательность происходящих радикальноцепных реакций может быть изображена следующей схемой:
СС14— С1 + СС13.; СС13- 4-СН2=СН2^СС13—СН2—СН2-CCI3CH2—СН2?-j-CHa=CH2 —* CC13CH2CH2GH2CH2« СС1зСНгСН2СН2СНа-+СС14-> СС13СН2СНаСН2СН2С14-СС13- и т. д.
Рост цепи прерывается при взаимодействии с СС14. Тетрахлоралкан и трихлоралкан под действием безводного хлорного железа, хлористого алюминия или хлористой сурьмы уже при комнатной температуре отщепляют хлористый водород с образованием дихлорвиниловых производных.
FeC[3
С1СН2СН2СНаСН2СС1з ? С1СН3СН2СН2СН-СС12
FeCl,
СНзСН2СН2СН2СС13 > СНзСН2СН2СН=СС12
Последние в концентрированной серной кислоте при 0—20° хлорируются до а- со- дихлор- и а-хлоралифатических кислот.
си
CICH2CH2CH2CH=CC12 v С1СН2СН2СН2—сн—соон
HAS04 |
С1
СНзСН2СН2СН=СС12 v СН3СН3СН2-СН—соон
H2SO* |
С1
Аминирование галоидных производных кислот получают затем с высокими выходами самые различные алифатические, ароматические и гетероциклические аминокислоты. Можно полагать, что метод аминирования галоидопроизводных кислот вновь займет доминирующее положение среди других методов синтеза.
В настоящее время наибольшее значение имеют методы, основанные на реакциях с малоновым или циануксусным эфирами и в меньшей степени— с ацетоуксусным эфиром.
Применение малонового эфира для синтеза аминокислот было предложено еще в 1904 г. Э. Фишером. Ниже приводится схема синтеза -аминокислот по Фишеру.
СООН (R) СООН (R) СООН (R)
) 1 Вг, | Н20
HCNa+C6H&CH2Br -» НС—СН2С6Н5 ВгС-СН2С6Н5 > СвН&СН2СН—СООН^
111 1
СООН
(R) СООН (R) СООН (R) Вг
—> С6Н5СН8СН (NH2) СООН
Метод интересен сейчас лишь с исторической точки зрения
Из значительного числа вариантов этой реакции в настоящее время •широкое применение получил так называемый синтез с помощью ацетиламиномалонового эфира. Малоновый эфир подвергают нитрозированию. Нитрозомалоновый эфир восстанавливают каталитически (нал Pel, Ni) или цинком в уксуснокислой среде до аминомалонового эфира; последний представляет собою очень нестойкое соединение, поэтому аминогруппу защищают ацильным остатком. Из разнообразных ацильных групп, применявшихся для этой цели (фталильной, бензоильной, ацетильной и формильной), наибольшее значение получила ацетильная. Ацетил а мшюмалоновый эфир представляет собою устойчивое соединение, которое применяют для синтеза самых разнообразных аминокислот. Действием натрия и галоидалкила с последующим частичным омылением и декарбоксилированием получают аминокислоты
ROOC—СН2—COOR+C4H9ONO -* ROOC—С—COOR —-* ROOC—СН—COOR
1) I
NOH NH3
(СН3СО)4 О Na; RBr; НгО
v ROOC—СН—COOR > R—СН—СООН
I I
NHCOCH3 NHa
Из приведенных схем синтеза различных аминокислот следует, что этот метод пригоден для синтеза всех известных аминокислот. Наряду с галоидалкилами стали широко использовать акролеин, эфиры акриловой кислоты и акрилонитрил, что позволило одновременно вводить радикалы и новые функциональные группы.
(COOR)2 II
СН2=СН~СОН COOR НСО—СН2—СН2—С—NHCOCH3
I 7
CH2=CH-COOR + HC-NHCOCHj - ROOC—СН2-СН2-С—NHCOCH3
I \ il
COOR \ (COOR)2
CHa=CH—CN NC-CH2—CH2—C—NHCOCH3
II
(COOR)2
Использование реакции Манниха еще более расширило рамки применения аминомалонового эфира. Вторичные амины и соединения с подвижным водородом у С-атома конденсируют с формальдегидом. Образующиеся третичные амины также легко реагируют с аминомалоновым и циануксусным эфирами, как и галоидалкилы (см. например синтез триптофана). Можно проводить конденсацию между диметиламином, формальдегидом и ацетиламиномалоновым эфиром. В полученном соединении диметиламин легко замещается на другие группы, так, например, при реакции с цианистым натрием с последующим омылением получают аспарагиновую кислоту.
COOR COOR
\ I
(СН3)2 NH+HCOH+HC—NHCOCH3 -* (СН3)2 NCH2—С—NHCOCH3
/ I
COOR COOR
NH2
NaCN H20 I
„ > (CH3)2 NH+HOOC—СН2—СН—соон
Аналогично используют циануксусный и нитромалоновый эфиры, но их применяют менее широко.
I. ROOC—СН2—CN ROOC—С—CN -* ROOC—СН—CN-+
II I
NOH NHNa; RBr, НЮ ROOC—СН—CN R—СН—СООН
I I
NHA с NH2
R
I\a, RBr j H2, H20
] I ROOC — CH—COOR -— ? ROOC—C—COOR ? R—CH—COOHL
I / I
NO™ NO- NH2
В 1940 г. В. В. Феофилакгов предложил оригинальный путь синтеза аминокислот из ацетоуксусного эфира, основанный на его способности реагировать с диазосоединениями. Алкил- или арилацетоуксусный эфир обрабатывают арилдиазотатом и тотчас же подвергают кислотному расщеплению. Образующееся азопроизводное изомеризуется в гидразон кетокислоты, который восстанавливают до аминокислоты и анилина.
кон
СН3СОСН (R) COOCaHa+CeHsNaOK-CHgCOC (R) СООС2Н5
N=NC6H5
н2*СН3СООН + C2HS0H+RC—СООН ? RCH—COOH+NH2C6H5
il 1
N—NHC6H5 NH2
Реакция была проверена на большем числе примеров. Особенно успешно она проходит с соединениями ароматического ряда.
Ароматические аминокислоты можно получать с достаточно хорошими выходами, пользуясь вариантами реакции Перкина — кротоновой конденсацией. Самым распространенным из них является так называемый азлактоновый метод, разработанный Эрленмейером.
При конденсации ароматических альдегидов с ацилглицином (чаще всего пользуются гиппуровой кислотой) в присутствии уксусного ангидрида и безводного ацетата натрия образуется 2-фенил-4-арилиден-5-ок-сазолон (азлактон), который при восстановлении и гидролизе превращается в аминокислоту.
СбН5СОН+СН2—СООН+ (СН3СО)2 O+CHgCOONa - С6Н5СН-С—СО
I 1 I
NHCOC6H5 N О —
V I с
I
СбН5
Нг; Н20
> у С6Н5СН2—СН—СООН
I
NH
Реакция основана на подвижности метиленовой группы. В настоящее время доказано, что на первой стадии реакции происходит циклизация ацилглицина под действием уксусного ангидрида в 2-арилоксазолон,
СН2—СООН СН2—СО
I I I
NHCOC6H5+(CH3CO)2 О - N О
Ч/ С—СбН5
обладающий активной метиленовой группой, которая взаимодействует •с альдегидами.
У0 CHsCOONd
С6Н3-С + СН2—СО - С6Н5СН=С—СО
\ I ! 11
Н N О NO
\ / V/ U
С—СбНб С—СбНв
Картером и рядом других авторов было показано, что реакция может идти и с алифатическими альдегидами, но выходы аминокислот в этих случаях незначительны. Тот же принцип использования подвижности метиленовой группы лежит в основе синтеза ароматических аминокислот путем конденсации альдегидов с дикетопиперазинами, гидантоинами и другими соединениями, имеющими подвижный атом водорода. Ниже представлена схема подобных реакций.
CO~NH
>СН2 XNH—СО
СО—NH
1. АгСНО+СЧ2
ArCH2CHCCCrL I / ч
Вопрос 61
Количественное определение висмута нитрата основного. Дать обоснование оптимальных условий титрования. В чем отличие методики определения от других препаратов (кальция, магния)?
Соединения висмута, вводимые внутрь путем инъекций, очень токсичны, так как образуют прочные химические связи с тиоловыми группами биогенных соединений, например ферментов: Bi(SR)3. При попадании в пищеварительный тракт соединения практически безвредны даже в больших количествах. Это объясняется малой растворимостью основных солей висмута, например BiOHS04. Препараты висмута применяются внутрь при желудочно-кишечных заболеваниях, связанных с накоплением соединений серы в кишечнике, которые, взаимодействуя с солями висмута, образуют не растворимый в кислотах и щелочах висмута сульфид Bi2S3. Из неорганических ЛС висмута фармакопейным препаратом является висмута нитрат основной.
Количественное определение.
Поскольку состав образующихся при гидролизе основных солей висмута непостоянен, применение гравиметрического и объемного методов для количественного определения дает, как правило, недостаточно точные результаты.
В ГФ для количественного определения висмута нитрата основного принят комплексонометрический метод (трилонометрический, хелатометрический), где в качестве титранта служит раствор трилона Б — динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА):
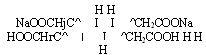
В качестве индикатора можно использовать пирокатехиновый фиолетовый (катехиновый фиолетовый, пирокатехинсульфофталеин) или ксиленоловый оранжевый (трифенилметановые красители). Титрование проводят в присутствии азотной кислоты. В процессе титрования титрант Ка2Н2ЭДТА связывает ионы висмута, образовавшиеся при растворении препарата в азотной кислоте, в комплексное соединение:
Ка2Н2ЭДТА + Bi(N03)3 — Ка[В1ЭДТА] + 2HN03 + NaN03
Вблизи точки эквивалентности окраска раствора изменяется от синей до желтой (пирокатехиновый фиолетовый) или от красной до желтой (ксиленовый оранжевый).
Выделяющаяся азотная кислота не мешает титрованию, так как соли висмута количественно взаимодействуют с Na2H23flTA при рН 2—4. Комплексное соединение висмута (Ш) с металлохромными индикаторами имеет меньшую константу устойчивости, чем комплекс Bi (III) с ЭДТА. Поэтому в эквивалентной точке, когда комплекс с индикатором полностью разрушен, а висмут (Ш) связан с гексадентатным лигандом (ЭДТА), выделяется свободный индикатор и окраска раствора меняется.
Вопрос 63
Привести примеры окислительно-восстановительных методов, которые можно применить для количественного определения йодидов в присутствии кальция хлорида. Написать схемы химических реакций.
К ЛС р-элементов VII группы ПСЭ относятся препараты галогенов и препараты галогенидов. К препаратам галогенов относят препараты йода.
Количественное определение. Для количественного определения йода точную его навеску растворяют в растворе йодида калия и титруют тиосульфатом натрия, применяя в качестве индикатора крахмал (до исчезновения синей окраски):
h + KI — К[13]
K[I3] + 2Na2S203 — KI + 2NaI + Na2S406
Для определения точки эквивалентности целесообразно использовать также метод потенциометрического титрования.
При определении количества йода в растворе йода спиртовом 10 % (титрование тиосульфатом натрия) ГФ рекомендует определять и количество йодистоводородной кислоты (HI), которая может образоваться при побочных реакциях окисления этанола. Для этого обесцвеченный после титрования тиосульфатом раствор титруют раствором щелочи (индикатор — фенолфталеин).
Йодиды нельзя определять методом Мора, так как происходит соосаждение хромата с осадком Agl. Поэтому при определении йодидов применяют адсорбционные индикаторы — динатриевые соли флуоресцеина или эозина. По мере титрования йодида раствором AgN03 образуется коллоидный осадок Agl, частицы которого обладают большой адсорбционной способностью. В точке эквивалентности их заряд меняется на положительный:
«AgI • хГ + (х + y)Ag+ —(п + x)AgI • yAg+,
и они адсорбируют на своей поверхности отрицательно заряженные анионы индикаторов. При этом в эквивалентной точке происходит изменение цвета поверхности осадка от желтого до розового.
Вопрос 74
Предложите реакции подлинности и метод количественного определения меди сульфата 5% - 200мл.
Привести соответствующие реакции и формулы для расчета массы эквивалента и содержания лекарственного вещества в г/мл.
Натрия бромид. Часть раствора на графитовой палочке вносят в бесцветное пламя. Пламя окрашивается желтый цвет.
Калия бромид. 1. К 5—6 каплям раствора прибавляют 5—6 капель раствора винной кислоты, 2—3 капли раствора натрия ацетата, 5—6 капель 96% этанола и охлаждают. Постепенно образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.
2. К 1—2 мл раствора прибавляют по 2—3 капли разведенной уксусной кислоты, и раствора натрия кобальтинитрита. Образуется желтый кристаллический осадок. I
Количественное определение. 1. Титруют 5 мл 0,25%, 2 мл 0,5%, 1 мл 1% или 0,5 мл 3% раствора 0,1 моль/л раствором серебра нитрата до оранжево-желтого окрашивания (индикатор — хромат калия).
1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,01029 г натрия бромида или 0,0119 г калия бромида.
2. К 5 мл 0,25%, 2 мл 0,5%, 1 мл 1% или 0,5 мл 3% раствора прибавляют воды пипеткой точно до объема 10 мл (раствор А). К 1 мл раствора А добавляют 5 мл воды, 2 капли разведенной азотной кислоты, 2 капли раствора дифенилкарбазона, титруют 0,01 моль/л раствором ртути перхлората до перехода желтой окраски в розовато-фиолетовую.
1 мл 0,01 моль/л раствора ртути перхлората соответствует 0,001029 г натрия бромида или 0,00119 г калия бромида.
ПРОПИСЬ 186. Натрия бромида 2 г Магния сульфата 5 г Раствора глюкозы 20% 200 мл
Определение подлинности. Натрия бромид (смотри пропись 185).
Магния сульфат. 1. К 0,5 мл раствора прибавляют по 5—6 капель растворов аммония хлорида и натрия фосфата, 3—4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте.
2. К 0,5 мл раствора прибавляют 5—6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
Глюкоза (см. пропись 180).
Количественное определение. Натрия бромид-К 1 мл раствора прибавляют 1—2 капли раствора бром-фенолового синего, по каплям разведенную уксусную кислоту зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,01029 г натрия бромида.
Магния сульфат. К 1 мл раствора прибавляют Ю мл воды, 5 мл аммиачного буферного раствора, 0,02 г индикаторной смеси кислотного хром-черного специального и титруют 0,05 моль/л раствором трилона Б до синего окрашивания.
1 мл 0,05 моль/л раствора трилона Б соответствует 0,01232 г магния сульфата.
Глюкоза. Определяют показатели преломления раствора (п) и воды (п0) при 20°С.
Концентрацию глюкозы (X) в процентах вычисляют по формуле:
п — (пр 4- 0,00134- С,+ 0,000953- С2)]-100-1,11 _ 0,00142-100
где 0,00134 — фактор показателя преломления 1% раствора натрия бромида; Ci— концентрация натрия бромида в растворе, определенная химическим методом, %; 0,000953— фактор показателя преломления 2,5% раствора магния сульфата; С2 — концентрация магния сульфата в растворе, определенная химическим методом, %, 1Д1 — коэффициент пересчета на водную глюкозу при содержании 10% влаги в препарате; 0,00142 — фактор показателя преломления раствора безводной глюкозы.
ПРОПИСЬ 187. Раствора натрия бромида 2% 200 мл Барбитал-натрия 2 г Кофеина-бензоата натрия 1 г
Определение подлинности. Натрия бромид (см. пропись 185).
Барбитал-натрий. К 0,5 мл раствора прибавляют 2—3 капли раствора кобальта нитрата. Образуется фиолетовый осадок, быстро переходящий в синий.
Кофеин-бензоат натрия. 1. К 1 мл раствора прибавляют 2—3 капли раствора танина. Образуется белый осадок, растворимый в избытке реактива.
2. Выпаривают 2 мл раствора в фарфоровой чашке на водяной бане. К сухому остатку прибавляют по 10 капель Разведенной соляной кислоты и пергидроля и вновь выпаривают на водяной бане. После охлаждения к сухому остатку добавляют 2—3 капли раствора аммиака. Появляйся пурпурно-красное окрашивание.
Количественное определение. Натрия бромид (см пропись 186).
Барбитал-натрий. Титруют 2 мл раствора 0,1 моль/л раствором соляной кислоты до красного окрашивания (индикатор — метиловый красный).
1 мл 0,1 моль/л раствора соляной кислоты соответствует 0,02062 г барбитал-натрия.
Кофеин-бензоат натрия. К оттитрование жидкости (см. «Определение барбитал-натрия») прибавляют 2—3 мл эфира и взбалтывают. Затем добавляют 2 капли раствора метилового оранжевого и 1 каплю раствор метиленового синего и титруют 0,1 моль/л раствором соляной кислоты при взбалтывании до фиолетового окрашивания водного слоя, сходного по окраске с таковым в контрольном опыте.
1 мл 0,1 моль/л раствора соляной кислоты соответствует 0,02322 г кофеина-бензоата натрия.
ПРОПИСЬ 188. Раствора натрия бромида 3% 200 мл Амидопирина Барбитал-натрия по 2 г
Определение подлинности. Натрия бромид. К 3— 4 каплям раствора прибавляют 2 капли раствора меди сульфата, 0,5 мл концентрированной серной кислоты. Появляется черное окрашивание.
Амидопирин. К 0,5 мл раствора прибавляют 1 мл раствора серебра нитрата. Появляется сине-фиолетовое окрашивание.
Барбитал-натрий (см. пропись 187).
Количественное определение. Натрия бромид.] К 0,5 мл раствора прибавляют 1—2 капли раствора бромфенолового синего и далее определяют по методике, описанной в прописи 186.
Список использованной литературы
1. Анализ лекарственных форм, изготовляемых в аптеках. – М., Медицина, 2009.