
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Доклад: Свойства дикарбоновых кислот и их ангидридов
Доклад: Свойства дикарбоновых кислот и их ангидридов
Свойства и получение дикарбоновых кислот и их ангидридов
2009 г
Дикарбоновыми
(или по-другому двухосновными) называют карбоновые кислоты, которые содержат
две карбоксильные группы: ![]() .
.
Двухосновные кислоты – бесцветные кристаллические вещества, в заметной степени растворимые в воде. Они обладают более кислотными свойствами, чем одноосновные кислоты.
Методы получения дикарбоновых кислот
Наиболее распространенным способом синтеза высших двухосновных кислот является окисление циклических кетонов. Также высшие дикарбоновые кислоты можно получать из тетрахлоралканов. Требуемые галогеналканы синтезируют по реакции теломеризации из этилена и четыреххлористого углерода. Кислоты с четным числом углеродных атомов в скелете могут быть получены электролизом солей кислых эфиров низших двухосновных кислот.
Свойства дикарбоновых кислот
Двухосновные карбоновые кислоты проявляют свойства, характерные для одноосновных кислотам – они образуют соли, сложные эфиры, хлорангидриды и амиды. Помимо этого, они способны вступать в специфические реакции, например, образование циклических ангидридов, двух различных рядов сложных эфиров (кислых и полных) и смешанных производных.
![]()
![]()
Дикарбоновые
кислоты имеют две константы диссоциации, соответствующие каждой из двух
карбоксильных групп. С увеличением количества углеродных атомов между группами ![]() и
и![]() становятся практически
равными и стремятся к
становятся практически
равными и стремятся к![]() соответствующей одноосновной
кислоты. Однако, когда карбоксигруппы расположены рядом, их константы
существенно отличаются друг от друга. Это обусловлено тем, что когда отрывается
первый протон, молекула становится заряженным ионом, и ей уже гораздо сложнее
отдать второй атом водорода.
соответствующей одноосновной
кислоты. Однако, когда карбоксигруппы расположены рядом, их константы
существенно отличаются друг от друга. Это обусловлено тем, что когда отрывается
первый протон, молекула становится заряженным ионом, и ей уже гораздо сложнее
отдать второй атом водорода.
По физическим свойствам двухосновные кислоты подобны одноосновным. Это кристаллические вещества с высокими температурами плавления. Одной из особенностей дикарбоновых кислот является то, что кислоты с четным числом углеродных атомов плавятся при более высоких температурах, нежели с нечетным (стоит заметить, что с удлинением углеродной цепи разница в температурах постепенно уменьшается). Низшие гомологи хорошо растворяются в воде. Так же, как и монокарбоновые кислоты, двухосновные кислоты способны образовывать межмолекулярные водородные связи.
Отдельные представители и их свойства
1. Щавелевая (этандиовая) кислота HOOC–COOH.
Эта кислота очень распространена в растительном мире – в виде солей она содержится в листьях щавеля, кислицы, ревеня и т.д. Соли и эфиры это кислоты имеют тривиальное название – оксалаты (от греч. «oxalis» – щавель).
В промышленности щавелевую кислоту получают из формиата натрия:
![]()
![]()
![]()
Щавелевая кислота – одна из самых сильных карбоновых кислот, далеко превосходящая по силе свои гомологи.
Этандиовая кислота проявляет восстановительные свойства: в подкисленном растворе перманганата калия она окисляется до оксида углерода(IV) и воды.
При нагревании в присутствии серной кислоты происходит декарбоксилирование, и получается оксид углерода(IV) и муравьиная кислота:
Качественной реакцией на оксалат-ион является образование нерастворимой соли кальция:
![]()
Щавелевая кислота используется для полировки металлов, в деревообрабатывающей промышленности, при очистке урана
2. Малоновая (пропандиовая) кислота.
![]()
Эта кислота содержится в соке сахарной свеклы в виде кальциевой соли. В промышленности ее получают из хлоруксусной кислоты через промежуточную стадию – цианоуксусную кислоту, которая потом гидролизуется в малоновую.
![]()
Интересным
свойством малоновой кислоты является способность образовывать недокись углерода
![]() при обезвоживании
фосфорным ангидридом
при обезвоживании
фосфорным ангидридом![]() . Это вещество (
. Это вещество (![]() ) является своеобразным
ангидридом пропандиовой кислоты.
) является своеобразным
ангидридом пропандиовой кислоты.
Еще одна ее особенность – декарбоксилирование при нагреве до 135℃, в результате чего образуется уксусная кислота.
Диэтиловый эфир этой кислоты имеет очень большое значение в промышленности – из него синтезируют различные лекарственные вещества, например барбитураты.
3. Янтарная (бутандиовая) кислота.
![]()
Основным отличием этой кислоты от предыдущих членов ряда является способность образовывать циклические производные – ангидриды и имиды. При длительном нагревании или при обезвоживании уксусным ангидридом эта кислота дает янтарный ангидрид, обладающий обычными свойствами ангидридов кислот. Например, при его взаимодействии с аммиаком получается имид (сукцинимид).
Впервые эта кислота была выделена из продуктов сухой перегонки янтаря, откуда она и получила свое название. Соли и эфиры этой кислоты носят название сукцинаты – от латинского «succinum» – янтарь. Янтарная кислота является промежуточным продуктом обмена веществ. Она применяется в текстильной и фармацевтической промышленности, в производстве инсектицидов, а так же смол и фотоматериалов.
4. Глутаровая (пентандиовая) кислота.
![]()
Впервые эта кислота была получена из глутаминовой аминокислоты, а та получила свое название от латинского «gluten» – клей, поскольку была найдена в клейковине пшеницы.
Эта кислота, как и янтарная, способна образовывать при нагревании циклический ангидрид.
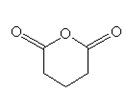
5. Адипиновая (гександиовая) кислота
![]()
Эта кислота образуется при окислении жиров и получила свое название от латинского «adeps» – жир, сало.
При нагревании эта кислота не образует ангидрида.
В промышленности эту кислоту получают, главным образом, путем окисления циклогексанола 50% азотной кислотой в присутствии медно-ванадиевого катализатора.
Большинство этой кислоты в промышленности идет на изготовление нейлона. Так же, благодаря кислотным свойствам, гександиовую кислоту используют для удаления накипи с эмалированной посуды.
6. Бутендиовая кислота
Это простейшая непредельная дикарбоновая кислота. Она существует в виде двух стереоизомеров – цис-изомера и транс-изомера – малеиновой и фумаровой кислот.
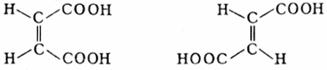
Эти кислоты отличаются друг от друга по физическим свойствам – имеют разные температуры плавления, кипения, значения констант диссоциации и т.д. Малеиновая кислота при нагревании легко дегидратируется, давая циклический ангидрид. Он используется при производстве пластмасс. Фумаровая же кислота не образует ангидрида из-за удаленности в пространстве друг от друга карбоксильных групп.
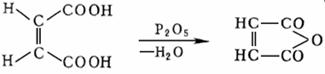
В природе малеиновая кислота не существует. Она получается при каталитическом окислении бензола кислородом воздуха, причем сначала образуется малеиновый ангидрид, который затем гидролизуется в кислоту.
Фумаровая же кислота, напротив, широко распространена в природе, она содержится в грибах, лишайниках и высших растениях, например дымянке. Транс-бутендиовая кислота участвует в биохимических процессах. В промышленности ее получают изомеризацией малеиновой кислоты при нагревании или УФ-облучении. Эта реакция свидетельствует о большей энергетической устойчивости фумаровой кислоты.
Оба изомера используются в промышленности для производства пластических масс и лакокрасочных материалов. Благодаря своему кислому вкусу фумаровая кислота используется в качестве вкусовой добавки к пищевым продуктам.
7. Фталевая (бензол -1, 2‑дикарбоновая) кислота
В промышленности эту кислоту получают гидролизом фталевого ангидрида, который в свою очередь образуется при каталитическом окислении ортоксилола или нафталина кислородом воздуха.
При нагревании фталевая кислота легко отщепляет воду и образует фталевый ангидрид.
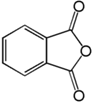
Именно он, а не сама кислота, служит источником для получения различных производных фталевой кислоты. Более половины производимого в мире ангидрида расходуется на получение средних(полных) эфиров фталевой кислоты. Эти эфиры добавляют в качестве пластификаторов к поливинилхлориду с целью придания эластичности изделиям из него. Диметилфталат используется как средство, отпугивающее гнус.
Из фталевого ангидрида так же получают фенолфталеин – индикатор щелочной среды в аналитической химии. Он образуется про конденсации фталевого ангидрида с фенолом в присутствии безводного хлорида цинка.
4 Ангидриды и их свойства
Не все дикарбоновые кислоты способны образовывать ангидриды. Так, высшие двухосновные кислоты не имеют таких циклических функциональных производных. Циклические ангидриды образуют только малеиновая, фталевая, глутаровая и янтарная кислоты.
Свойства ангидридов дикарбоновых кислот похожи на свойства ангидридов монокарбоновых кислот: при гидролизе они превращаются в кислоты, при добавлении аммиака переходят в имиды соответствующих кислот.
Список литературы
1) Начала органической химии. А.Н. Несмеянов, Н.А. Несмеянов, издательство «Химия», 1969 г.
2) Органическая химия. Н.А. Тюкавкина, издательство «Медицина», 1998 г.
3) Основы органической химии. Г. Тейлор, издательство «Мир», 1989 г.
4) Курс органической химии. Е.И. Ардашникова, издательство «Аквариум» 1998 г.